紫色薯蓣块茎外植体组培快繁研究
2015-01-20朱海萍李会宁陕西理工学院生物科学与工程学院陕西省资源生物重点实验室陕西汉中723001
朱海萍,李 彪,李 康,李会宁 (陕西理工学院生物科学与工程学院,陕西省资源生物重点实验室,陕西汉中 723001)
紫色薯蓣块茎外植体组培快繁研究
朱海萍,李 彪,李 康,李会宁*(陕西理工学院生物科学与工程学院,陕西省资源生物重点实验室,陕西汉中 723001)
[目的] 利用紫色薯蓣块茎外植体开展组培快繁研究,筛选其最佳快繁条件。 [方法]以紫色薯蓣块茎为外植体,于添加不同激素配比的MS培养基中诱导愈伤组织、不定芽和不定根,探讨植株再生与快繁条件。[结果] 适宜块茎外植体愈伤组织诱导培养基为MS+6-BA 1.0 mg/L+NAA 0.2~0.5 mg/L,诱导率达94.2%;丛生芽诱导培养基为MS+6-BA 1.0 mg/L+NAA 0.1~0.2 mg/L+GA 1.0 mg/L,诱导率为89.7%;生根培养基为1/2MS+IBA 0~1.0 mg/L+GA 0~1.0 mg/L,生根率为91.1%;沙土移栽紫色薯蓣组培苗效果较好,成活率达94%。[结论]采用低浓度激素配比,获得了紫色薯蓣块茎外植体较高的诱导率和分化率;研究结果丰富了紫色薯蓣外植体离体无性系建立的研究资料,并可应用于生产实践。
紫色薯蓣;组织培养;快繁
紫色薯蓣(DioscoreaalataL.′purple′),又名紫山药、紫莳药、紫淮山,是薯蓣科薯蓣属草本蔓生性植物[1],其作为绿色保健蔬菜逐渐在浙江、江苏、福建、江西等地区推广种植[2-3]。其薯形不一,薯皮褐色或紫褐色,薯肉多为亮丽的紫色。目前,关于紫山营养成分药的研究较多[2-6],紫山药营养价值高[3],含有多种矿质元素、维生素和胆碱,富含薯蓣皂苷元[2-4];紫山药中的主要功能成分为多糖、薯蓣皂甙、尿囊素以及花青素等[2-3,5]。紫山药是一种低脂肪、低热量、高蛋白、高膳食纤维和矿物元素含量丰富的天然绿色食补健康食品,也是一味名副其实的具有滋补作用的上等药材[2];具有滋肺益肾、健脾止泻、降压利肝等作用[1,5],可增加人体抵抗力,调节血压、血糖,能抗衰益寿等,现已列入“抗癌中草药大辞典”[5]。有关“薯蓣”资源的组织培养研究已有报道[7-16],但关于紫色薯蓣的组培报道较少。韩晓勇等[4]利用“台州紫山药”开展了试管薯诱导体系的研究;王碧琴等[7-8]对紫山药茎尖、茎段外植体培养及培养过程中的褐化问题进行探究。紫山药的繁殖主要是通过块茎繁殖和组培快繁[4]。笔者利用紫色薯蓣块茎外植体开展组培快繁研究,筛选其最佳快繁条件,以促进紫山药人工种植产业的发展。
1 材料与方法
1.1 材料供试材料于2011年11月采购于甘肃省兰州市栽培的紫色薯蓣块茎(图1-1)。
1.2 方法
1.2.1外植体消毒。取紫色薯蓣块茎,清洗表面后,自来水冲洗4~6 h;切去外围组织,75%乙醇消毒25~30 s,无菌水冲洗1次,0.2%升汞消毒15~16 min,无菌水冲洗3~4次。
1.2.2愈伤组织诱导。将消毒后外植体切成约0.5 cm的小块,每瓶接种1~2个外植体于初筛选的附加Na2S2O35.0 mg/L与6-BA(1.0、2.0 mg/L)、NAA(0.2、0.5 mg/L)和2,4-D 0.5 mg/L组合的MS基本培养基上,以确定愈伤组织诱导培养基。
1.2.3增殖与分化培养。将诱导产生的愈伤组织分割成约0.5 cm的小块,转接到初筛选的附加Na2S2O35 .0mg/L与6-BA(1.0、2.0 mg/L)、NAA(0.1、0.2 mg/L)和GA 1.0 mg/L组合的MS基本培养基上,以确定增殖分化培养基。
1.2.4生根培养。将长至3~5枚幼叶的外植体,分别转入初筛选的添加6-BA(0~1.0 mg/L)、NAA(0~0.5 mg/L)、IBA 0~0.5 mg/L与GA 0~1.0 mg/L组合的1/2MS培养基中,以确定生根培养基。
1.2.5练苗与移栽。当根2~3条,苗高3 cm以上,绿叶1片以上即可移栽。移栽前,练苗2~3 d后,取出试管苗,洗去根上附着的培养基;将试管苗移栽到沙土或腐殖土的苗盘上;30 d后调查成活率。
1.2.6培养条件。以MS为基本培养基,添加蔗糖30 g/L,琼脂条12.5 g/L,pH 5.8;培养温度为25~28 ℃,相对湿度为60%~85%,光照强度为40 μmol/(m2·s),辅助光照时间为12~14 h/d。
1.3 数据统计统计每种培养基中愈伤组织形成的外植体数及诱导率,生芽的愈伤组织株数及诱导率,生根苗数和生根率等。愈伤诱导率=产愈伤组织外植体数/接种数×100%;不定芽诱导率=产芽愈伤组织块数/接种数×100%;生根率=生根苗数/接种数×100%。
2 结果与分析
2.1 防褐变处理试验发现紫色薯蓣在组培过程中存在严重的褐变现象,紫色薯蓣组培苗或外植体枯死及其基部培养基黑褐化。此褐化现象又称为酚污染,严重影响外植体的脱分化和培养物的再分化[10]。由此可知,材料消毒要根据外植体幼嫩程度适当增减灭菌时间,对外植体进行连续转移,在培养基中加入适当浓度的Na2S2O3可减轻褐变程度。
2.2 愈伤组织诱导紫色薯蓣外植体经处理后,接种于不同激素配比的愈伤组织诱导培养基中,培养10 d后,部分外植体切口处有少量愈伤组织形成,表面淡紫色,其中MS+6-BA 1.0 mg/L+NAA 0.2 mg/L培养基上形成的愈伤组织较为明显;20 d后,各培养基中的外植体均有不同程度的愈伤组织形成和增生;30 d后发现,MS+6-BA 1.0 mg/L+NAA 0.2 mg/L和MS+6-BA 2.0 mg/L+2,4-D 0.5 mg/L有利于愈伤组织诱导,形成的愈伤组织为1~2 mm的淡紫色小颗粒状突起,其中6-BA 1.0 mg/L+NAA 0.2 mg/L 培养基的愈伤组织诱导率达94.2%(表1,图1-2、3)。

表1 不同激素组合的 MS 培养基对愈伤组织诱导的影响
2.3 分化与增殖培养将紫色薯蓣块茎外植体诱导产生的愈伤组织块分割后,转接于不同激素组合的增殖与分化培养基中,其中MS+6-BA 1.0 mg/L+NAA 0.2 mg/L+GA 1.0 mg/L培养基有利于增殖和不定芽分化培养,诱导率达89.7%。培养10 d后,愈伤组织增生,颜色转变为绿色到深绿色,呈瘤状愈伤组织群,表面有丛生芽原基分化;30 d后不定芽生长、增生,芽长0.5~1.5 cm,生长势强;42 d后,芽苗产生1~3片幼叶,色浅绿,苗高1.0~3.0 cm,且长势较好(表2,图1-4、5)。
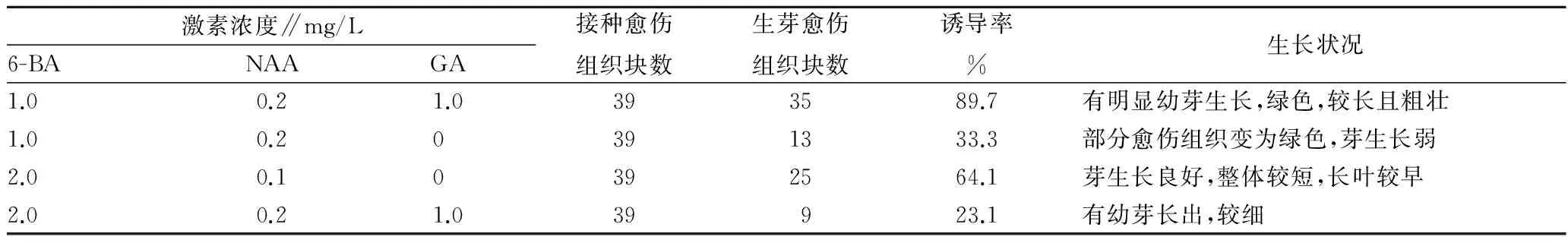
表2 不同激素配比的MS培养基对不定芽诱导的影响
2.4 生根培养将培养产生的丛生芽苗分割后,转接于生根培养基中培养,各培养基诱导生根有差异。1/2MS+IBA 0.5 mg/L+GA1.0 mg/L培养基易于诱导生根。10 d后,部分幼苗即有不定根产生;15 d后,多数幼苗产生不定根;20 d后,幼苗均产生不定根,且不定根数量增多,根数在8~15条;30 d后,诱导苗生根10~20条,根长2~5 cm,根系发达,植株长势良好,其生根诱导率达91.1%。壮苗后转接于1/2MS培养基,生根培养表现良好,50 d后部分外植体上产生棒状的小块茎,直径约2 mm,且随着植株不断增大,90 d后小块茎直径6~9 mm;150 d后,多数芽苗基部及茎节上产生直径0.5~1.5 cm 零余子(表3,图1-6~11)。
2.5 炼苗和移栽为提高成活率,先透气炼苗后取出试管苗,用清水洗去根系上的培养基,置1 000倍KMnO4溶液中浸泡10 min后清水洗净,将试管苗分别植入浇透水的沙土、腐殖土苗盘中,用塑料薄膜保湿,并控制相对湿度80%~85%,温度25 ℃左右,喷水1~2次/d。以沙土为基质的试管苗移栽15 d左右,移栽苗开始逐渐生长;30 d后成活率为94%,根多且粗白,茎叶生长旺盛,外观性状与母株一致;以腐殖土为基质,试管苗移栽30 d后成活率为78.0%(图1-12)。沙土移栽效果较好。
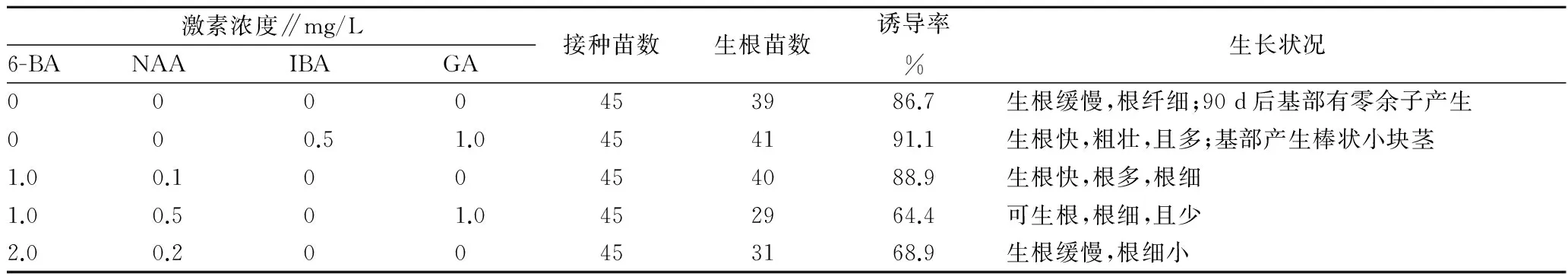
表3 不同培养基诱导生根培养结果
3 讨论
在薯蓣外植体组织培养过程中,褐变是一个普遍而严重的问题。王碧琴等[7-8]报道了紫山药组培中的褐变问题;谢碧霞等[11]报道盾叶薯蓣块茎组织在培养基上会逐渐褐变,这种褐变状况将维持50~60 d,在继代培养也有褐变现象;穿龙薯蓣的愈伤组织培养过程中也出现严重的褐变现象[12]。褐变是由于外植体组织被切割和接种快繁时,损伤切面细胞中酚类物质与酚氧化酶发生氧化反应,形成有毒的醌类物质;而紫色薯蓣细胞组织含有极高量的酚类物质。外植体褐变,并扩散至培养基中,抑制其他酶活性,导致组织代谢紊乱,生长受抑制,最终致使外植体死亡[13-14]。影响组培过程中的褐变因素较多,如培养基成分、高浓度激素、外植体中所含的酚类物质等,尤其是后者。在防褐变方面,不同研究者于培养基中添加AC或一定量的抗氧化剂VC,PVP,Cys,Na2S2O3等[7,13-14,17-18],所产生的效果也表现出明显的差异,但同时也对外植体生长产生影响。该试验针对褐变,考察毒性和应用性,在培养基中加入Na2S2O35.0 mg/L以抑制紫色薯蓣组培褐变,有一定的效果。
该试验表明,不同类型和不同浓度的植物激素对紫色薯蓣块茎外植体愈伤组织诱导效果存在差异。GA 在芽苗生长中的主要作用是促进茎的伸长生长[19]。适宜紫山药块茎愈伤组织诱导、丛生芽增殖和生根的培养基分别为 MS+6-BA 1.0 mg/L+NAA 0.2 mg/L,MS+6-BA 1.0 mg/L+NAA 0.1~ 0.2 mg/L+GA 1.0 mg/L和1/2MS+IBA 0~0.5 mg/L+GA 0~1.0 mg/L。该研究结果与梁艳丽等[9]、潘学峰等[10]、罗凤霞等[12]、王军等[15]、黄凤翔等[16]的研究结果相比,其外植体类型、激素种类和浓度有一定差异。薯蓣相关的组培研究较多,但该研究采用低浓度激素配比,获得了紫山药块茎外植体较高的诱导率、分化率和部分小块茎的产生,同时也补充了外植体的类型。研究结果可丰富紫山药外植体离体培养无性系建立的研究资料,并可应用于生产实践。
随着人们生活水平的提高和保健意识的增强,目前市场对紫色薯蓣的需求不断增长。但紫色薯蓣的人工栽培技术还未被广泛推广,良种繁育和种苗源匮乏是制约紫色薯蓣资源利用的瓶颈。该研究结果提供了一种简单、实用的紫色薯蓣试管快速繁殖技术,有助于其人工种植产业的发展。
[1] 赵冬兰,唐君,刘靖,等.紫山药的引种与标准化栽培技术初探[J].江西农业学报,2009,21(2):78-79.
[2] 刘影,史姗姗,汪财生.浙江紫山药营养成分及薯蓣皂苷元含量测定[J].安徽农业科学,2010,38(9):4563-4564,4567.
[3] 宋曙辉,刘庞源,王文琪,等.不同产地紫山药营养和功能成分分析[J].营养学报,2012,34(1):92-93,96.
[4] 韩晓勇,闫瑞霞,殷剑美,等.‘台州紫山药’试管薯诱导体系研究[J].园艺学报,2013,40(10):1999-2005.
[5] 倪勤学,高前欣,霍艳荣,等.紫山药色素的提取工艺及抗氧化性能研究[J].天然产物研究与开发,2012,24(2):229-233.
[6] 于东,林跃伟,陈桂星,等.紫山药营养成分分析研究[J].营养学报,2010,32(2):190-192.
[7] 王碧琴,朱祺,刘腾云,等.紫山药组织培养及褐化因素的研究[J].江西科学,2014,32(1):43-44.
[8] 王碧琴,周华,朱祺,等.紫山药组织培养快繁技术研究[J].江苏农业科学,2014,42(11):48-50.
[9] 梁艳丽,赵庆云,谢世清.盾叶薯蓣组培快繁技术研究[J].长江农业学报,2010(2):10-12.
[10] 潘学峰,王小精.墨西哥菊叶薯蓣离体快繁技术研究[J].海南大学学报:自然科学版,2007,25(2):163-168.
[11] 谢碧霞,何业华,易志军.盾叶薯蓣愈伤组织培养及其高产系的筛选[J].中南林学院学报,1999,19(4):18-20.
[12] 罗凤霞,祝朋芳,周广柱,等.穿龙薯蓣的组织培养研究[J].沈阳农业大学学报,2004,35(1):4-6.
[13] 蔡建荣.山药茎段愈伤组织褐变与外源药物抑制效应的研究[J].浙江农业科学,2008(5):523-525.
[14] MAYER A M.Polyphenol oxidase in plants-resent progress [J].Phytochemistry,1987,26:11- 20.
[15] 王军,张金莲,李少峰,等.盾叶薯蓣组培诱导分化实验研究[J].云南农业科技,2006(3):23-24.
[16] 黄凤翔,管艳,梁国平,等.不同植物激素用量对菊叶薯蓣组织培养的影响[J].热带农业科技,2007,30(2):21-23.
[17] 何琼英.抗坏血酸预处理防止香蕉吸芽外植体褐变的研究初报[J].华南农业大学学报,1995,16(3):79-82.
[18] 张蓉,李向民.菊叶薯蓣组培快繁中常见的几个问题及对策[J].陕西农业科学,2010(3):89-91.
[19] 李保珠,赵翔,安国勇.赤霉素的研究进展[J].中国农学通报,2011,27(1):1-5.
Study on Rapid Propagation of Purple yaminvitro
ZHU Hai-ping, LI Biao, LI Kang, LI Hui-ning*
(School of Biological Sciences and Engineering, Shaanxi University of Technology,Shaanxi Province Key Laboratory of Bio-resources, Hanzhong, Shaanxi 723001)
[Objective] The better rapid propagation conditions were screened using purple yam as explants. [Method] The callus, adventitious bud and root were induced on MS medium with different hormones using tubers of purple yam(DioscoreaalataL. ′purple′) as explants, and the conditions of proliferation culture and plant regeneration were discussed. [Result]The results showed the suitable medium for callus induction was MS+6-BA 1.0 mg/L+NAA 0.2-0.5 mg/L, and the induction rate was 94.2%; the suitable medium for buds induction was MS+6-BA 1.0 mg/L+NAA 0.1-0.2 mg/L+GA 1.0 mg/L, and the induction rate reached 89.7%; rooting induction was easy on 1/2MS+IBA 0-1.0 mg/L+GA 0-1.0 mg/L and rooting rate up to 91.1%; sandy soil was more suitable for transplanting yam, and the survival rate reached 94%. [Conclusion] This test got the higher induction rate and differentiation rate for purple yam tuber explant, using low concentration ratio of hormones. This result provided a simple and practical technology for purple yam in virto, helping to promote the artificial planting industry.
DioscoreaalataL. ‘purple’;Tissue culture; Rapid propagation
陕西省教育厅基金项目(12JS026)。
朱海萍(1988- ),女,山东菏泽人,硕士研究生,研究方向:植物生物技术。*通讯作者,高级实验师,从事植物生物技术研究。
2015-03-30
S 632.1044.3
A
0517-6611(2015)14-022-03
