盐酸吗啉胍片对小鼠心肌细胞的毒性研究
2015-01-18王四旺谢艳华孙纪元第四军医大学药学系天然药物学教研室西安71002秦巴山区中药发展协同创新中心西安71002西安市中心医院心血管内科西安71000
郝 琦,华 菲,宋 凡,张 环,王四旺,谢艳华,孙纪元*(1.第四军医大学药学系天然药物学教研室,西安 71002;2.秦巴山区中药发展协同创新中心,西安 71002;.西安市中心医院心血管内科,西安 71000)
盐酸吗啉胍片对小鼠心肌细胞的毒性研究
郝 琦1,2,华 菲1,2,宋 凡1,2,张 环3,王四旺1,2,谢艳华1,2,孙纪元1,2*(1.第四军医大学药学系天然药物学教研室,西安 710032;2.秦巴山区中药发展协同创新中心,西安 710032;3.西安市中心医院心血管内科,西安 710003)
目的 探究盐酸吗啉胍片(ABOB)对心肌细胞的毒性。方法 将小鼠随机分为盐酸吗啉胍片高剂量组(8只)、盐酸吗啉胍片低剂量组(8只)、生理盐水对照组(8只),给小鼠灌胃给药7d后,检测小鼠血清中肌酸激酶(CK)、脑钠肽(BNP)、肌钙蛋白T(CTnT)的水平;HE染色对心脏、肾脏的病理学形态分析。同时对新生大鼠心肌细胞培养,用MTT法检测盐酸吗啉胍片对心肌细胞的抑制作用。结果 与对照组比较,盐酸吗啉胍片高剂量组、盐酸吗啉胍片低剂量组的CK水平增高,差异有统计学意义(P<0.05),BNP和CTnT水平差异无统计学意义;与对照组比较,盐酸吗啉胍片高剂量组、盐酸吗啉胍片低剂量组的心肌组织切片呈病理样改变,肾脏组织未见明显变化;与空白对照组比较,给药组心肌细胞活性受到不同程度的抑制,并随着给药剂量的增加,心肌细胞活性逐渐下降。结论 盐酸吗啉胍片对心肌细胞有一定的毒性。
盐酸吗啉胍片;肌酸激酶;脑钠肽;肌钙蛋白T;心肌细胞
2014年,全国多地曝出幼儿园擅自给孩子服用盐酸吗啉胍片,导致孩子出现许多不良反应,甚至部分幼儿出现心肌酶偏高、心肌炎等症状[1]。盐酸吗啉胍片又称病毒灵,缩写为ABOB。1999年,国家药监局对地方标准的盐酸吗啉胍片公布停用,理由是效果不确切。盐酸吗啉胍片最初是作为治疗流感的药物使用的,后来才被用来治疗病毒性传染病。查阅相关文献,盐酸吗啉胍片的不良反应比较少,毒性作用小[23]。盐酸吗啉胍片的作用机制是抑制病毒的DNA和RNA聚合酶,从而抑制病毒繁殖。但病毒的聚合酶并不与人体完全一样,抑制或杀灭病毒的药物常影响人体细胞的复制,或通过其他机制损伤人体细胞而产生毒性[4-5]。由于心肌细胞的再生能力有限,坏死灶常被结缔组织取代产生纤维化。如果盐酸吗啉胍片有心肌毒性,甚至造成心肌炎,对儿童健康损害极大[6-7]。对盐酸吗啉胍片的毒性和不良反应的说法各专家持不同态度,盐酸吗啉胍片是否会使孩子的心肌酶指标偏高、发生心肌炎等不良反应,已经成为社会关注的热点。本文通过体内药物实验和体外细胞培养实验,探讨盐酸吗啉胍片对心肌细胞的毒性作用[8-9]。
1 仪器与材料
1.1 仪器 移液枪(DT51947型,德国Eppendorf公司);酶标仪(680型,美国BIO-RAD公司);半自动生化分析仪(RT9600型,深圳雷杜生命科学股份有限公司);超净工作台(SW-CJ-1F型,苏州惠丰净化设备有限公司);CO2培养箱(HERACELL 150i型,美国Thermo Scientific公司);倒置显微镜(CKX41型,日本Olympus公司);离心机(L420型,湖南湘仪仪器有限公司)。
1.2 试药 盐酸吗啉胍片(购于太原市振兴制药有限责任公司,国药准字:H14023483);生理盐水(购于山东康宁药业有限公司,批号:G13013202);小鼠肌酸激酶试剂盒、小鼠肌钙蛋白试剂盒、小鼠脑钠肽试剂盒均购自南京建成生物工程研究所;2.5g·L-1胰蛋白酶(ShinyBio公司);10%的胎牛血清(Hyclone公司);DMEM/F-12培养基(Hyclone公司);青链霉素(genview公司);MTT(Sigma公司);二甲基亚砜(Sigma公司)。
1.3 动物 健康雌性昆明种小鼠24只,体质量20~25g,由第四军医大学实验动物中心提供,许可证号:SCXK(陕)2014-002;1~3d龄的SD大鼠7只,由第四军医大学实验动物中心提供。
2 方法
2.1 体内药物实验
2.1.1 分组与给药 将小鼠随机分为3组,每组8只,分别为:盐酸吗啉胍片高剂量组、盐酸吗啉胍片低剂量组和生理盐水对照组。给药剂量按本品临床成人口服剂量设计,采用灌胃给药,连续给药7d,每日给药时间相近[10]。
2.1.2 观察指标 给药前及给药期间每天称体质量,并按体质量调整给药量。实验期间每天观察小鼠一般状态、体征、摄食量、饮水及粪便状况。发现有中毒反应的动物应取出单笼饲养,重点观察,发现死亡或濒死动物应及时解剖[11]。
2.1.3 心肌损伤检测指标 采用酶联免疫试剂盒检测小鼠血清中肌酸激酶、肌钙蛋白和脑钠肽水平。全部小鼠眼球取血后将血液静置20min,以3 000 r·min-1离心15min,取血清,参照试剂盒说明书方法进行检测[12]。
2.1.4 病理学切片检测 处死小鼠后,立即取出心脏、肾脏,置于冷生理盐水中洗去血液,滤纸吸干水分,切片厚5μm,固定于100mL·L-1甲醛溶液中,石蜡包埋,HE染色,镜下观察。
2.1.5 统计学方法 采用Excel 2003建立数据库,采用SPSS 17.0统计分析软件进行数据处理。数据以±s表示,采用单因素方差分析,P<0.05为差异有统计学意义。
2.2 体外细胞培养
2.2.1 新生大鼠心肌细胞培养 所有手术器械高压灭菌,玻璃器材均强酸浸泡过夜,流水冲洗20遍,蒸馏水冲洗2次,烘干,高压灭菌备用。取7只1~3d龄的SD大鼠,用体积分数75%的冰乙醇浸泡5min,取出,置于培养皿中,剪开皮肤,无菌眼科剪在剑突上一肋处入剪(注意避免剪破消化道预防污染),在胸骨剑突下稍左侧打开胸腔,左手轻轻用力,心脏跃出,用眼科弯镊取心脏,剪除结缔组织。
将剪下的心脏迅速置于预冷的不含Ca2+、Mg2+的PBS中,反复冲洗3遍,洗去残留的血细胞,将其剪成0.5~1mm3的组织块,放入锥形瓶中。加入2.5 g·L-1胰蛋白酶,37℃消化10min,弃去第一次消化液,再消化2次,吸取上清液,加入适量含10%的胎牛血清的DMEM/F-12培养基,终止消化,吹打混悬液。用筛网过滤混悬液,收集滤液。将滤液以800r·min-1离心5min,弃去上清液,加入适量含10%胎牛血清的DMEM/F-12培养基,反复吹打,制成混悬液,接种于培养瓶中,置于37℃、体积分数5%CO2培养箱中培养。观察培养24,48和72h的细胞形态[13-14]。
2.2.2 铺板 观察细胞状态,待细胞处于对数生长期时,轻轻晃动,弃去培养瓶中的培养液,用2.5 g·L-1胰酶消化,待细胞变圆后,加培养液停止消化,用吸管反复吹打但不要产生泡沫,将瓶壁的细胞吹落,吹匀后进行细胞计数,经计算配成3×105个/mL细胞悬液,将细胞悬液接种于96孔板内,每孔100 μL,平行条件下铺3块板,置于37℃、体积分数5% CO2培养箱中培养。
2.2.3 给药 在超净工作台内用DMEM/F-12培养液配制2mg·mL-1母液,稀释成所需质量浓度,药液质量浓度分别为2,0.4,0.08,1.6×10-2,3.2× 10-3,6.4×10-4,1.28×10-4,2.56×10-5,5.12× 10-6,1.024×10-6和2.048×10-7mg·mL-1,每个质量浓度设置8个平行孔。观察细胞状态,待细胞大部分贴壁后,每孔加入100μL药物,空白孔加入100 μL DMEM/F-12培养液,平行条件下铺3块板,置于37℃、5%CO2培养箱中培养。
2.2.4 MTT法测定盐酸吗啉胍片的细胞毒性 将分别培养24,48和72h的96孔板取出,每孔加入质量浓度为0.5mg·mL-1的MTT 20μL,置于37℃、5%CO2培养箱中继续培养,培养4h后取出96孔板,弃去孔内MTT,每孔再加入150μL二甲基亚砜,震荡仪上震荡10min,使孔内结晶充分溶解,在490nm波长处酶标仪检测[15-16]。
2.2.5 数据处理 采用Excel 2003建立数据库,采用SPSS 17.0统计分析软件进行数据处理。数据以±s表示,采用单因素方差分析,P<0.05为差异有统计学意义。
3 结果
3.1 体内药物实验结果
3.1.1 死亡率与一般情况观察 给药期间未发现有小鼠中毒或死亡,小鼠形态、摄食、饮水均正常。模型组与对照组相比,用药前后体质量、摄食量、饮水量差异均无统计学意义。
3.1.2 小鼠血清中CK、BNP、CTnT的变化 与对照组相比,盐酸吗啉胍片高剂量组、盐酸吗啉胍片低剂量组小鼠血清中CK水平增高(P<0.05),CTnT水平和BNP水平差异无统计学意义。

表1 小鼠血清中CK、BNP、CTnT的变化Tab.1 The change of CK,BNP and CTnT in mice serum
3.1.3 病理学改变 如图1所示,小鼠心脏HE染色后,正常对照组心肌纤维排列整齐,无心肌纤维的破坏,细胞间隙正常,无水肿,心肌细胞大小无变化,横纹清晰,胞核正常;盐酸吗啉胍片高剂量组心肌细胞体积增大、水肿,局灶性心肌横纹消失,染色浅;盐酸吗啉胍片低剂量组胞浆染色较正常略淡,少数区域心肌纤维断裂,部分区域心肌纤维呈波浪状。小鼠肾脏HE染色后,正常对照组肾脏病理切片可见肾皮质和髓质结构清晰,系膜区无增生及沉积物,各级肾小管及集合管结构清晰,间质未见血管扩张、充血;盐酸吗啉胍片高剂量组可见肾小球系膜区增宽,肾血管结构不清;盐酸吗啉胍片低剂量组系膜区无增生,部分区域肾小管结构模糊[17]。

图1 盐酸吗啉胍片对小鼠心脏和肾脏病理切片的影响A.正常对照组心肌组织(HE,×200);B.盐酸吗啉胍片高剂量组心肌组织(HE,×200);C.盐酸吗啉胍片低剂量组心肌组织(HE,×200);D.正常对照组肾脏组织(HE,×400);E.盐酸吗啉胍片高剂量组肾脏组织(HE,×400);F.盐酸吗啉胍片低剂量组肾脏组织(HE,×400)Fig.1 The effects of ABOB on heart and kidney pathological section of miceA.normal control group myocardial tissue(HE,×200);B.ABOB high dose group myocardial tissue(HE,×200);C.ABOB low dose group myocardial tissue(HE,×200);D.normal control group kidney tissue(HE,×400);E.ABOB high dose group kidney tissue(HE,×400);F.ABOB low dose group kidney tissue(HE,×400)
3.2 体外细胞培养结果
3.2.1 新生大鼠心肌细胞生长的观察 如图2所示,培养24h的心肌细胞已贴壁生长,贴壁后的细胞为梭形或三角形,细胞密度较小,但分裂能力旺盛,部分心肌细胞开始出现自发性搏动,搏动频率较慢,每分钟仅数次;培养48h后,心肌细胞在瓶底铺展,细胞体积增大,并伸出伪足,形状仍以三角形和梭形为主,随着心肌细胞不断分裂增殖,细胞数目不断增多,互相连接成片,搏动次数增加;培养3d后,心肌细胞形态趋于成熟,呈梭形或柱状,细胞铺满整个皿底,相互接触,交织成网,形成细胞单层或细胞簇,其搏动趋向同步化[18-19]。
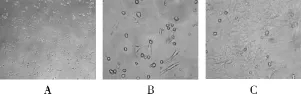
图2 不同时期心肌细胞形态A.培养24h的心肌细胞(×200);B.培养48h的心肌细胞(× 400);C.培养72h的心肌细胞(×400)Fig.2 Myocardial cell morphology in different periodsA.cultivation 24hof myocardial cells(×200);B.cultivation 48hof myocardial cells(×400);C.cultivation 72hof myocardial cells(×400)
3.2.2 盐酸吗啉胍片对心肌细胞的毒性 如图3所示,与空白对照组比较,不同质量浓度的盐酸吗啉胍片在分别培养24,48和72h后,各给药组对心肌细胞活性显示不同程度的抑制作用。培养24h,随着给药剂量的增加,心肌细胞活性逐渐下降,与空白组比较,各给药组差异均有统计学意义[20]。

图3 ABOB对心肌细胞的毒性注:与对照组相比*P<0.05Fig.3 ABOB on myocardial cell toxicity
4 讨论
盐酸吗啉胍片主要的不良反应是抗胆碱反应(便秘、出汗等),这种反应只要停药就会很快消失,但如果有心脏毒性,甚至造成心肌炎,将造成不可逆的损害。其病情轻重不一,重者可发生心力衰竭、心源性休克或猝死,疾病迁延日久可转化为扩张型心肌病。
近期,由于幼儿园违规长期给孩子喂药事件,盐酸吗啉胍片引起社会高度关注。盐酸吗啉胍片的毒性和不良反应成为被关注的热点。查阅相关文献,盐酸吗啉胍片毒性小,不良反应相对较少。相关专家指出,国内医院特别是综合医院有关儿童的心肌酶谱测定,都是参照成人心肌酶的正常值标准,按照儿科专家的临床经验,年龄越小的儿童,检测的心肌酶值越高,并且影响心肌酶谱的因素较多,如感染、进行性肌营养不良等。不能因为儿童的心肌酶增高就认为是心肌损害,还应结合临床症状、体征和其他检查结果进行综合诊断[21]。
本文先进行了体内药物实验,按本品临床用药预防2~3d设计,对小鼠灌胃给药7d,以CK、BNP、CTnT作为心肌损伤标志物,一旦小鼠心肌受损,心肌损伤标志物将从受损的心肌释放到血液中,在血液中的含量相对升高。本研究结果表明,CK的水平显著性增高,BNP和CTnT的水平没有明显变化;进一步观察心肌组织病理切片发现,盐酸吗啉胍片高剂量组的心肌细胞体积增大,部分区域心肌纤维横纹消失,盐酸吗啉胍片低剂量组部分区域心肌纤维呈波浪状;最后进行体外心肌细胞培养实验,用MTT法对心肌细胞进行细胞质量浓度、作用时间、给药剂量等优化选择,发现培养24h的心肌细胞随着给药剂量的增加,细胞活性逐渐下降;与空白对照组比较,各给药组差异均有统计学意义。综上所述,初步认为盐酸吗啉胍片对心肌细胞有一定的毒性。
本实验采用体内和体外分别对盐酸吗啉胍片的心肌毒性进行了初步研究,为了进一步验证盐酸吗啉胍片的心肌毒性及相关毒性和不良反应,还需要进行深入研究。
[1]刘霞.莫让幼儿园变成“药儿园”.云南政协报[N].2014-04-11(004).
[2]Melander B.Pharmacology of the influenza suppressant N′,N′-anhydrobis(β-hydroxyethyl)biguanide-HCl(ABOB)[J].Toxicol Appl Pharmacol,1960,2(4):474-489.
[3]Thomas L Flanagan,Emi K Horikawa,Edward J Van Loon.Determination of N′,N′-anhydrobis(β-hydroxyethyl)-biguanide hydrochloride in urine[J].Anal Biochem,1961,2(3):231-236.
[4]杨卫东,容建清.病毒灵治疗扁平疣43例效果评估[J].中国社区医师(医学专业),2010,12(19):63-64.
[5]杭州制药二厂,新产品“病毒灵”试制总结[J].杭州化工,1973,10(4):2-4.
[6]杨作成.病毒性心肌炎与心肌纤维化[J].临床儿科杂志,2007,25(10):807-810.
[7]施葵,顾菊萍,秦晔.心律平在小儿病毒性心肌炎心律失常治疗中的应用及疗效观察[J].西北药学杂志,2004,19(6):268-269.
[8]蔡晓丹,京华时报.http://news.southcn.com/c/2014-03/12/content_94725304.htm,2014-03-22.
[9]子进爵教育,http://www.zijinjue.com/detail/1/1817.html,2014-03-12.
[10]于连智,张德新,高维凡,等.病毒灵对鸡的毒性、药动学及防治鸡传染性支气管炎的研究[J].辽宁畜牧兽医,1998,15(1):91-92.
[11]李玉玲,杨建业,唐俊明,等.阿霉素诱导大鼠心衰模型不同方案的比较[J].中国比较医学杂志,2006,8(2):93-96.
[12]邹江.急性心肌损伤新的预警分子的初步筛选[D].中南大学,2010.
[13]李润琴,慕晓玲.新生大鼠心肌细胞培养技术[J].山西医药杂志,2007,36(2):103-105.
[14]王涛,余志斌,谢满江,等.新生大鼠心肌细胞培养技巧[J].第四军医大学学报,2003,24(2):92.
[15]刘钊,杨占秋,肖红,等.MTT法在抗病毒药物筛选中的应用[J].武汉大学学报:医学版,2004,25(3):332-334.
[16]Zhang J Q,Ma H L,Wu C H,et al.Effects of sodium tanshinone IIA sulfonate against Marek′s disease virus in experimentally infected chickens[J].Int J Biol Macromol,2013,29(4):258-262.
[17]何鹏程,谈宁,周颖玲,等.缺血后适应对活性氧及心肌细胞凋亡的影响[J].岭南心血管病杂志,2008,14(4):282-287.
[18]王瑞华,兰晓莉,曹国祥,等.新生SD大鼠心肌细胞培养方法的简化及改良[J].心脏杂志,2008,20(2):154-157.
[19]范雪晖,王文锋,徐振平.新生大鼠心肌细胞体外培养及其与心肌成纤维细胞形态比较[J].新乡医学院学报,2009,26(2):129-132.
[20]阳海鹰,丁巍,丁卫石,等.新生小鼠心肌细胞培养模型的建立及其在毒性评价研究中的应用[J].军事医学科学院院刊,2010,34(1):201-206.
[21]Wang Q,Kuang H,Su Y,et al.Naturally derived antiinflammatory compounds from Chinese medicinal plants[J].J Ethnopharmacol,2013,146(1):9-39.
The toxic effects of Moroxydine Hydrochloride Tablets on mice myocardial cells
HAO Qi1,2,HUA Fei1,2,SONG Fan1,2,ZHANG Huan3,WANG Siwang1,2,XIE Yanhua1,2,SUN Jiyuan1,2*(1.Department of Natural Medicine,School of Pharmacy,the Fourth Military Medical University,Xi′an 710032,China;2.Collaborative Innovation Center for Chinese Medicine in Qinba Mountains,Xi′an 710032,China;3.Department of Cardiovascular Medicine,Xi′an Central Hospital,Xi′an 710003,China)
Objective To explore the myocardial cell toxicity of Moroxydine Hydrochloride Tablets(ABOB).Methods Mice were randomly divided into ABOB high dose group(8),low dose group(8),and saline control group(8).Mice serum creatine kinase(CK),brain natriuretic peptide(BNP),CTnT levels were determined 7dafter intragastric administration.The hearts and kidneys were removed and processed for histological examination.At the same time,the inhibition effect of ABOB on the newborn rat myocardial cell was evaluated by MTT assay.Results Compared with the control group,ABOB high dose group,ABOB low dose group significantly increased the levels of CK(P<0.05),while no obvious change was observed in the levels of BNP and CTnT.Compared with the control group,ABOB high dose group and ABOB low dose group,myocardial tissue presented patholoical change,while no obvious change found in kidney tissue.Compared with the control group,myocardial cell activity was inhibited in different degrees after administration of ABOB with high or low dose,and tended to decline gradually with increasing the drug dose.Conclusion ABOB has certain toxicity for myocardial cells.
ABOB;CK;BNP;CTnT;myocardial cells
10.3969/j.issn.1004-2407.2015.04.017
R965
A
1004-2407(2015)04-0379-04
2014-11-10)
郝琦,女,药师
*通信作者:孙纪元,男,副教授,硕士生导师
