酶解技术在多糖结构和活性研究中的应用进展
2015-01-18李卫燕第四军医大学药学院天然药物学教研室西安710032
李 萍,李卫燕,曹 蔚(第四军医大学药学院天然药物学教研室,西安 710032)
·综述·
酶解技术在多糖结构和活性研究中的应用进展
李 萍,李卫燕,曹 蔚*(第四军医大学药学院天然药物学教研室,西安 710032)
目的 总结几种常用酶在多糖结构和活性研究中的应用进展。方法 查阅分析相关资料文献并综述。结果 酶解主要用于多糖的初级结构分析。酶解后,多糖的异头碳构型发生变化,且酶解后多糖片段的活性有所改变。结论 酶解技术在多糖结构研究以及活性多糖研究开发方面有着重要的作用。
多糖;结构;活性;酶解技术
多糖(polysaccharide)是由醛糖或酮糖通过苷键连接在一起的多聚物,广泛存在于植物、动物和微生物中,是构成生命的四大基本物质之一。目前已报道,多糖具有抗病毒、抗凝血、抗炎、抗肿瘤、抗氧化、免疫调节、神经保护、抗辐射、抗糖尿病、护肝、抗骨质疏松症、抗疲劳、抗动脉粥样硬化等生物活性[1-4]。
研究发现,多糖的生物活性与其结构密切相关。多糖结构的分析方法主要有3种:化学分析法、仪器分析法和生物学方法。多糖的生物学分析方法主要包括酶学方法和免疫学方法。本文主要对酶解技术在多糖结构和活性研究中的应用进行综述,以期为多糖的进一步开发利用提供参考依据。
1 多糖的结构
多糖的结构比较复杂,分为初级结构(一级结构)和高级结构(二、三、四级结构)。多糖的一级结构是指相对分子质量、单糖组成及比例、糖环形式(吡喃环或呋喃环)、单糖残基类型及糖苷键连接位点、糖苷取代的异头异构形式(α-或β-)等;二级结构是指多糖骨架链间以氢键为主要次级键而形成的有规则的构象[5];三级结构和四级结构是指以二级结构为基础,由于糖单位之间的非共价相互作用,导致二级结构在有序的空间里产生的有规则的构象[6]。目前国内外对多糖的结构研究主要集中在一级结构的研究上。
2 酶解技术在多糖结构研究中的应用
酶学方法即利用各种特异性糖苷酶水解多糖分子得到寡糖片段,通过分析寡糖片段的结构来推测多糖的结构,主要用于糖链结构的分析[7]。而在酶解法中,因为酶具有特异性,可选择性地酶解切断特定糖苷键,从而对多糖专一降解,制得特定聚合度的寡糖[8]。目前,多糖结构研究中常用的酶有果胶酶、壳聚糖酶、纤维素酶等。
2.1 果胶酶 果胶的基本结构是半乳糖醛酸以α-(1-4)-糖苷键聚合形成的聚半乳糖醛酸。果胶酶是一类分解果胶质的酶的总称[9],主要功能是通过裂解或β消去作用切断果胶质中的糖苷键,使果胶质裂解为多聚半乳糖醛酸[10]。现一般根据果胶酶的底物、底物被作用的方式以及切割位点这三类标准进行分类,如表1所示。
果胶酶基本的作用机制包括水解作用和反式消去作用。水解作用的酶主要有果胶酯酶(pectin esterase)、原果胶酶(protopectinases)及多聚半乳糖醛酸酶(polygalacturonases)。起反式消去作用的酶是裂解酶(lyase)。
2.1.1 果胶酯酶 果胶酯酶催化果胶的半乳糖醛酸主链,将其甲基酯键脱酯化,释放出酸性果胶和甲醇[11]。
2.1.2 原果胶酶 原果胶酶分为A型和B型。A型原果胶酶作用于果胶内部区域的半乳糖醛酸部位;B型原果胶酶作用于果胶外部的连接多聚半乳糖醛酸链和细胞壁成分多糖链[11]。
2.1.3 多聚半乳糖醛酸酶 多聚半乳糖醛酸酶特异性水解组成果胶酸的D-半乳糖醛酸-α-(1-4)-糖苷键[11]。
2.1.4 裂解酶 裂解酶在果胶酸的C-4上断开糖苷键,同时在C-5消除H,产生△4∶5不饱和产物[11]。
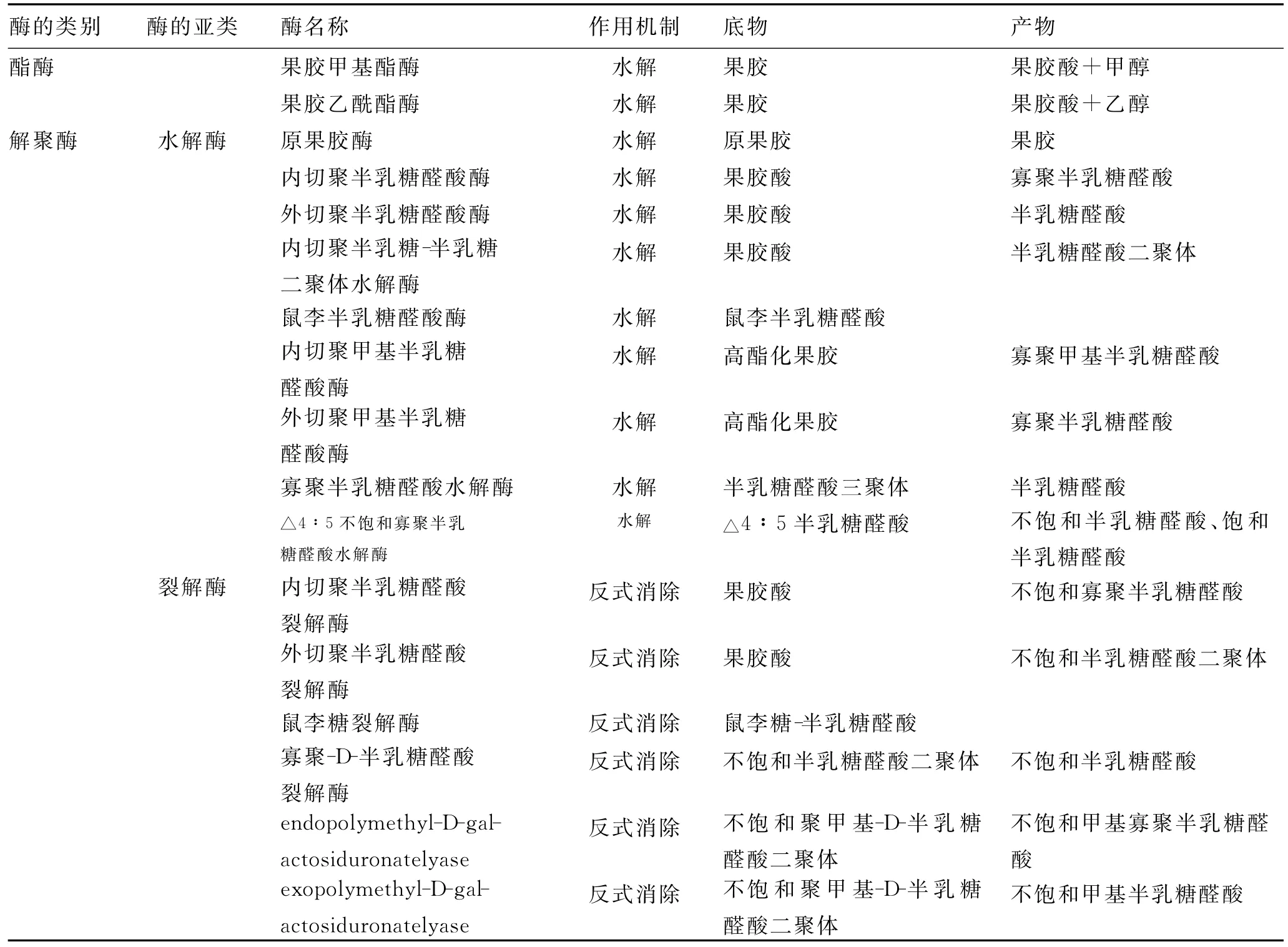
表1 果胶酶的分类Tab.1 The classification of pectinase
2.2 壳聚糖酶 几丁质(chitin)又名甲壳素、甲壳质,由N-乙酰-D-葡萄糖胺以β-(1-4)-糖苷键相连而成[12]。壳聚糖(chitosan)为几丁质部分或全部脱乙酰化后的衍生物,是β-(1-4)-2-乙酰氨基-D-葡萄糖(N-乙酰-D-葡萄糖胺,N-乙酰氨基葡萄糖,GlcNAc)和β-(1-4)-2-氨基-D-葡萄糖(D-葡萄糖胺,葡萄糖胺,GlcN)的线性共聚物[13]。壳聚糖有以下4种类型,即GlcN-GlcN,GlcNAc-GlcN(还原端为GlcNAc,非还原端为GlcN),GlcN-GlcNAc(还原端为GlcN,非还原端为GlcNAc),GlcNAc-GlcNAc。
壳聚糖酶(chitosanase)可以特异性地切断壳聚糖的β-(1-4)-糖苷键,得到壳聚糖的低聚物。2008年,国际酶命名委员会命名了一个新的酶,外切-β-D-氨基葡萄糖苷酶[14](EC 3.2.1.165),这种酶也被称为外切壳聚糖酶和氨基葡萄糖苷酶。这种外切水解酶可降解GlcN-GlcNAc,但对GlcNAc-GlcNAc无降解作用[14]。
根据底物的细微差别,壳聚糖酶目前可以分为3个亚类[14]。I类壳聚糖酶作用于GlcN-GlcN和GlcNAc-GlcN;Ⅱ类壳聚糖酶只作用于GlcN-GlcN;Ⅲ类酶作用于GlcN-GlcN和GlcN-GlcNAc。而根据酶解产物的不同,壳聚糖酶可以分为内切壳聚糖酶和外切-β-D-氨基葡萄糖苷酶。前者随机切断壳聚糖链,产生相对分子质量小的壳寡糖[15];后者从壳聚糖链的非还原性末端顺序切下连续GlcN残基[16],得到氨基葡萄糖。大多数微生物所产壳聚糖酶均为内切酶[17]。
2.3 纤维素酶 纤维素作为植物产生的最丰富的碳水化合物,是由β-(1-4)-糖苷键与纤维二糖的重复单元连接的葡萄糖亚单位的线性链[18]。纤维素酶是一类水解纤维素的β-(1-4)-糖苷键,使其降解为低聚葡萄糖、纤维二糖和葡萄糖的水解酶。
纤维素酶根据其催化反应功能的不同可分为:(Ⅰ)内切葡聚糖酶或β-(1-4)-D-葡聚糖-4-葡萄糖水解酶(EC 3.2.1.4),(II)外切葡聚糖酶,包括β-(1-4)-D-葡聚糖-葡萄糖水解酶(EC 3.2.1.74)和β-(1-4)-D-葡聚糖-纤维二糖水解(EC3.2.1.91),(III)β-葡萄糖苷酶或β-葡萄糖苷-葡萄糖水解酶(EC 3.2.1.21)[19]。
目前,纤维素酶降解纤维素的机制比较公认的是协同理论,该理论认为:内切酶将结晶纤维素降解成无定形纤维素,外切酶将纤维素降解成纤维二糖,最后由β-葡萄糖苷酶将纤维二糖水解成葡萄糖[20]。但对于内切酶和外切酶的作用顺序尚未定论。
2.3.1 内切葡聚糖酶 内切葡聚糖酶,主要作用于纤维素的非结晶区域,随机切断β-(1-4)-糖苷键,从而降解纤维素,形成纤维寡糖、纤维三糖等短链低聚糖[21]。
2.3.2 外切葡聚糖酶 外切葡聚糖酶以一种连续性的方式作用于纤维素多糖链的还原端或非还原端,水解β-(1-4)-糖苷键,产生大量葡萄糖(由葡聚糖水解酶酶解得到)或是纤维二糖(由纤维二糖水解酶酶解得到)[19]。外切葡聚糖酶也可以作用于微晶纤维素,从其结构中可切除纤维素链[22]。
2.3.3 β-葡萄糖苷酶 β-葡萄糖苷酶可以将寡聚葡萄糖和纤维二糖水解成葡萄糖。
2.4 其他 α-甘露糖苷酶,可外切α-(1-2),α-(1-3)和α-(1-6)甘露糖苷键,得到产物甘露单糖;α-淀粉酶(α-(1-4)-glucan-4-glucanohydrolase,EC 3.2.1.20)从淀粉内部切开α-(1-4)键产生糊精和还原糖;α-葡萄糖苷酶(α-D-glucoside glucohydrodase,EC 3.2.1.20)是糖苷水解酶的一种,从底物的非还原性末端水解底物的α-(1-4)-葡萄糖苷键,得到产物α-葡萄糖;α-半乳糖苷酶(α-D-galactoside galactohydrolase,EC 3.2.1.22)水解半乳糖苷化合物的非还原性末端,得到产物α-半乳糖;糖化酶(glucoamylase,EC 3.2.1.3),从糖链的非还原性末端顺序水解α-(1-4)-葡萄糖苷链,释放出葡萄糖[23]。
3 酶解技术对多糖活性的影响
研究发现,大多数多糖酶解后生物活性增强。徐张展等[24]研究显示,海胆多糖SEP通过α-淀粉酶降解主链为α-(1-4)-糖苷键的葡聚糖,得到3个或3个以上α-(1-4)-糖苷键连接的葡萄糖单元后,其免疫活性增强。Im S等[25]研究了芦荟多糖通过纤维素酶酶解得到的改性芦荟多糖(MAP)片段与其免疫调节、抗肿瘤活性的关系,显示相对分子质量介于5× 103和4×105之间的多糖MAP在体内具有较强的抗肿瘤活性,且该多糖片段比相对分子质量大于4×105和小于5×103的片段对巨噬细胞的激活作用强。吴婷等[26]研究显示,葫芦巴多糖经甘露聚糖酶解得到半乳糖甘露聚糖片段,其抗氧化、抗菌活性均增强。Yoshizawa Y等[27]研究发现,条斑紫菜多糖(PASF)经β-琼胶酶(含Ⅰ、Ⅱ型,β-琼胶酶裂解琼脂糖的β-(1-4)-糖苷键)降解后,得到的降解产物具有较高的免疫活性。也有研究表明,多糖酶解后活性减少或丧失,如FPP(柑橘果胶热处理得到的一种商业果胶)通过内切聚半乳糖醛酸酶(可从果胶酸分子内部无规则地切开α-(1-4)-糖苷键)以及果胶甲酯酶(随机切除甲酯化果胶中的甲基,产生甲醇和游离羧基)后得到的降解产物基本上无诱导肿瘤细胞凋亡的活性[28]。
4 小结
多糖广泛存在于有机体,具有重要的生物功能,也具有重要的药用价值。国内外已报道了200余种活性多糖,其药理作用涉及抗凝血、抗肿瘤、抗损伤、抗辐射、抗HIV病毒、调节免疫等。继香菇多糖以来,已有牛膝多糖、云芝多糖、猪苓多糖等相继用于临床。改性柑橘果胶(MCP)可与半乳凝素-3(Gal-3)结合从而抑制多种肿瘤细胞的生长[29]。MCP由半乳糖醛酸、鼠李糖和木糖组成,直接溶于水,现已进入Ⅲ期临床抗肿瘤研究。Gal-3是一类能选择性识别糖结构并与之非共价结合的蛋白质,它在癌细胞中高表达并激活下游信号通路,而此作用又可被多糖阻断[30]。我们近期的研究显示,经酶解的多种寡糖片段对Gal-3的亲和作用可进一步增强,呈现显著的抗肿瘤作用。
酶解技术在多糖结构分析及活性研究中起着重要的作用。但目前在多糖结构分析以及活性研究中应用的酶仅限于部分类型多糖的降解酶,所以开发利用转移酶、合成酶等新型酶,将丰富酶解技术在多糖结构分析以及活性研究中的应用。
[1]秦洁华,李雪华,肖庆,等.龙眼壳多糖含量的测定及其免疫活性研究[J].西北药学杂志,2010,25(2):110-112.
[2]Mingliang Jin,Qingsheng Huang,Ke Zhao,et al.Biological activities and potential health benefit effects of polysaccharides isolated from Lycium barbarum L.[J].Intern J Biological Macromolec,2013,54:16-23.
[3]Yongxu Sun.Structure and biological activities of the polysaccharides from the leaves,roots and fruits of Panax ginseng C.A.Meyer:an overview[J].Carbohydr Polymer,2011,85:490-499.
[4]Mingliang Jin,Ke Zhao,Qingsheng Huang,et al.Structural features and biological activities of the polysaccharides fromAstragalus membranaceus[J].Intern J Biological Macromolec,2014,64:257-266.
[5]刘吉成,牛英才.多糖药物学[M].北京:人民卫生出版社,2008:28-29.
[6]高小荣,刘培勋.多糖结构分析研究进展[J].天津药学,2003,15(6):67-70.
[7]刘玉红,王凤山.真菌多糖结构研究进展[J].中国药学杂志,2007,42(8):561-564.
[8]缪月秋,顾龚平,吴国荣.植物多糖水解及其产物的研究进展[J].中国野生植物资源,2005,24(2):4-7.
[9]Kashyap D R,Vohra P K,Chopra S,et al.Applications of pectinases in the commercial sector.a review[J].Bioresourc Technol,2001,77(3):215-227.
[10]Sathyanarayana N G,Panda T.Purification and biochemical properties of microbial pectinases-a review[J].Proc Biochem,2003,38(7):987-996.
[11]Ranveer Singh Jayani,Shivalika Saxena,Reena Gupta.Microbial pectinolytic enzymes:a review[J].Proces Biochem,2005,40(9):2931-2944.
[12]Rinaudo M.Chitin and chitosan:properties and applications[J].Prog Poly Sci,2006,31:603-632.
[13]Zitouni M,Fortin M,Scheerle R K,et al.Biochemical and molecular characterization of a thermostable chitosanase produced by the strain Paenibacillus sp.1794 newly isolated from compost[J].Appl Microbiol Biotechnol,2012,97:1-13.
[14]Nidheesh Thadathil,Suresh Puthanveetil Velappan.Recent developments in chitosanase research and its biotechnological applications:a review[J].Food Chem,2014(150):392-399.
[15]季更生,陈爱春.微生物壳聚糖酶的研究进展[J].食品科学,2010,31(3):297-301.
[16]T Fukamizo,A Fleury,N Côté,et al.Exo-β-d-glucosaminidase from Amycolatopsis orientalis:catalytic residues,sugar recognition specificity,kinetics,and synergism[J].Glycobiology,2006,16(11):1064-1072.
[17]van Bueren A L,Ghinet M G,Gregg K,et al.The structural basis of substrate recognition in an exo-β-D-glucosaminidase involved in chitosan hydrolysis[J].Mol Biol,2009,385(1):131-139.
[18]Moumita Saharay,Hong Guo,Jeremy C Smith.Catalytic mechanism of cellulose degradation by a cellobiohydrolase,CelS[J].Plos One,2010,5(10):1-10.
[19]Lee R Lynd,Paul J Weimer,Willem H van Zyl,et al..Microbial cellulose utilization:fundamentals and biotechnology[J].Microbiol Mol Biol Rev,2002,66(3):506-577.
[20]陈洪章.纤维素生物技术[M].北京:化学工业出版社,2005:46-130.
[21]Nakazawa H,Okada K,Onodera T,et al.Directed evolution of endoglucanaseⅢ(Cel12A)from Trichoderma reesei[J].App Microbiol Biotechnol,2009,83(4):649-657.
[22]Teeri T.Crystalline cellulose degradation:new insight into the function of cellobiohydrolases[J].Trends Biotechnol,1997,15:160-167.
[23]张惟杰.糖复合物生化研究技术[M].杭州:浙江大学出版社,2006:163-174.
[24]徐张展,邢莹莹,周长林,等.海胆黄多糖SEP酶解及产物免疫活性测定[J].药物生物技术,2009,16(4):342-346.
[25]Im S,Oh S,Song S,et al.Identification of optimal molecular size of modified aloe polysaccharides with maximum immunomodulatory activity[J].Intern Immunopharmacol,2005,2(5):271-279.
[26]吴婷,闫茂华,张雅,等.葫芦巴多糖酸解和酶解产物抗氧化及抗菌活性的比较研究[J].食品科学,2007,28(11):509-512.
[27]Yoshizawa Y,Ametani A,Tsunehiro J,et al.Macrophage stimulation activity of the polysaccharide fraction from a marine alga(Porphyra yezoensis):structure-function relationships and improved solubility[J].Biosci Biotechnol Biochem,1995,59(10):1933-1937.
[28]Crystal L Jackson,Tina M Dreaden,LisaK Theobald,et al.Pectin induces apoptosis in human prostate cancer cells:correlation of apoptotic function with pectin structure[J].Glycobiology,2007,17(8):805-819.
[29]Chauhan D,Li G,Podar K.A novel carbohydratebased therapeutic GCS-100overcomes bortezomib resistance and enhances dexamethasone-induced apoptosis in multiple myeloma cells[J].Cancer Res,2005,65(18):8350-8358.
[30]沈歆,曹蔚,王四旺.半乳凝集素抑制剂及其抗肿瘤作用研究进展[J].西北药学杂志,2013,28(6):653-656.
Application progress of enzymolysis technology in the study of the structure and activity of polysaccharides
LI Ping,LI Weiyan,CAO Wei*(Department of Natural Medicine,School of Pharmacy,the Fourth Military Medical University,Xi′an 710032,China)
Objective To summarize the progress of several common enzymes in the structure and activity of polysaccharides.Methods Related articles were reviewed.Results Enzymolysis is mainly used in the elemental structural analysis of the polysaccharides.After enzymolysis,the configuration of anomeric carbon of polysaccharides changed and the active of fragments of polysaccharides varied as well.Conclusion The enzymolysis technology plays an important role in the structural analysis of polysaccharides and the exploitation of active polysaccharides.
polysaccharide;structure;activity;enzymolysis technology
10.3969/j.issn.1004-2407.2015.04.036
R284
A
1004-2407(2015)04-0433-04
2014-10-21)
国家自然科学基金(编号:30701081,81173513,81473329)
李萍,女,硕士研究生
*通信作者:曹蔚,女,副教授,硕士研究生导师
