DC-CIK过继免疫治疗联合化疗治疗晚期结直肠癌的临床研究
2015-01-18翁海光沈冬茅卫东韩兰秀
翁海光 沈冬 茅卫东 韩兰秀
DC-CIK过继免疫治疗联合化疗治疗晚期结直肠癌的临床研究
翁海光 沈冬 茅卫东 韩兰秀
目的 探讨树突状细胞联合细胞因子诱导的杀伤细胞(DC-CIK)过继免疫治疗联合化疗治疗晚期结直肠癌的疗效及安全性。方法 2010年1月至2013年12月确诊的235例晚期结直肠癌患者,按随机数字表法分成两组,DC-CIK组124例患者行DC-CIK过继免疫治疗联合化疗,单纯化疗组111例患者行单纯化疗,评价两组患者治疗后免疫功能、疗效、生存期、不良反应以及生活质量等。结果 治疗3个周期后,DC-CIK组患者的CD3+、CD3+CD4+、CD3+CD8+、NK、NKT、Treg,CD4+T细胞以及CD4+T细胞内IFN-γ、IL-2、TNF-α等指标与治疗前比较均无统计学差异(均P>0.05);患者的中位无进展生存期(PFS)为7.0个月(95% CI=6.4~7.6),中位总生存期(OS)为14.5个月(95%CI=13.4~15.6),与单纯化疗组比较均有统计学差异(均P<0.01)。DC-CIK组患者的Ⅲ~Ⅳ度不良反应中,血白细胞下降的发生率为22.0%(11/50),低于单纯化疗组(P<0.05)。DC-CIK组治疗前后生活质量评分分别为(51.1±6.2)和(62.3±5.2)分,比较有统计学差异(t=15.413,P<0.01)。结论 DC-CIK过继免疫治疗联合化疗能够明显改善晚期结直肠癌患者的免疫功能,提高患者生存期及生存质量,而且不良反应少、安全性高。
DC-CIK 免疫疗法 结直肠癌 疗效 生存分析
结直肠癌是我国常见肿瘤,其主要治疗方法有手术、化疗、放疗等,手术治疗是早期结直肠癌患者的首选。但是,临床上近30.0%的患者确诊时已是晚期[1],大多数晚期患者已失去手术治疗机会,因而寻求合理的内科治疗方案显得尤为重要。虽然规范化疗的有效率能够达到50.0%,但是在杀灭肿瘤细胞的同时也损伤了正常细胞,不良反应较大。树突状细胞联合细胞因子诱导的杀伤细胞(DC-CIK)过继免疫治疗是一种新兴免疫治疗方法,能够有效抑制和杀灭肿瘤细胞,提高患者的机体
免疫力和生活质量,降低了肿瘤复发、转移的风险,同时避免对正常细胞的损伤,减少了不良反应,具有较高的安全性[2-3]。国内外目前已有部分对结直肠癌患者进行DCCIK过继免疫治疗联合化疗的研究[2-6],但DC-CIK过继免疫治疗联合化疗对于晚期结直肠癌患者的各项免疫学指标、疾病控制率、生存期和生活质量等的影响仍缺少系统报道。本研究从2010年开始连续4年对确诊的晚期结直肠癌患者分别应用DC-CIK过继免疫治疗联合化疗,并与单纯化疗进行对比,观察其临床疗效和安全性,现将结果报道如下。
1 对象和方法
1.1 对象 2010年1月至2013年12月东南大学医学院附属江阴医院确诊的晚期结直肠癌患者共235例,其中男130例,女105例。按随机数字表法将患者分成两组,DC-CIK组124例,年龄48~79岁,平均(63.2±4.3)岁,中位年龄59岁;单纯化疗组111例,年龄44~76岁,平均(61.7±5.2)岁,中位年龄55岁。患者纳入标准:(1)经病理确诊的晚期结直肠癌(Ⅲ~Ⅳ期);(2)PS评分1~2分;(3)心、肝、肾等脏器功能基本正常;(4)至少能够完成2个周期治疗;(5)接受治疗前后完善辅助检查并详细记录结果。排除标准:(1)存在心、肝、肾等内科疾病;(2)存在免疫性疾病或其他肿瘤;(3)存在感染性疾病;(4)合并肺部或其他部位严重感染;(5)使用激素或免疫抑制剂。两组患者的性别、年龄构成、临床分期、组织学类型等临床资料比较均无统计学差异(均P>0.05),显示资料均衡可比,见表1。本研究方案已获得东南大学医学院附属江阴医院伦理委员会批准,且所有患者及家属均在入组前签署了知情同意书。
1.2 治疗方案
1.2.1 单纯化疗组 所有患者化疗方案均采用FOLFOX4方案,具体为:奥沙利铂85mg/m2静脉滴注,第1天;甲酰四氢叶酸钙200mg/m2静脉滴注,第1天;5-氟尿嘧啶400mg/m2静脉推注,第1~2天;600mg/m2静脉微泵注射持续22h,第1~2天。14d为1个周期,1个疗程12个周期。
1.2.2 DC-CIK组 患者化疗前采集外周血50ml,分离单个核细胞(PBMCs),置于37℃、5%CO2细胞培养箱中培养,收集悬浮细胞,以GT-T551培养液调整细胞密度,常规培养24h后加入重组人IL-2(rhIL-2),定期观察并适时分瓶培养。结合细胞状态、扩增数量和成熟度,培养9~21d后收集细胞。细胞培养物须经免疫功能检测合格,且无菌生长。以0.9%氯化钠注射液洗涤细胞后,将其混悬于含2%白蛋白的0.9%氯化钠注射液100ml中,分两次回输给患者,每个月回输1次。患者采血后第2天开始化疗,方案同单纯化疗组。

表1 两组患者临床资料比较
1.3 疗效评价
1.3.1 免疫功能评价 患者均于每周期治疗前以及完成3个周期治疗后,抽取外周血。以流式细胞仪(美国BD公司)检测患者免疫学指标的变化情况。免疫学指标包括T细胞亚群,包括:总CD3+T细胞、CD3+CD8+T细胞、CD3+CD4+T细胞、CD3-CD56+NK细胞、CD3+CD56+NKT细胞以及CD4+CD25+调节性T细胞(Treg)。同时检测CD4+T细胞内IFN-γ、IL-2、TNF-α含量。
1.3.2 近期疗效评价 根据WHO实体瘤疗效评价(RECIST)标准,疗效分为完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)和疾病进展(PD),临床有效率(RR)=(CR患者数+PR患者数)/患者总数×100%,疾病控制率(DCR)=(CR患者数+PR患者数+SD患者数)/患者总数×100%。
1.3.3 远期疗效评价 本研究随访至2013年12月31日,主要随访方式为电话随访。主要研究终点为疾病进展,其次为死亡,并评价两组患者的无进展生存期(PFS)和总生存期(OS)。
1.3.4 不良反应评价 根据美国国立癌症研究所NCI《急性和亚急性毒性反应表现和分度标准》,分为0~Ⅳ度。入组患者于DC-CIK过继免疫治疗及化疗第3个周期末评价近期疗效。
1.3.5 生活质量评价 采用欧洲癌症研究机构与治疗组织的癌症患者生命质量测定量表(EORTC QLQ-C30),包含躯体、角色、情绪、认知、社会等5个功能量表,所有项目总分0~100分,得分越高,提示生活质量越高。
1.4 统计学处理 采用SPSS 18.0统计软件。计量资料以表示,满足正态分布或方差齐性的计量资料组间比较采用t检验,否则采用秩和检验;计数资料采用χ2检验。PFS和OS分析采用Kaplan-Meier法,生存分析运用log-Rank检验。
2 结果
2.1 两组患者治疗前后外周血T细胞亚群的变化 比较两组患者治疗前、治疗3个周期后外周血T细胞亚群显示,DC-CIK组治疗前、治疗3个周期后CD3+T细胞、CD3+CD8+T细胞、CD3+CD4+T细胞、CD3-CD56+NK细胞、CD3+CD56+NKT细胞以及CD4+CD25+Treg细胞等指标均无统计学差异(均P>0.05),而单纯化疗组治疗后除CD3+CD56+NKT细胞外,其他指标与治疗前比较均有统计学差异(均P<0.05),见表2。
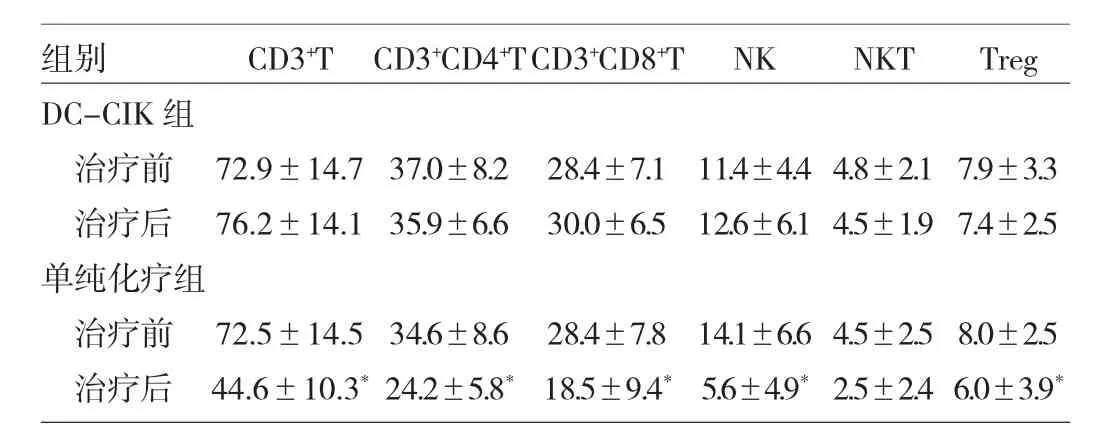
表2 两组患者治疗前后外周血T细胞亚群的变化(%)
2.2 两组患者治疗前后CD4+T细胞中主要细胞因子含量的变化 进一步比较两组患者治疗3个周期后CD4+T细胞中主要细胞因子含量的变化,DC-CIK组治疗前后IFN-γ、IL-2、TNF-α含量均无明显变化(均P>0.05);而单纯化疗组治疗前后IFN-γ、IL-2、TNF-α含量均有统计学差异(均P<0.05),见表3。
2.3 两组患者的疗效评价 两组患者的RR比较无统计学差异(χ2=2.774,P>0.05);但DC-CIK组患者的DCR高于单纯化疗组(χ2=17.455,P<0.01),见表4。截止到2013年12月,两组患者随访率均为100.0%。DCCIK组患者的中位PFS为7.0个月(95%CI=6.4~7.6),中位OS为14.5个月(95%CI=13.4~15.6);单纯化疗组患者中位PFS为5.2个月(95%CI=5.0~5.4),中位OS为10.9个月(95%CI=9.5~12.3),两组比较均有统计学差异(χ2=30.438、11.342,均P<0.01),见图1-2。

表3 两组患者治疗前后CD4+T细胞中主要细胞因子含量变化(%)

表4 两组患者的疗效评价
2.4 两组患者的不良反应比较 DC-CIK组和单纯化疗组的Ⅲ~Ⅳ度不良反应中,血白细胞减少发生率分别为22.0%(11/50)和44.2%(23/52),两组比较有统计学差异(P<0.05)。其他不良反应如贫血、血小板减少、恶心、呕吐、肝功能障碍等,两组比较均无统计学差异(均P>0.05),见表5。
2.5 两组患者治疗前后生活质量评价 DC-CIK组患者治疗前后生活质量评分分别为(51.1±6.2)和(62.3± 5.2)分,比较有统计学差异(t=15.413,P<0.01)。而单纯化疗组患者生活质量下降较为明显,治疗前后生活质量评分分别为(50.5±5.2)和(47.3±6.4)分,比较也有统计学差异(t=4.321,P<0.01)。
3 讨论
DC在机体抗肿瘤免疫中发挥着非常重要的作用,能够特异性激活CD8+和CD4+T细胞,是针对肿瘤抗原免疫反应的理想靶点[7]。美国食品药品监督管理局(FDA)于2010年5月批准了命名为Provenge的DC肿瘤疫苗,将其应用于前列腺癌治疗,意义十分重大[8]。近年兴起的CIK细胞免疫治疗具有独特优势,该疗法能够激活并强化机体免疫系统,通过抗原特异性T细胞靶向杀伤肿瘤细胞。而机体免疫系统具有免疫记忆,对复发肿瘤也能起到抑制或杀伤作用。DC与CIK细胞免疫治疗联合应用不但能够激活DC介导的MHC限制性细胞毒反应,同时可发挥CIK的非MHC限制性细胞毒反应,增加对肿瘤细胞的杀伤,而且在有效抑制肿瘤的同时,也能提高肿瘤患者的生活质量,因此DC-CIK过继免疫治疗成为目前行之有效的国际化免疫治疗方案[7-9]。
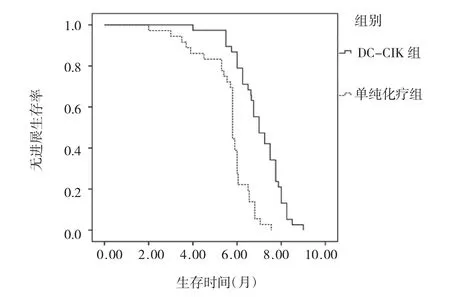
图1 两组患者的无进展生存曲线

表5 两组患者不良反应比较(例)
本研究的一大特色是纳入患者样本量较大(235例),研究时间较长(4年),并对患者DC-CIK过继免疫治疗后的免疫功能变化、近、远期疗效和安全性进行了评价,同既往研究相比更为全面、客观。CIK细胞具有很强的细胞毒性,可以诱导肿瘤细胞凋亡,从而杀死耐药的肿瘤细胞,并能产生IFN-γ、IL-2和其他抗肿瘤细胞因子[10],因此DC-CIK过继免疫治疗能够明显改善患者由于化疗导致的免疫功能低下,为患者带来临床获益。本研究中DC-CIK组患者治疗3个周期后T细胞亚群,特别是CD4+T细胞中IFN-γ、IL-2、TNF-α等指标与治疗前无统计学差异,与尹良伟等[4]、张京雨等[11]的研究一致。DC-CIK组患者的DCR达到76.6%,略高于国内外其他研究的60.0%~70.0%[3-4,12-13],说明DC-CIK细胞免疫治疗在缓解肿瘤进展,延长患者PFS方面具有显著的积极作用。
本研究中DC-CIK组患者中位PFS为7.0个月,高于单纯化疗组患者的5.2个月,与国内外报道的中位PFS在6.0个月左右接近[4,10-12]。Zhang等[10]回顾性研究了CIK治疗60例结直肠癌患者的临床效果,其中位PFS和中位OS分别为25.8个月和41.3个月,显著高于本研究结果。这主要是由于上述研究包含了部分Ⅰ~Ⅱ期患者,而本研究中仅纳入了Ⅲ~Ⅳ期患者,预后均较差,但所有研究均提示DC-CIK过继免疫治疗能够有效延长患者的PFS。本研究DC-CIK组患者的中位OS为14.5个月,其他研究显示DC-CIK过继免疫治疗联合化疗患者的中位OS为12.0个月,最长可达到18.0个月[14-15],说明DC-CIK细胞免疫治疗与化疗可能起到协同作用,显著提高了患者OS。本研究与既往研究的不同之处在于,本研究发现DC-CIK组患者的PFS、OS均高于单纯化疗组,且均有统计学差异,这可能与DC-CIK的回输显著改善了患者的免疫功能有关。而国内大部分研究结果显示,DC-CIK过继免疫治疗与化疗联合对改善患者PFS更有效。同时本研究对治疗的不良反应和患者生活质量的分析也提示,DC-CIK过继免疫治疗联合化疗在为患者带来临床获益的同时,具有良好的安全性,并能显著提高患者生活质量,值得在临床推广[7,13,16-17]。
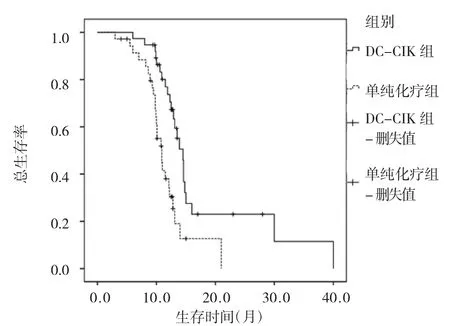
图2 两组患者的总生存曲线
[1] 张思维,雷正龙,李光琳,等.中国肿瘤登记地区2005年发病死亡资料分析[J].中国肿瘤,2009,18(12):973-979.
[2] 卞晋荣.结直肠癌术后化疗联合DC-CIK细胞治疗的效果评价[J].中国肿瘤外科杂志,2013,5(5):306-309.
[3] 燕海姣,吴骏,孙文辉,等.CIK细胞联合化疗治疗高龄晚期结直肠癌的临床观察[J].肿瘤基础与临床,2014,27(4):286-288.
[4] 尹良伟,王苏平,张利,等.DC-CIK过继性免疫疗法联合化疗治疗转移性结直肠癌患者的疗效[J].中国肿瘤生物治疗杂志,2013,20(2):217-224.
[5] Kim H S,Park H M,Park J S,et al.Dendritic cellvaccine in addition to FOLFIRI regimen improve antitumor effects through the inhibi-tion of immunosuppressive cells in murine colorectal cancer model[J].Vaccine,2010,28(49):7787-7796.
[6] Lee H J,Hong C Y,Kim M H,et al.In vitro induction of anterior gradient-2-specific cytotoxic T lymphocytes by dendritic cells transduced with recombinant adenoviruses as a potential therapy for colorectalcancer[J].Exp MolMed,2012,44(1):60-67.
[7] 庄捷.DC与CIK共培养细胞的肿瘤杀伤作用研究[D].上海交通大学, 2009.
[8] Thara E,Dorff T B,Pinski J K,et al.Vaccine therapy with sipuleucel-T(Provenge)for prostate cancer[J].Maturitas,2011,69(4): 296-303.
[9] 李壮,董晨辉,徐祥,等.自体及健康人CIK细胞治疗临床恶性肿瘤的比较[J].基础医学与临床,2014,34(4):475-479.
[10] Zhang J Y,Zhu L J,Zhang Q,et al.Effects of cytokine-induced killer cell treatment in colorectal cancer patients:a retrospective study[J].Biomed Pharmacother,2014,68(5):715-720.
[11] 张京雨,张晓明.CIK细胞过继性免疫治疗对结直肠癌化疗患者免疫指标的影响[J].肿瘤基础与临床,2009,22(1):51-53.
[12] Donahue R N,Duncan B B,Fry TJ,et al.Apan inhibitor of DASH family enzymes induces immunogenic modulation and sensitizes murine and human carcinoma cells to antigen-specific cytotoxic Tlymphocyte killing:implications for combination therapy with cancervaccines[J].Vaccine,2014,32(26):3223-3231.
[13] 郭增清,叶韵斌,余家密,等.细胞因子诱导的杀伤细胞联合化疗治疗晚期结直肠癌的临床观察[J].肿瘤研究与临床,2012,24(10):663-666.
[14] LiW,Xu LP,DI Zhao L,et al.Cytokine-induced killer celltherapy for advanced pancreatic adenocarcinoma:A case report and review ofthe literature[J].OncolLett,2013,5(4):1427-1429.
[15] Lopes M,Kutlu B,Miani M,et al.Temporal profiling of cytokine-induced genes in pancreatic β-cells by meta-analysis and network inference[J].Genomics,2014,103(4):264-275.
[16] Kim S K,Yun C H,Han S H.Enhanced anti-cancer activity of human dendritic cells sensitized with gamma-irradiation-induced apoptotic colon cancer cells[J].Cancer letters,2013,335 (2):278-288.
[17] Ja kelC E,Vogt A,Gonzalez-Carmona MA,et al.Clinicalstudies applying cytokine-induced killer cells for the treatment of gastrointestinaltumors[J].J ImmunolRes,2014,897214.
Clinical efficacy of DC-CIK immunotherapy combined with chemotherapy in treatmentof advanced colorectal cancer
WENG Haiguang,SHEN Dong,MAO Weidong,et al.
Department of Oncology,the Affiliated Jiangyin Hospital of Southeast University Medical College,Jiangyin 214400,China
【 Abstract】 Objective To investigate the efficacy and safety of DC-CIK (dendritic cell-cytokine induced killer cell) immunotherapy combined with chemotherapy for advanced colorectal cancer. Methods Two hundred and thirty five patients with advanced colorectal cancer admitted in Affiliated Jiangyin Hospital of Southeast University Medical College from January 2010 to December 2013 were enrolled in the study.Patients were randomly assigned in two groups,124 cases received DC-CIK combined with chemotherapy(DC-CIK group),and 111 cases received routine chemotherapy(chemotherapy group).The immune function,efficacy,survival,toxicity and quality of life were evaluated and compared between two groups. Results After 3 cycles of treatment,no significant difference was observed between 2 groups regarding CD3+,CD3+CD4+,CD3+CD8+,NK,NKT,Treg, CD4+T cells,IFN-γ,IL-2,TNF-αindex and other indicators(all P>0.05).Log-Rank test showed that the median progress-free survival(PFS)(7 months,95%CI=6.4~7.6)and median overall survival(OS)(14.5 months,95%CI=13.4~15.6)in DC-CIK group were significantly longer than those in chemotherapy group(both P<0.01).The incidence of leukopenia(22.0%,11/50)in DC-CIK group was lower than that in chemotherapy group(P<0.05).The quality of life scores in DC-CIK group were increased from 51.1±6.2 before treatment to 62.3±5.2 after treatment(t=15.413,P<0.01). Conclusion DC-CIK immunotherapy combined with chemotherapy can significantly improve immune function,progression-free survival and overall survival and the quality of life for patients with advanced colorectal cancer.
DC-CIK Immunotherapy Colorectal cancerEfficacy Survival analysis
2014-12-18)
(本文编辑:胥昀)
无锡市卫生局面上项目(ML201318)
214400 江阴,东南大学医学院附属江阴医院肿瘤科(翁海光系进修医师,现在浙江普陀医院消化内科工作)
沈冬,E-mail:wdmao_jy@163.com
