西妥昔单抗联合放化疗治疗局部进展期非小细胞肺癌的临床研究
2015-01-18赖霄晶周霞谷庆许亚萍刘冠徐裕金封巍孙晓江郑晓
赖霄晶 周霞 谷庆 许亚萍 刘冠 徐裕金 封巍 孙晓江 郑晓
西妥昔单抗联合放化疗治疗局部进展期非小细胞肺癌的临床研究
赖霄晶 周霞 谷庆 许亚萍 刘冠 徐裕金 封巍 孙晓江 郑晓
目的 初步观察西妥昔单抗联合放、化疗治疗局部进展期非小细胞肺癌(NSCLC)的临床疗效和不良反应,并与顺铂联合长春瑞滨(NP)方案诱导加同步放、化疗进行对比。方法 将18例局部晚期NSCLC患者随机分为两组,治疗组10例患者采用西妥昔单抗联合放、化疗的方案治疗。对照组8例患者采用NP方案诱导加同步放、化疗治疗。比较两组患者的生存情况、近期疗效及不良反应。结果 治疗组患者总生存时间(OS)较对照组显著延长(19.0个月vs 15.0个月,P<0.05),客观缓解率(ORR)也明显高于对照组(75.0%vs 12.5%,P<0.05)。治疗组除痤疮样皮疹发生率明显高于对照组外(60.0%vs 0.0%,P<0.01),两组患者其他不良反应均无统计学差异(均P>0.05)。结论 西妥昔单抗联合放、化疗治疗局部进展期NSCLC,与单用放、化疗比较,近期疗效显著,能够延长患者OS,且不良反应无明显增加,患者可以耐受。
西妥昔单抗 放疗 化疗 毒副反应 非小细胞肺癌
2012年卫生部公布统计显示,我国肺癌病死率为30.83/10万,居恶性肿瘤的首位。不同性别的恶性肿瘤相关死亡中,肺癌引起的死亡亦均占首位。经过20余年的多项Ⅲ期临床研究,同期放、化疗已成为局部进展期非小细胞肺癌(NSCLC)的标准治疗模式。然而,即使应用高强度的治疗,患者的5年总生存率仍然低于20.0%。为了进一步提高综合治疗的疗效,近年来出现了很多新药,包括细胞毒药物和靶向治疗药物,提高了治疗有效率,延长了患者中位总生存时间(OS)。2004年2月西妥昔单抗(cetuximab,erbitux,IMC-C225)经美国FDA批准上市,作为抗表皮生长因子受体(EGFR)的人/鼠嵌合型单克隆抗体[1],在肠癌、头颈部鳞癌、NSCLC等肿瘤的临床治疗中取得了很好的疗效[2-4]。在一系列评价西妥昔单抗的抗肿瘤活性和安全性的临床前研究以及Ⅰ/Ⅱ/Ⅲ期临床试验中都证实,西妥昔单抗与放、化疗具有协同作用,而且不良反应并没有明显增加[5]。本研究使用西妥昔单抗联合顺铂/长春瑞滨(NP)方案诱导加同步放、化疗治疗局部进展期NSCLC,与NP方案诱导加同步放、化疗的近期疗效和不良反应进行对比,为进一步研究西妥昔单抗在NSCLC治疗中的临床价值提供依据。
1 对象和方法
1.1 对象 2010年5月至2011年5月我院收治的局部进展期(ⅢA~ⅢB期)NSCLC初治患者18例,均经病理组织及影像学检查确诊,所有患者均为男性。年龄45~72岁,中位年龄61岁。根据NSCLC分期标准,ⅢA期12例,ⅢB期6例。鳞癌14例,腺癌1例,NSCLC未定型3例。所有患者均有CT可以客观评估的肿瘤病灶。患者治疗前三大常规、肝肾功能、心电图正常。无重要器官功能严重损害,体力状况ECOG评分0~1级,见表1。所有患者采用随机数字表法分成治疗组和对照组,其中治疗组10例,对照组8例。两组患者的一般情况、临床资料方面比较均无统计学差异(均P>0.05),见表1。所有患者治疗前均签署知情同意书。

表1 两组患者的一般资料比较
1.2 治疗方法 治疗组患者西妥昔单抗首剂负荷剂量400mg/m2,静脉滴注120min,以后每周给药1次,剂量250mg/m2,静脉滴注60min,最大滴注速率不超过5ml/ min,联合NP方案诱导及同步放、化疗。NP方案诱导化疗为:顺铂70~75mg/m2,静脉滴注,第1天;长春瑞滨25mg/m2,静脉滴注,第1、8天,治疗2个周期。同步化疗方案为:顺铂20~25mg/m2,静脉滴注,第1~3天;长春瑞滨12.5mg/m2,静脉滴注,第1、8天。胸腔放疗采用三维适形放疗(3D-CRT)或调强放疗(IMRT),总剂量60.0~66.0Gy。脊髓Vmax<40.0Gy;肺V5<55.0%,V20<30.0%,平均肺剂量(MLD)<17.0Gy;心脏V40<40.0%。对照组患者诱导及同步放、化疗方案均同于治疗组。
1.3 疗效评定标准 治疗结束后复查胸部CT以明确肿瘤病灶大小及消退情况,用以评价近期疗效。采用RECIST实体瘤客观疗效评价标准进行评价,分为完全缓解(CR)、部分缓解(PR)、病灶稳定(SD)和疾病进展(PD)。疾病控制率(DCR)是指经治疗后获得缓解(CR+ PR)和SD的病例数占整个可评价病例数的百分比。客观缓解率(ORR)指肿瘤缩小达到一定量并且保持一定时间的病例,即CR+PR病例的百分比。不良反应按照美国国立癌症中心常见毒性标准(NCI-CTC 3.0版)进行分级,共分为0~Ⅳ级。治疗期间每周复查血常规,肝肾功能、血电解质,同时详细记录肺炎、食管炎、乏力、腹泻、恶心、呕吐、皮肤黏膜等不良反应情况。
1.4 统计学处理 采用SPSS 16.0统计软件,并绘制生存曲线。无进展生存时间(PFS)及OS采用Kaplan-Meier方法进行分析;DCR、ORR及不良反应发生率的组间比较均应用χ2检验。
2 结果
2.1 两组患者治疗完成情况比较 治疗组中2例患者分别因严重的肺部感染及心脏疾患而终止抗肿瘤治疗退出研究,其余8例患者完成全部治疗,均持续使用西妥昔单抗3个周期。对照组8例患者均顺利完成治疗计划。
2.2 两组患者近期疗效比较 治疗组患者中CR 4例、PR 2例、SD 0例、PD 2例,ORR为75.0%(6/8),对照组患者中CR 0例、PR 1例、SD 3例、PD 4例,ORR为12.5%(1/8),治疗组明显优于对照组(P<0.05);两组患者的DCR分别为75.0%(6/8)和50.0%(4/8),两组比较无统计学差异(P>0.05)。
2.3 两组患者生存情况比较 所有患者随访至2013年7月,随访时间9.0~36.0个月,中位随访时间18.0个月。治疗组患者中位OS为19.0个月,对照组中位OS为15.0个月,比较有统计学差异(P<0.05),见图1。治疗组患者的中位PFS为7.0个月,对照组的中位PFS为5.0个月,两组PFS比较无统计学差异(P>0.05),见图2。
2.4 两组患者不良反应比较 两组患者中最常见的不良反应有骨髓抑制、肺炎、食管炎、腹泻、乏力、恶心、呕吐、口腔炎、肝功能损害、皮疹等。治疗组中1例患者因心脏疾患退出研究,系因年龄较大,心脏功能欠佳,而非药物本身引起的心脏不良反应导致退出。治疗组10例患者中4例出现Ⅰ度皮疹,2例出现Ⅱ度皮疹,皮疹发生率为60.0%;对照组8例患者均未出现皮疹,皮疹发生率为0.0%,两组间比较有统计学差异(P<0.01)。治疗组患者中1例发生Ⅰ级肺炎,2例发生Ⅲ/Ⅳ级肺炎,而对照组患者中仅有1例出现Ⅰ级肺炎,两组肺炎发生率比较无统计学差异(P>0.05)。治疗组1例患者发生Ⅰ级食管炎,而对照组患者未发生食管炎,两组间比较无统计学差异(P>0.05)。其余不良反应发生率两组间均无统计学差异(均P>0.05),见表2。
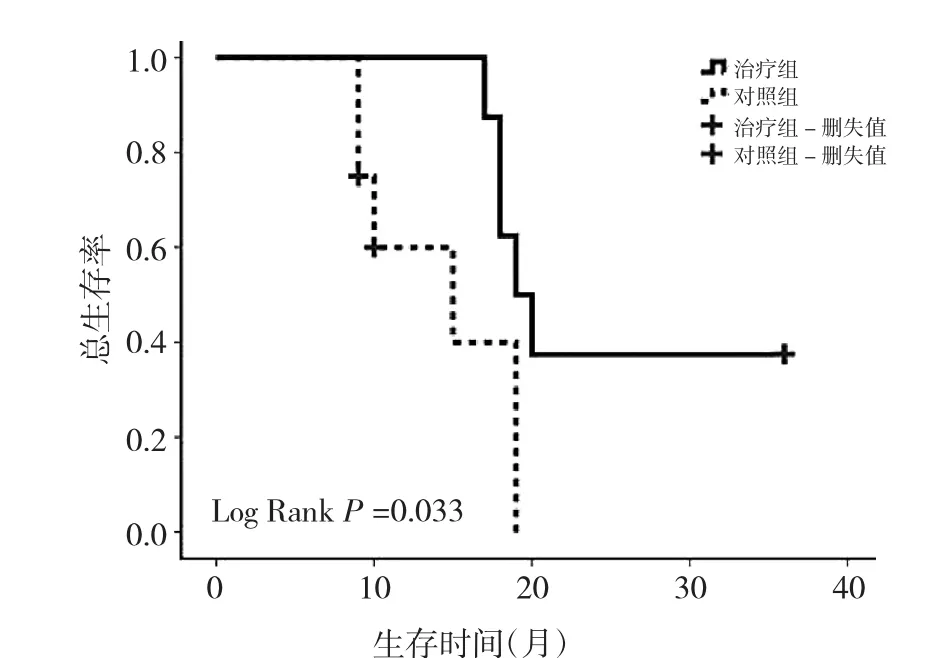
图1 两组患者的OS曲线

表2 两组患者不良反应比较(例)
3 讨论
分子靶向治疗是21世纪抗肿瘤治疗的重大进展,主要针对肿瘤的特异性分子进行治疗。EGFR是一种受体酪氨酸蛋白激酶,分布与细胞膜表面,是表皮生长因子(EGF)家族的受体。EGFR突变可以导致其过表达或活性明显增加,在头颈部鳞癌、肺癌、乳腺癌及脑胶质瘤等多种恶性肿瘤中均发现EGFR突变,可能与肿瘤的发生、发展、侵袭、转移、肿瘤细胞增殖、凋亡抑制以及血管新生有关[6-7]。目前用于NSCLC临床治疗的EGFR酪氨酸激酶抑制剂(EGFR-TKI)主要有:吉非替尼(Iressa)、厄洛替尼(Tarceva)及埃克替尼(icotinib)。西妥昔单抗是第一个获准上市的靶向EGFR单克隆抗体,在转移性结直肠癌、头颈部鳞癌、NSCLC治疗中取得很好的疗效。

图2 两组患者的PFS曲线
本试验中,18例NSCLC患者中有14例病理类型为鳞癌。对于局部进展期的肺鳞癌,放、化疗为其主要治疗手段,鳞癌细胞对射线有中度的敏感性,病变以局部侵犯为主,转移相对较晚,故多采用根治性放疗。为了提高疗效,更好的达到根治的目的,探索增加放、化疗敏感性的新方法变得尤为重要。在放疗过程中联合使用EGFR-TKI可以解决放疗后期肿瘤的放射抵抗,增加对肿瘤的杀伤能力。Raben等[8]的研究发现,在对西妥昔单抗敏感的肺癌细胞株H292的裸鼠移植瘤模型中,西妥昔单抗具有放疗及放、化疗增敏作用。在评价西妥昔单抗的抗肿瘤活性和安全性的一系列临床前研究以及Ⅰ/Ⅱ/Ⅲ期临床试验中都证实西妥昔单抗与放、化疗具有协同作用,且其不良反应可以耐受。Ramalingam等[9]的一项Ⅱ期多中心临床试验入组了40例不可手术切除的ⅢA/ⅢB期NSCLC患者,患者接受了63.0~73.5Gy的胸部放疗,同时给予西妥昔单抗同步治疗,后续给予紫杉醇、卡铂方案巩固化疗,最终患者的中位OS为19.4个月,中位PFS为9.3个月,31例可评估疗效的患者ORR达到了67.0%,证实西妥昔单抗对于Ⅲ期NSCLC患者有效,胸部放疗和巩固化疗的患者对西妥昔单抗耐受性良好,而且食管炎的发病率低。
这些基础及临床研究为西妥昔单抗联合放、化疗治疗Ⅲ期NSCLC提供了理论依据。美国肿瘤放射治疗协作组织(RTOG)的一项单臂Ⅱ期临床试验(RTOG 0324)显示了西妥昔单抗联合紫杉醇、卡铂化疗及放疗可以显著延长ⅢA/ⅢB期NSCLC患者中位OS至22.7个月[5]。进一步提示西妥昔单抗联合放、化疗对Ⅲ期NSCLC治疗具有一定的可行性。本研究中,治疗组8例局部进展期NSCLC患者,均给予西妥昔单抗联合NP方案治疗3个周期,再给予西妥昔单抗联合NP方案治疗加同期胸腔放疗,中位OS为19.0个月,而对照组患者的中位OS为15.0个月,两组比较有统计学差异。两组患者的中位PFS分别为7.0个月及5.0个月,无统计学差异,可能与本研究入组病例数少有关,还需积累资料进一步观察。治疗组患者ORR为75.0%,而对照组为12.5%,提示西妥昔单抗联合放、化疗方案治疗局部进展期NSCLC患者,临床近期疗效明显优于单用放、化疗方案。
现有的临床资料显示,患者对西妥昔单抗的耐受性好,不良反应多为轻至中度,且不明显增加放、化疗的毒性。本研究中治疗组的皮疹发生率为60.0%,患者均可以耐受;而对照组8例患者均未发生痤疮样皮疹,其他不良反应均无统计学差异。2014年一项Meta分析表明,在实体恶性肿瘤患者中,痤疮样皮疹的发生与西妥昔单抗抗肿瘤作用密切相关,与患者的PFS、OS及ORR呈正相关[10]。
瑞典肺癌研究组(SLCSG)的一项Ⅱ期临床试验中,在多西紫杉醇、顺铂诱导化疗后,放疗的同时联合西妥昔单抗治疗,患者Ⅲ级以上食管炎和肺炎发生率明显低于大部分同步化疗方案[11]。Ⅱ期临床试验RTOG 0324中观察到Ⅲ级以上食管炎发生率为8.0%,Ⅲ级以上肺炎发生率为7.0%[5]。Ⅱ期临床试验CALGB 30407中,放、化疗联合或不联合西妥昔单抗,患者食管炎发生率分别为16.0%和13.0%,肺炎发生率分别为12.0%和10.0%,均无统计学差异[12]。本研究中,治疗组患者有1例发生Ⅰ级肺炎,2例发生Ⅲ级以上肺炎,而对照组患者中仅有1例出现Ⅰ级肺炎;治疗组有1例发生Ⅰ级食管炎,而对照组患者未观察到食管炎的发生,两组间比较均无统计学差异。因此,笔者认为西妥昔单抗联合放、化疗治疗局部进展期NSCLC,具有一定的可行性,其不良反应尚可耐受,但由于入组病例数较少,仍需进一步研究进行验证。
综上所述,笔者认为西妥昔单抗联合NP方案放、化疗治疗Ⅲ期NSCLC具有一定的可行性,且不良反应并未明显增加,西妥昔单抗引起的痤疮样皮疹患者均可耐受,本研究为Ⅲ期NSCLC患者的治疗提供了新的方向和依据。
[1] Ensinger C,Sterlacci W.Implications of EGFR PharmDx kit for cetuximab eligibility[J].Expert Rev MolDiagn,2008,8(2):141-148.
[2] Starling N,Cunningham D.Cetuximab in previously treated colorectalcancer[J].Clin ColorectalCancer,2005,5 Suppl1:S28-33.
[3] Steins M B,Reinmuth N,Bischoff H,et al.Targeting the epidermal growth factor receptor in non-small cell lung cancer[J]. Onkologie,2010,33(12):704-709.
[4] Burtness B,Goldwasser M A,Flood W,et al.Phase III randomized trial of cisplatin plus placebo compared with cisplatin plus cetuximab in metastatic/recurrent head and neck cancer:an Eastern Cooperative Oncology Group study[J].J Clin Oncol,2005, 23(34):8646-8654.
[5] Blumenschein G R Jr,Paulus R,Curran W J,et al.Phase II study of cetuximab in combination with chemoradiation in patients with stage IIIA/B non-small-cell lung cancer:RTOG 0324[J].J Clin Oncol,2011,29(17):2312-2318.
[6] De Luca A,Carotenuto A,Rachiglio A,et al.The role of the EGFR signaling in tumor microenvironment[J].J Cell Physiol,2008,214 (3):559-567.
[7] Amann J,Kalyankrishna S,Massion P P,et al.Aberrant epidermal growth factor receptor signaling and enhanced sensitivity to EGFR inhibitors in lung cancer[J].Cancer Res,2005,65(1):226-235.
[8] Raben D,Helfrich B,Chan D C,et al.The effects of cetuximab alone and in combination with radiation and/or chemotherapy in lung cancer[J].Clin Cancer Res,2005,11(2 Pt 1):795-805.
[9] Ramalingam S S,Kotsakis A,Tarhini A A,et al.A multicenter phase II study of cetuximab in combination with chest radiotherapy and consolidation chemotherapy in patients with stage III non-smallcelllung cancer[J].Lung cancer,2013,81(3):416-421.
[10] Abdel-Rahman O,Fouad M.Correlation of cetuximab-induced skin rash and outcomes of solid tumor patients treated with cetuximab:a systematic review and meta-analysis[J].Crit Rev Oncol Hematol,2015,93(2):127-135.
[11] Hallqvist A,Wagenius G,Rylander H,et al.Concurrent cetuximab and radiotherapy afterdocetaxel-cisplatin induction chemotherapy in stage III NSCLC:satellite-a phase II study from the Swedish Lung Cancer Study Group[J].Lung cancer, 2011,71(2):166-172.
[12] Govindan R,Bogart J,Stinchcombe T,et al.Phase II study of pemetrexed,carboplatin and thoracic radiation with or without cetuximab in patients with locally advanced unresectable non-small cell lung cancer:Cancer and Leukemia Group B trial 30407[J].J Clin Oncol,2011,29(23):3120-3125.
Cetuximab combined with chemoradiotherapy for locally advanced non-small cell lung cancer
LAI Xiaojing,ZHOU Xia,GU Qing, et al.
Department of Radiation Oncology,Zhejiang Key Laboratory of Diagnosis and Treatment on Thoracic Oncology(Lung and Esophagus),Zhejiang Cancer Hospital,Hangzhou 310022,China
【 Abstract】 Objective To evaluate the clinical efficacy and adverse events of cetuximab combined with chemoradiotherapy for locally advanced non-small cell lung cancer(NSCLC)in comparison of chemoradiotherapy alone. Methods A total of 18 patients with locally advanced NSCLC were randomly assigned to two groups:10 patients in trial group were treated with cetuximab in combination with chemoradiotherapy,and 8 patients in control group were treated with concomitant chemoradiotherapy alone.The survival,efficacy and adverse events of two groups were analyzed. Results The overall survival(OS)of patients in trial group was significantly prolonged than that in control group(19.0 months vs 15.0 months,P<0.05).The objective response rate(ORR)of trial group was higher than that in control group(75.0%vs 12.5%,P<0.05).The incidence of acne-like rash in trial group was significantly higher than that in control group(60.0%vs 0.0%,P<0.01),while there was no significant difference in other adverse events between two groups(P>0.05). Conclusion Cetuximab combined with chemoradiotherapy has better efficacy and prolong overall survival for patients with locally advanced NSCLC in comparison with chemoradiotherapy alone,and the toxicities are tolerable.
Cetuximab Radiotherapy Chemotherapy Toxicity Non-small cell lung cancer(NSCLC)
2015-01-04)
(本文编辑:胥昀)
浙江省医药卫生科技计划项目(2011KYB024)
310022 杭州,浙江省肿瘤医院放疗科,浙江省胸部肿瘤(肺、食管)诊治技术研究重点实验室
郑晓,E-mail:zhengxiao@zjcc.org.cn
