天然马尾松林细根生物量分布及其与土壤理化性质相关性研究*
2015-01-17肖欣韩天一欧阳勋志
肖欣,韩天一,欧阳勋志
(1.江西农业大学林学院,江西 南昌330045;2.江西省林业调查规划研究院,江西 南昌330046)
细根 (直径<2 mm)是森林生态系统重要的动态组成部分,也是森林根系系统中最活跃的部分[1~2],细根的快速生长、死亡、分解及周转使其在土壤养分及碳循环中起着关键的作用[3]。研究表明,每年通过枯死细根向土壤归还的碳、养分和能量甚至超过了地上部分枯落物[4~5],森林生态系统如果忽略植物根 (尤其是细根)的作用,有机质及养分归还将被低估20% ~80%[6]。植物的细根是受环境影响反应最敏感的部分,其现存量、形态及分布会随着树种、林龄、土壤水分、土壤养分及土壤温度的改变而发生变化[7~8]。同时,细根的生命活动旺盛,周转快,它的死亡会将大量物质和养分带入土壤[9]。所以,细根与土壤之间存在相互作用与影响,在全球二氧化碳浓度升高及氮沉降增加等背景下,细根作为森林生态系统养分循环与能量流动的重要环节,通过某一树种不同生长阶段林分中细根现存量及其与土壤水分、养分的相关机制研究对揭示森林生态系统生产力的形成机制及细根在养分循环中的作用等具有一定的理论意义。
马尾松 (Pinus massoniana)是我国南方地区天然分布最广的乡土树种之一,其适应性强,且耐干旱与贫瘠,在亚热带森林自然资源中占有重要地位。目前,对马尾松细根生物量的研究较少,且多是围绕马尾松人工林开展的[7,10~11]。本项目通过对吉安市不同发育阶段天然马尾松林的细根生物量分布特征及其与土壤理化性质关系的研究,以期为全面了解其细根在森林生态系统养分循环及碳平衡中的作用提供参考依据。
1 研究区概况
研究区吉安市位于江西省中部,赣江中游,地理位置介于北纬 25°58'32″~ 27°57'50″,东经113°46'~115°56'之间,属中亚热带湿润季风气候区,四季分明,年平均气温17.7℃,年均降水1 553 mm,平均降雨日为166天,无霜期约为280天。地貌以山地、丘陵为主,境内地带性土壤为红壤,约占各土壤总面积的60%,土层厚度多为20~100 cm,腐殖质层为3~20 cm,土壤偏酸性。植被类型主要有针叶林、常绿阔叶林、针阔混交林、竹林等。吉安市林业用地面积为175.60×104hm2,乔木林总面积为135.29×104hm2,其中马尾松林面积占全市乔木林总面积的19.7%。天然马尾松林下植被主要有檵木 (Loropetalum chinense)、金樱子 (Rosa laevigata)、栀子 (Gardenia jasminoides)、铁芒萁 (Dicranopteris linearis)等。
2 材料与方法
2.1 标准地的选取
2011年7月,在天然马尾松群落内按照国家林业局《森林资源规划设计调查主要技术规定》(2003)中的龄组划分标准,分幼、中、近、成、过5个龄组选择立地条件相近的马尾松天然林标准地,每个龄组3个重复,共设置15个标准地,标准地大小为28.28 m ×28.28 m(0.08 hm2)。标准地概况见表1。
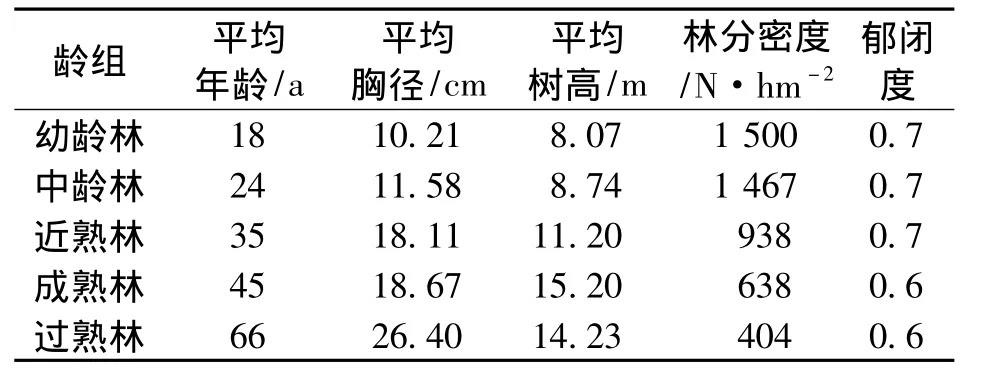
表1 标准地概况Tab.1 The basic situation of sample plots
2.2 细根样品采集及生物量测定
细根生物量采用土钻法,土钻直径5 cm。在每个标准地的上、中、下部位分别设置3~4个采样点,采集0~20 cm,20~40 cm的土芯8~10个,分层混合装袋,带回室内将样品用流动水浸泡、漂洗、过筛,拣出直径<2 mm的根系。根据外形、颜色和弹性区分死根和活根,称取鲜重,并取一定数量的根样在65℃烘箱中烘干至恒重,计算干重率,换算出单位面积细根现存量。细根生物量的计算公式为[8],B=m/〔π (d/2)2×10-4〕,式中,B代表细根生物量 (g/m2),m为平均每根土芯细根干重 (g),d为土钻直径 (cm)。
2.3 土壤样品的采集及理化性质的测定
在每块标准地的上、中、下部位分别选择具有代表性的地块挖取土壤剖面,按0~20 cm、20~40 cm两个层次分层采集土壤样品,并分层混合装袋,带回实验室分析。土壤含水率用烘干法测定;容重采用环刀法测定;土壤有机碳用重铬酸钾-外加热法测定;土壤全氮采用靛酚蓝比色法测定;全磷用碱熔-钼锑抗比色法测定。
2.4 数据分析及处理
用SPSS 17.0进行数据统计分析,用 EXCEL 2003对数据进行汇总、计算,并制作图表。
3 结果与分析
3.1 细根生物量特征
3.1.1 细根现存量及分布
不同土层及龄组的细根生物量见表2。0~20 cm、20~40 cm土层活细根生物量分别介于85.40~136.45 g/m2与 22.79 ~34.51 g/m2之间,死细根生物量分别介于 28.97~58.88 g/m2与 7.60~14.70 g/m2之间。各土层所有类型 (包括活细根、死细根和细根总)生物量均随林龄的增加呈现先减小后增加的规律,0~40 cm土层不同龄组总细根生物量大小表现为:过熟林>幼龄林>成熟林>中龄林>近熟林。方差分析表明,同一土层不同龄组所有类型生物量之间均无显著差异 (P>0.05);各龄组所有类型生物量均表现为0~20 cm土层大于20~40 cm土层。
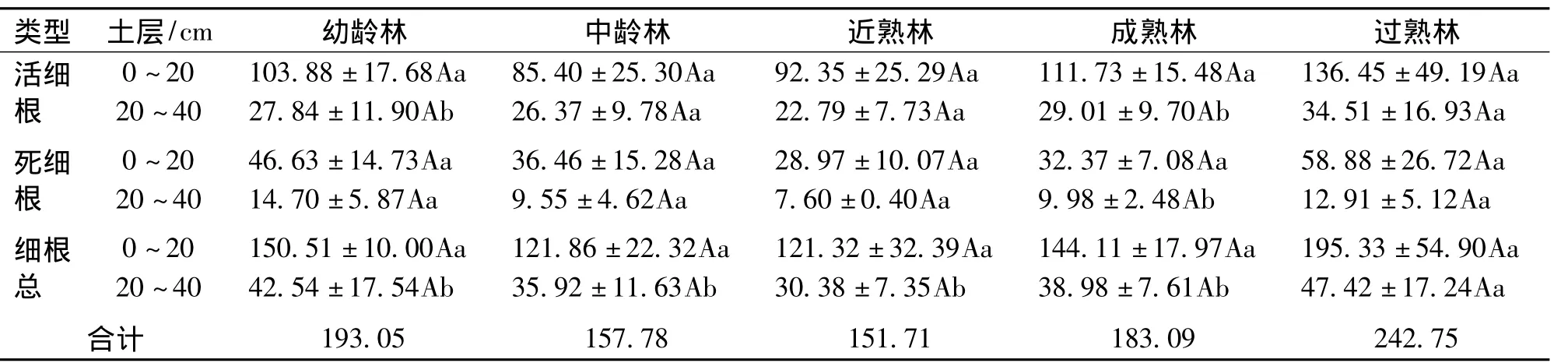
表2 各龄组细根生物量及分布Tab.2 Fine root biomass and its distribution of each age group
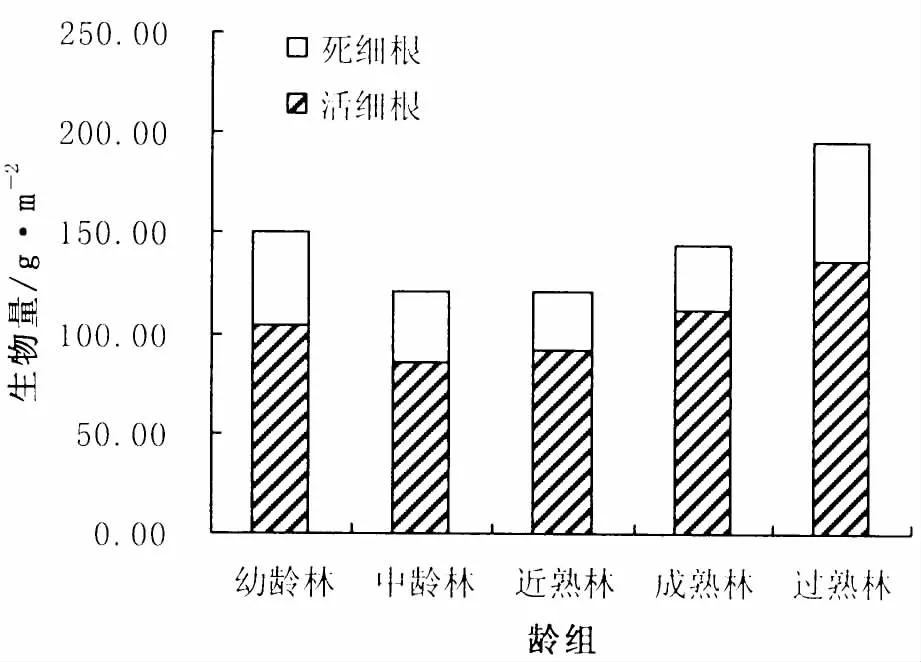
图1 0~20 cm土层活、死细根生物量分配Fig.1 Distribution of live,dead fine root biomass in 0~20 cm layer
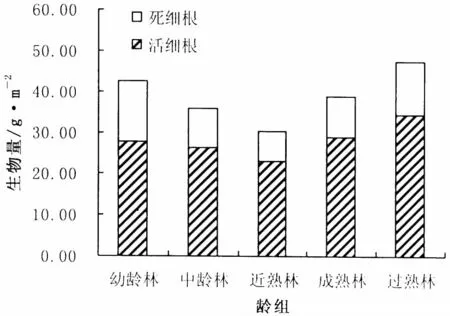
图2 20~40 cm土层活、死细根生物量分配Fig.2 Distribution of live,dead fine root biomass in 20~40 cm layer
3.1.2 细根生物量分配特征
从图1~2中可以看出,各土层细根总生物量中活细根生物量占大部分比例,0~20 cm土层中活细根、死细根生物量比例分别介于69.02% ~77.54%与 22.46% ~30.98% 之间;20 ~ 40 cm土层分别介于 65.45% ~75.00%与 25.00% ~34.55%之间。相对而言,20~40 cm土层中死细根的比例较0~20 cm土层大。
3.2 土壤理化性质及其特征
3.2.1 土壤含水率与容重
从表3中可以看出,0~20 cm土层含水率、容重分别介于 10.13% ~ 23.26% 与 1.24 ~1.35 g/cm3之间;20~40 cm土层分别介于10.11% ~21.46%与1.31 ~1.56 g/cm3之间。两土层不同龄组间含水率均表现为成熟林显著大于幼龄林 (P<0.05);各龄组0~20 cm土层含水率均大于20~40 cm土层,但两者差异未达显著水平 (P>0.05)。两土层不同龄组间土壤容重差异不显著(P>0.05),且随着林龄的增加无明显变化规律;各龄组20~40 cm土层土壤容重均大于0~20 cm土层,除幼龄林外差异均未达显著水平 (P>0.05)。

表3 各龄组土壤含水率与容重Tab.3 Soil moisture and bulk density of each age group
3.2.2 土壤碳氮磷含量及分布
0~20 cm、20~40 cm土层有机碳含量分别介于24.55~32.14 g/kg 与 7.11 ~11.02 g/kg之间。方差分析结果表明各龄组0~20 cm土层有机碳含量均显著高于20~40 cm土层 (P<0.05)。0~20 cm土层有机碳含量占整个土层比例在70.03% ~78.30%之间,可见,土壤有机碳大部分储存在表层 (0~20 cm)土中。从图3可以看出,各土层土壤有机碳含量随林龄的增加无明显的变化规律,方差分析结果表明,各土层不同龄组间有机碳含量无显著差异 (P>0.05)。
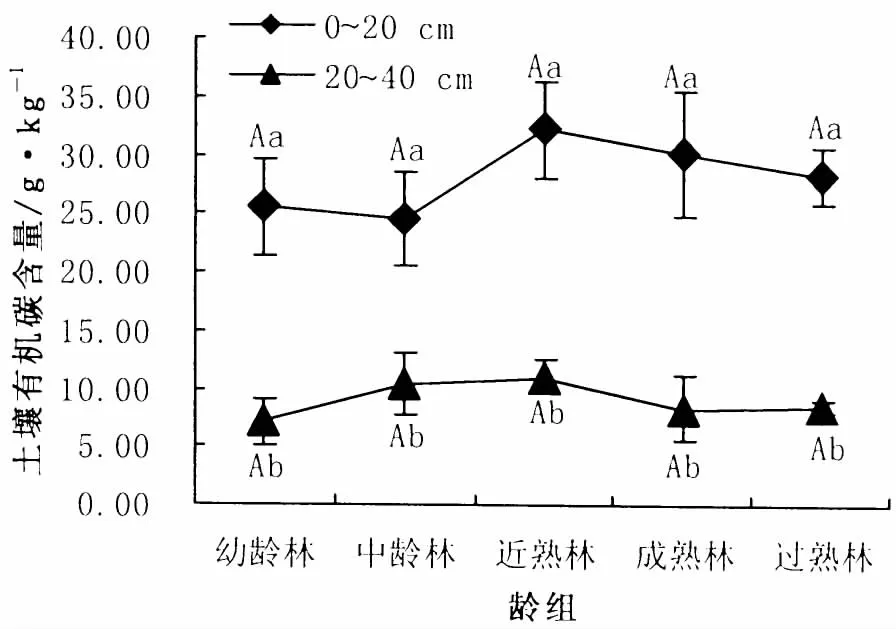
图3 各龄组土壤有机碳含量Fig.3 Organic carbon content of each age group
0~20 cm、20~40 cm土层全氮含量分别介于1.56 ~2.63 g/kg与0.78 ~1.18 g/kg之间。各土层全氮含量均随林龄的增加而增加 (图4)。方差分析结果表明,各土层不同龄组间全氮含量无显著差异 (P>0.05)。近、成、过熟林0~20 cm土层全氮含量显著高于20~40 cm土层 (P<0.05),幼、中龄林无显著差异 (P>0.05)。0~20 cm土层全氮含量占整个土层大部分比例,在62.96% ~69.19%之间。
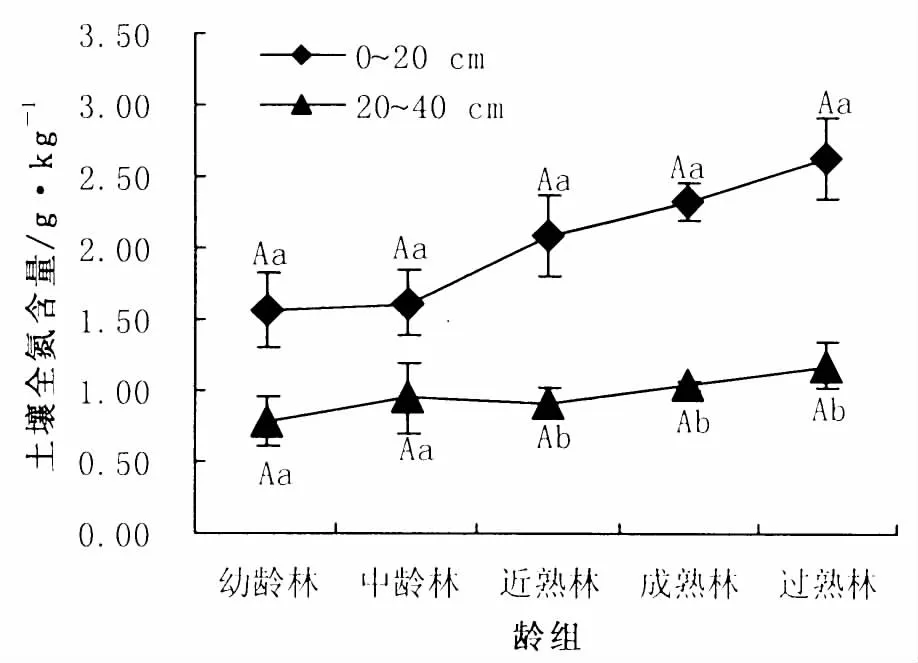
图4 各龄组土壤全氮含量Fig.4 Nitrogen content of each age group
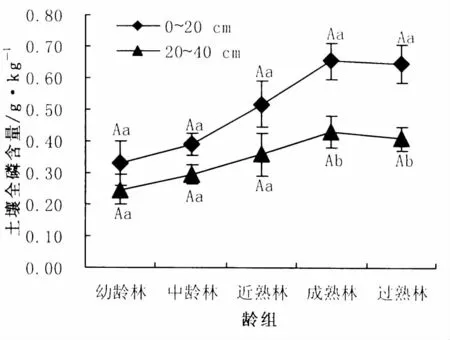
图5 各龄组土壤全磷含量Fig.5 Phosphorus content of each age group
从图5中可以看出,各土层全磷含量呈现出先升高后降低的趋势,表现为成熟林最高,分别为0.65 g/kg和0.43 g/kg;幼龄林最低,分别为0.33 g/kg和0.25 g/kg。方差分析结果表明,各土层不同龄组全磷含量之间无显著差异 (P>0.05);成、过熟林0~20 cm土层全磷含量显著高于20~40 cm土层 (P<0.05),其他龄组间差异未达显著水平(P>0.05)。0~20 cm土层全磷含量占整个土层比例依然较大,在56.78% ~61.30%之间。
3.3 细根生物量与土壤理化性质的关系
为了探讨细根 (活、死细根)生物量与土壤理化性质之间的关系,现将其分别0~20 cm、20~40 cm两土层进行相关性分析,因每个龄组细根生物量及土壤理化性质重复数据仅有3组,对两者之间的相关关系代表性不强,故本项研究不再细分为各个龄组对其相关性进行探讨。0~20 cm土层分析结果见表4。
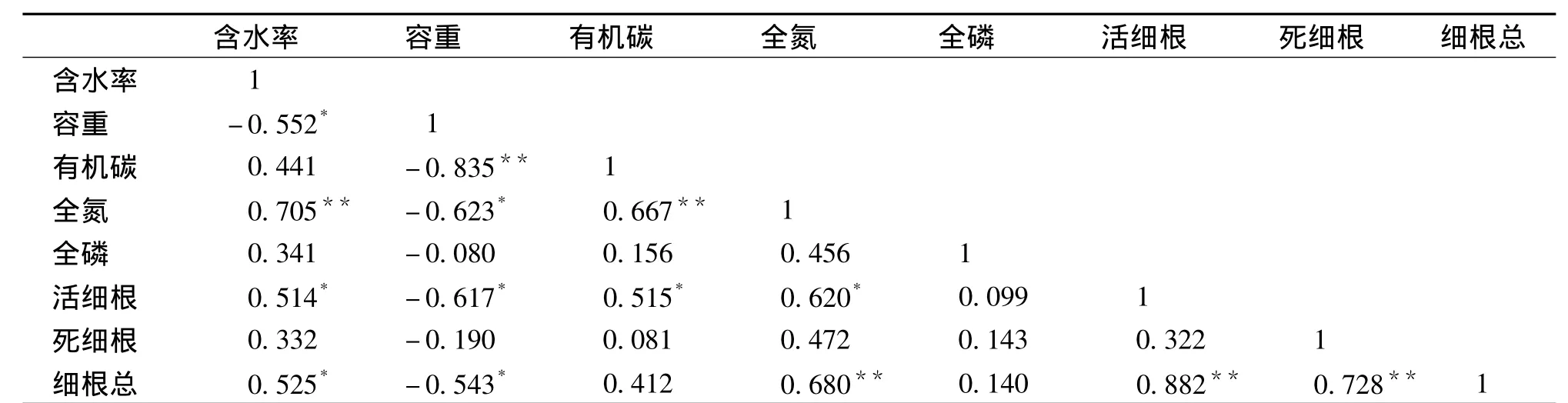
表4 0~20 cm土层细根生物量与土壤性质的相关性Tab.4 Correlation between fine root biomass in 0 ~20 cm layer and soil properties
从表4中可以看出,0~20 cm土层中,活细根生物量与土壤含水率、容重及有机碳、全氮含量相关性显著 (P<0.05),其中活细根生物量与土壤容重呈显著负相关 (P<0.05),与土壤全磷含量相关性不显著 (P>0.05);死细根生物量与土壤理化性质之间的相关关系均不显著 (P>0.05);细根总生物量与土壤含水率、容重及全氮含量相关性显著 (P<0.05),其中细根总生物量与容重呈显著负相关,与全氮含量相关性达极显著 (P<0.01)。
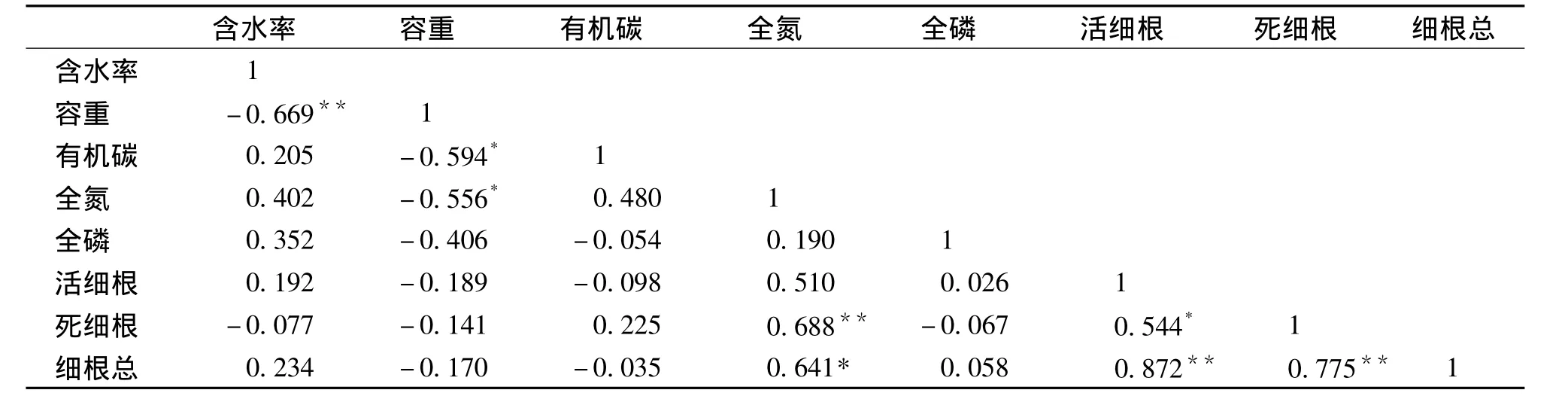
表5 20~40 cm土层细根生物量与土壤性质的相关性Tab.5 Correlation between fine root biomass in 20 ~40 cm layer and soil properties
随着土层深度的增加,20~40 cm土层所有类型 (包括活细根、死细根和细根总)生物量与土壤理化性质呈现与0~20 cm土层不尽相同的相关性 (表5)。活细根生物量与土壤理化性质之间相关性均未达显著水平 (P>0.05);死细根生物量与土壤全氮含量之间呈极显著的正相关关系 (P<0.01);细根总生物量与土壤全氮含量相关性也达到显著水平 (P<0.05)。0~20 cm及20~40 cm土层活、死细根生物量与细根总生物量均呈极显著的正相关关系 (P<0.01)。
4 结论与讨论
(1)吉安市天然马尾松林土壤细根总生物量为1.52 ~2.43 t/hm2,介于 Vogt对亚热带森林细根生物量研究结果 1.1 ~5.8 t/hm2之间[5],高于李树站等对湖南马尾松细根生物量的计算结果1.24 t/hm2[12]。不同龄组土壤细根总生物量大小表现为:过熟林>幼龄林>成熟林>中龄林>近熟林,刘波等对阔叶林细根生物量的研究表明,其大小表现为50年生 >18年生 >40年生的林分[13],虽然林分细根生物量随着林龄的增长不断积累[14],但是由于林分幼龄阶段腐殖质薄,随着大量凋落物在表层积累,使早期演替阶段根系分布较深,细根较多[13,15]。细根生物量大多集中在土壤表层 (0~20 cm),呈现明显的表层富集特征,这可能与土壤下层养分相对缺乏有关,且活细根占总细根生物量的比重较大,这与大部分学者研究结果一致[8,14,16 ~17]。
(2)对土壤理化性质的分析发现,土壤含水率与容重随林龄的增加无明显的变化规律,同一龄组土壤含水率均表现为随土层的加深而降低,容重则相反,这与张雷等对杉木林不同层次土壤理化性质的研究结果相同[8],但各龄组不同土层含水率及容重间差异基本未达显著 (P>0.05)。土壤有机碳、全磷含量随林龄的增加表现为先增加后减少的规律,全氮则随着林龄的增加而增加,各土层不同龄组碳氮磷含量之间差异均不显著 (P>0.05)。0~20 cm土层碳氮磷含量占整个剖面碳氮磷含量的比值达到56.78% ~78.30%,表明碳氮磷大部分都储存在土壤表层,这与大部分学者研究结果一致[8,11,18 ~19]。
(3)Vogt等通过大量研究分析发现,土壤养分状况是决定细根生物量的重要因素之一[6],本研究发现在同一气候及立地条件下,所有类型(包括活细根、死细根和细根总)生物量与土壤含水率、容重、有机碳或全氮之间都存在一定的相关关系。0~20 cm土层活细根及细根总生物量与土壤含水率、容重之间有着显著的相关关系 (P<0.05),与含水率之间表现为正相关,与容重呈负相关。土壤水分与植物细根生长有密切的关系[20],杨秀云等对落叶松林细根生物量的研究中发现土壤含水率与细根生物量显著正相关[21],Millikin等在研究中提出由于土壤表层容重较小,细根较易获得更多的氧气,故细根生物量大[22],而随着土层深度的增加,土壤容重增大,土壤中的氧气减少,所以没有表现出对细根生物量明显的促进关系。0~20 cm土层活细根生物量与土壤有机碳含量相关性显著 (P<0.05),裴智琴等提出每年通过细根周转进入土壤中的有机碳为 (16.83 ± 2.56)g/m2[23],故细根作为土壤有机碳的重要来源理应与土壤有机碳含量存在一定的相关关系。杨秀云、张雷等的研究表明土壤全氮含量与细根生物量之间存在明显的正相关 (P < 0.05)[8,21],这与本研究结果一致。随着土层深度的增加,20~40 cm土层所有类型细根生物量仅与土壤全氮含量呈显著正相关 (P<0.05),这可能与下层土壤有机碳、含水率相对较小有关。本研究得出土壤全氮含量在0~20 cm土层与活细根相关性显著 (P<0.05),在20~40 cm土层与死细根相关性显著 (P<0.05),郭大立等指出随着土壤氮有效性的提高,细根产量提高,周转率加快[24],Nadelhoffer[25]也在其研究中支持了这一假说,所以随着全氮含量的增加,细根周转率加快可能是导致下层土壤死细根生物量增加的主要原因,而土壤表层由于有足够的碳维持细根的寿命,细根周转率降低[24]。研究得出所有类型的细根生物量与土壤全磷含量无显著相关 (P>0.05),周玮等也发现细根单位面积生物量与全磷含量相关关系不明显[11],这可能是酸性红壤地区缺磷导致全磷含量偏低所致。
[1]Hendrick R L,Pregitzer K S.Temporal and depth-related patterns of fine root dynamics in northern hardwood forests[J].Journal of Ecology,1996(2):167-176.
[2]Wells C E,Eissenstat D M.Marked differences in survivorship among apple roots of different diameters[J].Ecology,2001,82(3):882-892.
[3]Silver W L,Thompson A W,McGroddy M E,et al.Fine root dynamics and trace gas fluxes in two lowland tropical forest soils[J].Global Change Biology,2005,11(2):290-306.
[4]Toland D E,Zak D R.Seasonal patterns of soil respiration in intact and clear-cut northern hardwood forests[J].Can.J.For.Res,1994,24:1711-1716.
[5]Vogt K A ,Grier C C,Vogt D J.Production turnover and nutrient dynamics of above-and-below ground detritus of world forests[J].Advances in Ecological Research,1986,15:303-377.
[6]Vogt K A,Vogt D J,Palmiotto P A,et al.Review of root dynamics in forest ecosys-tems grouped by climate,climatic forest type and species[J].Plant and Soil,1996,187(2):159-219.
[7]王力,汪永文,张令峰,等.不同混交比例马尾松林细根生物量及其养分研究[J].安徽农业大学学报,2010,37(2):317-323.
[8]张雷,项文化,田大伦,等.第2代杉木林土壤有机碳、全氮对细根分布及形态特征的影响[J].中南林业科技大学学报,2009,29(3):11-15.
[9]温达志,魏平,孔国辉,等.鼎湖山南亚热带森林细根生产力与周转[J].植物生态学报,1999,23(4):361-369.
[10]王光军,田大伦,闫文德,等.湖南马尾松人工林群落细根生物量及时空动态研究[J].中国水土保持,2009(5):38-40.
[11]周玮,周运超.马尾松细根与土壤养分含量研究[J].浙江林业科技,2009,29(6):6-10.
[12]李树战,田大伦,王光军,等.湖南4种主要人工林群落的细根生物量及时空动态[J].中南林业科技大学学报,2011,31(5):63-68.
[13]刘波,余艳峰,张贇齐,等.亚热带常绿阔叶林不同林龄细根生物量及其养分[J].南京林业大学学报(自然科学版),2008,32(5):81-84.
[14]杨丽韫,罗天祥,吴松涛.长白山原始阔叶红松(Pinus koraiensis)林及其次生林细根生物量与垂直分布特征[J].生态学报,2007,27(9):3609-3617.
[15]Grief C C,Vogt K A,Keyes M R,et al.Biomass distribution and above-and below-ground production in young and mature Abies amabicis zone ecosystem of the Washington Cascades[J].Can J For Res,1981,11:155-167.
[16]Yong Zhou ,Jiaqi Su ,Ivan A Janssens,et al.Fine root and litterfall dynamics of three Korean pine(Pinus koraiensis)forests along an altitudinal gradient[J].Plant and Soil,2014,374:19-32.
[17]徐钰,许凯,于水强,等.不同林龄杨树细根生物量分配及其对氮沉降的响应[J].生态学杂志,2014,33(3):583-591.
[18]向仕敏,陆梅,徐柳斌,等.5种林分类型林地土壤氮含量与其土壤微生物学性质的研究[J].西部林业科学,2008,37(1):41-45.
[19]马少杰,李正才,周本智,等.北亚热带天然次生林封山育林对土壤肥力质量的影响[J].江西农业大学学报,2011(2):328-334.
[20]林希昊,陈秋波,华元刚,等.不同树龄橡胶林土壤水分和细根生物量[J].应用生态学报,2011,22(2):331-336.
[21]杨秀云,韩有志,武小钢.华北落叶松林细根生物量对土壤水分、氮营养空间异质性改变的响应[J].植物生态学报,2012,36(9):965-972.
[22]Millikin C S,Bledsoe C S.Biomass and distribution of fine and coarse roots from blue oak(Quercus douglasii)trees in the northern Sierra Nevada foothills of California[J].Plant and Soil,1999,214:27-38.
[23]裴智琴,周勇,郑元润,等.干旱区琵琶柴群落细根周转对土壤有机碳循环的贡献[J].植物生态学报,2011,35(11):1182-1191.
[24]郭大立,范萍萍.关于氮有效性影响细根生产量和周转率的四个假说[J].应用生态学报,2007,18(10):2354-2360.
[25]Nadelhoffer K J.The potential effects of nitrogen deposition on fine-root production in forest ecosystems[J].New Phytologist,2000,147:131-139.
