丹皮酚对急性肝细胞损伤的保护作用
2015-01-17颜贵明宣自华李月月
颜贵明, 戴 敏, 宣自华, 李月月
(新安医学省部共建重点实验室,安徽中医药大学,安徽合肥230012)
[科研报道]
丹皮酚对急性肝细胞损伤的保护作用
颜贵明, 戴 敏*, 宣自华, 李月月
(新安医学省部共建重点实验室,安徽中医药大学,安徽合肥230012)
目的在乙醇诱导的体外大鼠肝细胞急性损伤导致谷草转氨酶 (AST)、谷丙转氨酶 (ALT)、丙二醛 (MDA)水平升高的模型基础上,探讨丹皮酚对大鼠肝细胞的直接保护作用。方法分别将肝细胞接种于培养瓶中培养传代,利用50mmol/L乙醇处理12 h建立急性大鼠体外肝细胞急性损伤模型,用含不同浓度丹皮酚(250、125、62.5、31.25、15.625μmol/L)的培养液与急性损伤肝细胞共孵育不同时间 (0.5、1、3、6、12、24 h),MTT比色法测定丹皮酚对肝细胞损伤的预防作用,赖氏法测定上清液ALT和AST的水平,硫代巴比妥法测定上清液MDA水平。结果丹皮酚(125μmol/L,12 h)可抑制乙醇对肝细胞的损伤,并明显降低乙醇致急性损伤肝细胞的ALT、AST释放量和MDA水平。结论丹皮酚体外给药抑制乙醇诱导肝细胞的ALT、AST和MDA释放,提示其具有对肝细胞损伤的直接保护作用。
乙醇;酒精性脂肪肝;丹皮酚(Pae);ALT;AST;MDA;保护作用
酒精滥用与酒精依赖已经成为当今社会一个重要的社会和医学问题。过量酒精的摄入严重影响肝脏的功能,鉴于此探索对酒精性肝细胞损伤具有保护作用的中药显得非常必要。任何新药的研究都需要选择合适的模型,现有报道的酒精性肝细胞损伤模型,慢性居多,并且大多数以酒精代谢指标、体内抗氧化指标、酶组织化学或病理学检查作为衡量依据,但关于酒精对体外肝细胞膜急性影响的研究很少。建立在动物实验的基础之上实验结果的实用性受一定的限制。
大量酒精进人机体后,在乙醇脱氢酶的作用下大量脱氢氧化,使三梭酸循环过程障碍和抑制脂肪酸氧化而影响脂质代谢。乙醇可致磷酸甘油增多导致甘油三酯合成增加,促进脂肪在肝细胞内沉积,同时乙醇能激活氧分子,氧自由基的产生导致肝细胞膜的脂质过氧化以及体内还原型谷胱甘肽的大量耗竭[1]。一般认为,氧化损伤、脂质过氧化损伤及免疫功能损伤等在乙醇导致肝细胞损伤机制中起主要作用,并且由乙醛所致的肝细胞氧化损伤更为突出,表现为GSH的耗竭及MDA增加[2]。
通常认为,酒精性肝细胞损伤实质上是由乙醇的氧化毒性所致,主要表现为乙醇能损害肝细胞利用氧的能力,促进细胞内的清道夫分子还原型谷胱甘肽耗竭,促进自由基介导的毒性作用和脂质过氧化作用[3-4]。但是,由于人类与动物的乙醇代谢酶以及乙醇的毒性反应种属间差异很大,从而建立在动物实验基础之上的实验结果的实用性受限制。由此,本研究以L-02细胞株为研究对象,排除其他因素,研究酒精对肝细胞的直接作用,以培养L-02细胞株上清液中谷丙转氨酶 (ALT)、谷草转氨酶 (AST)释放量,肝细胞中丙二醛 (MDA)作为细胞氧化损伤的指标,进行酒精诱导体外急性肝细胞氧化损伤的研究。MDA作为脂质过氧化终产物具有较强的细胞毒性,可造成细胞能量代谢障碍,使细胞功能受损。肝细胞损伤的程度和体内脂质过氧化的程度均可通过MDA水平直接或间接反映出来[5-9]。
丹皮酚(paeonal,Pae)是芍药科植物牡丹Paeonia Suffruticoas Andr.的干燥根皮及萝摩科植物徐长卿Cynanchum paniculatum(Bge.)Kitag.的干燥根及根茎中的有效成分之一[10]。现代研究表明,丹皮酚具有解热、镇痛、抗炎、降脂、抗氧化、抗血栓、抗肿瘤、抗动脉粥样硬化(AS)等广泛的药理作用[11]。本研究首次研究丹皮酚体外用药对酒精诱导的肝细胞细胞膜损伤、过氧化反应等过程是否有直接抑制作用,从而进一步验证丹皮酚对酒精性脂肪肝细胞保护作用的细胞学机制。
1 实验材料
1.1 药物 丹皮酚,宣城百草工贸有限公司提供,纯度大于99.8%,批号:100216。
1.2 细胞株 BRL大鼠正常肝细胞株L-02(中科院上海生物化学与细胞研究所)。
1.3 主要试剂 乙醇 (纯度 99%,批号 20100912);DMEM培养基 (Gibco公司,批号20081123);胰蛋白酶(Amersco公司,批号20090128);胎牛血清(美国Gibco公司,批号12100-038);二甲基亚砜DMSO(Sigma公司,批号20080324);台盼蓝染色细胞存活率检测试剂盒 (北京化学试剂厂,批号20081118);链霉素针剂 (规格为每支100万单位,华北制药股份有限公司,批号20101218);青霉素针剂 (规格为每支80万单位,华北制药股份有限公司,批号20101213);MTT(Amersco进口分装,武汉生命技术有限公司)。
1.4 主要溶液配制
1.4.1 PBS缓冲液的配制(pH 7.2) 精密称取Na2HPO4· 12H2O 3.49 g、KCl 0.2 g、NaCl 8.0 g、KH2PO40.2 g,溶于1 000mL ddH2O中。经121℃高压灭菌20min,4℃保存。
1.4.2 胎牛血清灭活 室温解冻胎牛血清,置于56℃水浴灭活30min,20mL分装,-20℃保存。
1.4.3 培养液的配制 DMEM培养液加1.8 g/L碳酸氢钠,10万IU/L青霉素,10万U/L硫酸庆大霉素,加入20%的Defined FBS。
1.4.4 细胞消化液的配制 含0.2%胰蛋白酶,配制方法:称取400mg胰蛋白酶,加入到200mL无钙、镁的PBS缓冲液中,振摇至全部溶解后滤过除菌,分装,-20℃保存备用。
1.4.5 MTT贮存液制备 MTT粉50 mg,溶于10 mL PBS中,使终质量浓度为5 mg/mL,0.22μm微孔滤膜过滤。棕色瓶,4℃保存,半月内备用。
1.4.6 丹皮酚药液的配制 精密称取丹皮酚1.66 mg,加入20μL二甲基亚砜(DMSO)使其溶解,吸取20 mL DMEM培养基充分混匀,配成浓度为500μmol/L的溶液,再依次将药液等比稀释成250、125、62.5、31.25、15.625 μmol/L,置于4℃冰箱保存,1周内备用。
1.5 主要仪器 CO2培养箱(日本Sanyo公司);培养/干燥箱 (上海一恒科技有限公司);LD4-8型低速离心机 (北京医用离心机厂);艾科浦超纯水系统 (重庆颐洋企业发展有限公司);灭菌锅(日本Tomy KOQYO公司);培养瓶、培养皿、96孔培养板(美国Corning公司);EIX50自动洗板机(美国Bio-Tek公司);-20℃冰箱(荣事达电器有限公司);-80℃冰箱 (日本Sanyo公司);电子精密天平 (上海精密科学仪器有限公司);水浴恒温箱 (常州国华电器有限公司);快速混匀器 (常州国华电器有限公司);ELX800uv酶标仪(Bio-TEK公司);洁净工作台(苏净集团安泰公司);CK2型倒置显微镜(日本Olympus公司);液氮罐 (成都金凤液氮容器有限公司)。
2 实验方法
2.1 肝细胞培养和传代 培养基是DMEM培养基(含10%胎牛血清、青霉素100 U/mL和链霉素100 U/mL),将肝细胞接种于培养瓶中,置于37℃、5%CO2、相对饱和湿度培养箱中培养。肝细胞为单纯贴壁生长,隔日换液,待细胞长至80%~90%的密度,用胰酶消化传代,每2天传代1次。
2.2 肝细胞计数方法 无水酒精清洁盖玻片和计数板,晾干备用。肝细胞经胰酶消化后再用新鲜DMEM培养基分散成单个细胞悬液。用吸管适度吹打细胞悬液,吸取少量细胞悬液,在计数板盖玻片的一端加微量细胞悬液,加样时需要注意,不要溢出盖玻片和两边的玻璃槽内,显微镜下,用10倍物镜观察计数板四大方格中的细胞数。细胞压中线时,只计左侧和上方者,右侧和下方者不计。
2.3 酒精诱导肝细胞损伤模型的建立 将处于对数生长期的L-02细胞调整密度为4×104个/m L培养于96孔板中,培养24 h更换培养液,分别设立正常对照组,25、50、75、100 mmol/L 4个酒精诱导组,肝细胞悬液与不同浓度的酒精继续培养0.5、1、3、6、12、24 h。用MTT比色法测定细胞活力,台盼蓝染色法计算细胞存活率。结合细胞形态观察,选择诱导肝细胞损伤的酒精最佳浓度。
2.4 丹皮酚对肝细胞损伤的保护作用
2.4.1 丹皮酚肝损伤保护作用量效时效关系 在乙醇诱导肝细胞损伤模型的基础上,将细胞吹打成密度为4×104个/mL培养于96孔板中,贴壁生长24 h。分别加入不同浓度 (250、125、62.5、31.25、15.625μmol/L)的丹皮酚,用MTT比色法测定细胞活力,台盼蓝染色法计算细胞存活率。结合细胞形态观察作为处理脂肪肝细胞的最佳浓度。结果显示125μmol/L浓度作用12 h最佳。
2.4.2 ALT、AST和MDA的测定 将对数增殖期的L-02细胞调整成密度为4×104个/mL的细胞悬液,接种于96孔板,每孔100μL,接种24 h后,镜下观察确认细胞贴壁良好。试验设正常对照组、继续诱导组、丹皮酚治疗组(62.5、125、250μmol/L),每组设6个复孔。各组给予50 mmol/L酒精处理12 h,Pae治疗组加入不同浓度丹皮酚(62.5、125、250μmol/L)的培养液,正常对照组加不含酒精的培养液,继续诱导组继续给予50 mmol/L酒精培养液,继续恒温培养12 h。收集培养上清液,4℃1 000 r/min离心5 min,分别取100μL上清液测ALT、AST、MDA水平,按试剂盒说明书操作。此实验重复3次。
2.5 统计处理方法 采用t检验,P<0.05为差异具有统计学意义,P<0.01为差异具有显著性。
3 实验结果
3.1 酒精诱导急性肝细胞损伤 本研究显示采用浓度分别为25、50、75、100 mol/L的酒精处理肝细胞0.5、1、6、12、24 h。结果显示 (见表1),酒精对肝细胞的损伤作用有剂量依赖性,浓度25 mmol/L的酒精作用于肝细胞影响不明显,光镜下未见肝细胞形态异常,但随着酒精浓度的增大,其存活率则逐步降低,其中,50 mmol/L乙醇处理12 h可使肝细胞损伤明显。显微镜下观察肝细胞明显损伤,部分细胞固缩变圆,体积变小,少量细胞贴壁不牢,呈半贴壁状态;12 h可观察到多数细胞固缩变圆,较多细胞脱落,漂浮于培养液中,亦有少数细胞内出现空泡或体积增大,细胞肿胀、破裂呈坏死状 (见图1);24 h可观察到多数细胞脱落,漂浮于培养液中,部分细胞内出现空泡或体积增大,细胞肿胀、破裂死亡。吸取100μL细胞悬液到EP管内,加入100μL台盼蓝染色液,轻轻吹打混匀,3~5 min后,吸取适量加有台盼蓝染色液的细胞悬液,滴加血细胞计数板计数。于大方格内计数未被蓝染的细胞总数(蓝染细胞为死亡细胞)即为活细胞数,计算细胞存活率。随着作用时间的延长,酒精浓度的增大,肝细胞存活率也随之降低。25 mmol/L组对酒精诱导的肝细胞生长影响不大,因此不选为作用浓度。故选用50 mmol/L乙醇处理12 h作为诱导急性酒精性肝损伤模型的方法。
表1 不同浓度的乙醇对肝细胞存活率的影响 ()
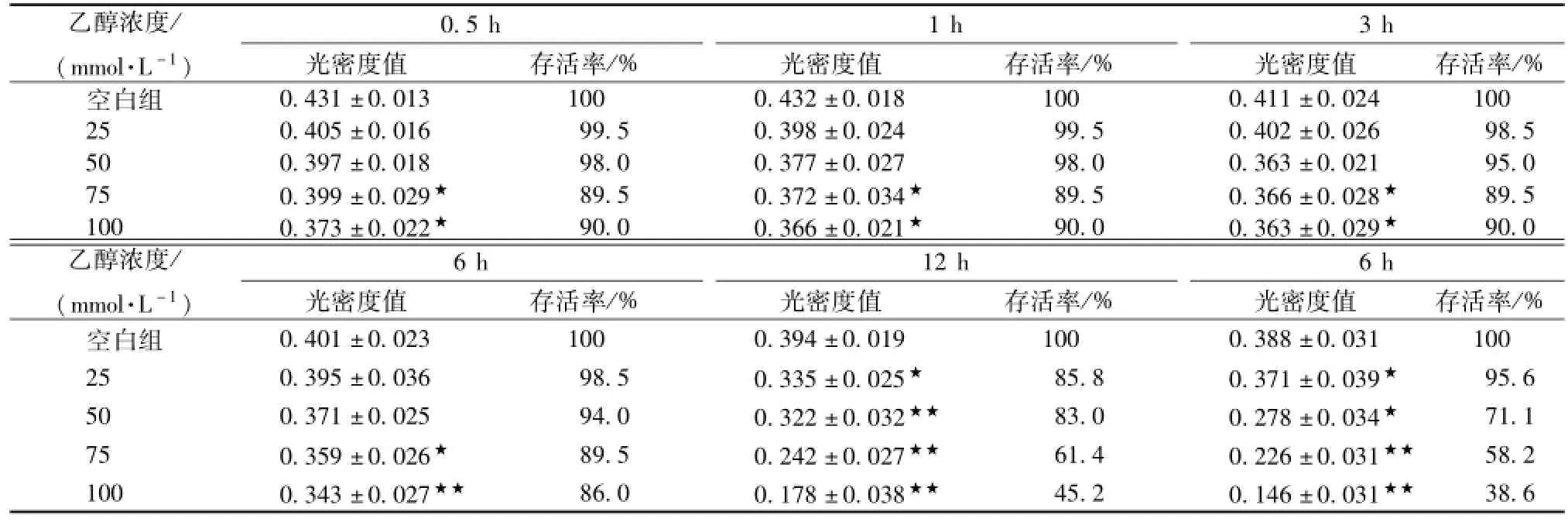
表1 不同浓度的乙醇对肝细胞存活率的影响 ()
注:与空白组比较,★★P<0.01,★P<0.05
乙醇浓度/(mmol·L-1)0.5 h光密度值 存活率/% 1 h光密度值 存活率/% 3 h光密度值 存活率/%空白组0.431±0.013 100 0.432±0.018 100 0.411±0.024 100 25 0.405±0.016 99.5 0.398±0.024 99.5 0.402±0.026 98.5 50 0.397±0.018 98.0 0.377±0.027 98.0 0.363±0.021 95.0 75 0.399±0.029★ 89.5 0.372±0.034★ 89.5 0.366±0.028★ 89.5 100 0.373±0.022★ 90.0 0.366±0.021★ 90.0 0.363±0.029★ 90.0乙醇浓度/(mmol·L-1)6 h光密度值 存活率/% 12 h光密度值 存活率/% 6 h光密度值 存活率/%空白组38.6 0.401±0.023 100 0.394±0.019 100 0.388±0.031 100 25 0.395±0.036 98.5 0.335±0.025★ 85.8 0.371±0.039★ 95.6 50 0.371±0.025 94.0 0.322±0.032★★ 83.0 0.278±0.034★ 71.1 75 0.359±0.026★ 89.5 0.242±0.027★★ 61.4 0.226±0.031★★ 58.2 100 0.343±0.027★★ 86.0 0.178±0.038★★ 45.2 0.146±0.031★★
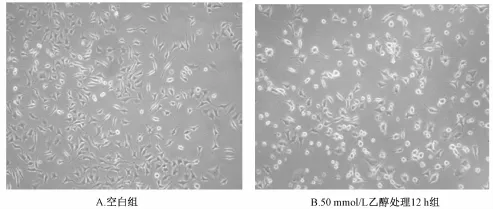
图1 倒置显微镜下观察肝细胞形态学改变 (×100)
3.2 丹皮酚保护肝细胞损伤的量效时效关系 用含不同浓度丹皮酚(250、125、62.5、31.25、15.625μmol/L)的培养液孵育不同时间 (0.5、1、3、6、12、24 h),加入含酒精(50 mmol/L)的培养液继续孵育12 h后,MTT比色法测定丹皮酚对肝细胞损伤的预防作用 (细胞存活率检测方法同前)。结果发现,丹皮酚 (125μmol/L)即可明显抑制酒精对肝细胞的损伤 (P<0.01)。12 h时丹皮酚 (125 μmol/L)抑制作用更明显 (P<0.001),见表2。
表2 MTT法检测丹皮酚对肝细胞损伤的预防作用()

表2 MTT法检测丹皮酚对肝细胞损伤的预防作用()
注:与空白组比较,▲▲P<0.01;与模型组比较,★★★P<0.001,★★P<0.01,★P<0.05
组别 浓度/(μmol·L-1)0.5 h光密度值 存活率/% 1 h光密度值 存活率/% 3 h光密度值 存活率/% - 0.590±0.025 100 0.588±0.027 100 0.585±0.030 100模型组 - 0.402±0.021▲▲ 67 0.391±0.023▲▲ 67.1 0.390±0.026▲▲ 67.0丹皮酚 15.625 0.417±0.029 66 0.397±0.025 68.0 0.392±0.030 67.2 31.25 0.421±0.039 71 0.423±0.031 72.3 0.407±0.028 70.1 62.5 0.435±0.033★ 76 0.440±0.029★ 76.1 0.434±0.036★ 76.1 125 0.503±0.037★★ 84 0.490±0.032★★ 84.3 0.498±0.027★★ 84.3 250 0.431±0.027 69 0.499±0.019 68.5 0.421±0.028 68.5组别 浓度/(μmol·L-1)空白组6 h光密度值 存活率/% 12 h光密度值 存活率/% 24 h光密度值 存活率/% - 0.585±0.035 100 0.573±0.031 100 0.552±0.042 100模型组 - 0.391±0.027▲▲ 66.8 0.401±0.022▲▲ 70 0.385±0.034▲▲ 68.7丹皮酚 15.625 0.387±0.031 66.3 0.414±0.034 72.3 0.403±0.025 73 31.25 0.417±0.041 73.3 0.485±0.030★★ 84.6 0.436±0.029 80.7 62.5 0.445±0.043★ 76.1 0.517±0.041★★ 89.4 0.485±0.030★ 85.2 125 0.493±0.047★★ 84.3 0.557±0.034★★★ 97.2 0.535±0.031★★ 91.9 250 0.401±0.022 68.5 0.461±0.025 79.7 0.465±0.025★空白组80.6
3.3 丹皮酚对酒精致急性损伤的肝细胞释放ALT、AST和MDA影响 收集正常对照组、继续诱导组、Pae治疗组(62.5、125、250μmol/L)培养上清液检测ALT、AST、MDA水平。结果表明,50 mmol/L酒精作用于肝细胞后,明显损伤肝细胞,导致肝细胞坏死,细胞内ALT、AST释放量明显升高,MDA水平升高,加重细胞炎性反应。而丹皮酚可明显抑制ALT、AST释放量的升高,降低MDA水平,提示Pae保护肝细胞与稳定肝细胞膜的结构和抗过氧化等作用有关,见表3。
表3 Pae对急性酒精肝细胞损伤ALT、AST和M DA的影响 (n=6,)
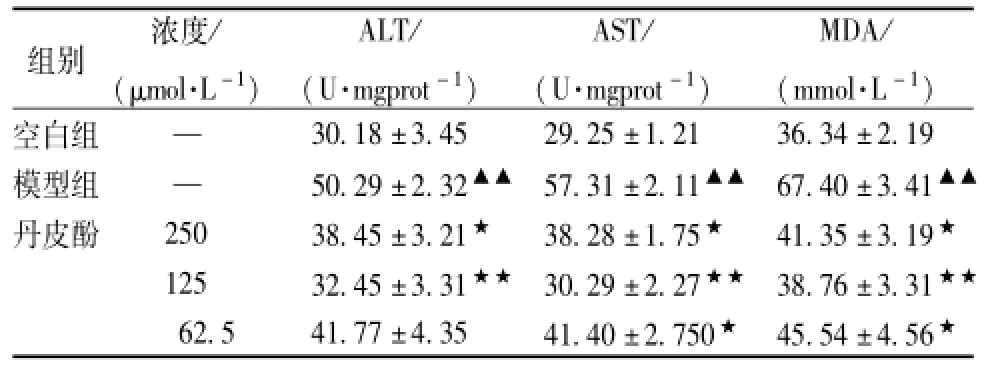
表3 Pae对急性酒精肝细胞损伤ALT、AST和M DA的影响 (n=6,)
注:与空白组比较,▲▲P<0.01;与模型组比较,★★P<0.01,★P<0.05
组别 浓度/(μmol·L-1)ALT/(U·mgprot-1)AST/(U·mgprot-1)MDA/(mmol·L-1)空白组 —30.18±3.45 29.25±1.21 36.34±2.19模型组 — 50.29±2.32▲▲ 57.31±2.11▲▲ 67.40±3.41▲▲丹皮酚 250 38.45±3.21★ 38.28±1.75★ 41.35±3.19★125 32.45±3.31★★ 30.29±2.27★★ 38.76±3.31★★62.5 41.77±4.35 41.40±2.750★ 45.54±4.56★
4 讨论
酒精进入机体后,在肝细胞乙醇脱氢酶、乙醛脱氢酶、细胞色素P450等作用下产生氧自由基,而氧自由基不仅能直接使肝细胞损伤,而且可以通过促进肝细胞对脂质过氧化的敏感性,致使细胞膜和细胞器的破坏,酶系丢失,细胞死亡[12-17]。同时酒精本身和它的氧化物乙醛对肝细胞有直接毒性作用[18-19]。ALT、AST是肝细胞内主要酶系,在肝细胞膜受损时,胞内ALT、AST释放增加,因此培养液中ALT、AST活性检测是判断肝细胞膜损伤最直接的标志[20-22],肝细胞脂质过氧化的最终产物MDA,它的含量则反应膜脂质过氧化程度的强弱及肝细胞的受损程度[23]。肝细胞的存活情况利用MTT比色法检测,直接反应肝细胞的损伤程度。
MTT比色法是一种具有简、便、灵、验用于检测细胞存活和生长的方法,原理是存活的细胞线粒体中琥珀酸脱氢酶能使外源性的MTT在细胞色素作用下还原为不溶于水的蓝紫色(或蓝色)的甲臜 (Formazan),并沉积在细胞中,而死细胞无此功能。因此可以客观、准确地反映活细胞数及其代谢强度[24-25]。利用台盼蓝染色镜下观察肝细胞的存活度:正常的活肝细胞,细胞膜结构完整,完全能够排斥台盼蓝,使之不能够进入胞内;而丧失活性或细胞膜不完整的细胞,胞膜的通透性增加,可被台盼蓝染成蓝色。一般认为细胞膜丧失完整性,就可认为细胞死亡。因此,利用台盼蓝染色可以非常简便、快速地区分活细胞和死细胞。台盼蓝是组织和细胞培养中最常用的死细胞鉴定染色方法之一。通过以上两种方法更能客观地评价细胞的存活情况。
为了充分证实丹皮酚对酒精性肝细胞损伤的抑制作用,本实验选用L-02细胞株,以50 mmol/L乙醇处理12 h制备急性肝细胞损伤模型。通过MTT比色法、台盼蓝染色法和细胞形态学观察中我们发现丹皮酚在62.5~250μmol/L剂量范围内能够抑制肝细胞的损伤,特别是125μmol/L剂量丹皮酚时,且作用12 h时,抑制肝细胞损伤的效应最为明显。
实验结果显示:虽然低浓度酒精对肝细胞损伤不明显,但是随着酒精浓度的加大,肝细胞培养液中MDA、ALT、AST生化检测结果逐渐升高,肝细胞存活率则逐渐下降,表明过量饮酒可引起肝细胞氧化损伤。与继续诱导组相比,丹皮酚组ALT、AST的泄露量明显降低,且MDA量降低两组比较差异有统计学意义 (P<0.05),说明丹皮酚可以减轻酒精对肝细胞膜的损害,从而改善肝细胞功能。与正常对照组相比,继续诱导组各项指标明显升高,提示肝细胞损伤严重。
在细胞水平实验中出现的细胞损伤现象,与动物水平的实验结果基本一致,并且相对动物实验而言,细胞实验的影响因素少,可行性高。故我们可以认为,细胞水平的实验可以作为动物水平实验的补充,两者的有机结合,将为进一步研究酒精性脂肪肝的发病机制以及临床治疗药物的筛选提供有效的途径。
5 小结
丹皮酚体外给药抑制酒精诱导肝细胞的ALT、AST和MDA释放,提示其具有对肝细胞损伤的直接保护作用。
[1]刘锡光,祁自柏,熊诗松.肝病实验诊断指南[M].北京:人民卫生出版社,2004:219.
[2]吴 勤,成 军,李 莉.酒精性脂肪肝的研究[J].世界华人消化杂志,2002,10(9):1037-1038.
[3]陈重华,方治平,于波涛.肝脂康颗粒剂抗脂肪肝作用机理的研究[J].中药药理与临床,2006,22(3):164-165.
[4]陈 奇.中药药理研究方法学[M].北京:人民卫生出版社,2006:479-499.
[5]夏瑾瑜,贾学平,程良斌,等.肝脂康胶囊对非酒精性脂肪肝的防治作用[J].中国中西医结合消化杂志,2004,12(1):15-18.
[6]李亚峰,姚树坤.中药脂肝宁对酒精加高脂饮食大鼠脂肪肝丙二醛、谷胱甘肽的影响[J].河北医科大学学报,2003,24(4):204-206.
[7]应 力,姜春萌,王朝晖,等.甘正复方对大鼠非酒精性脂肪肝的影响[J].中国中西医结合消化杂志,2006,14(2):30-33.
[8]邓利娟,李湛军,乐嘉静,等.海狗油对非酒精性脂肪肝肝细胞色素P450表达及与氧化抗氧化关系的影响[J].中国临床药理学与治疗学,2004,9(7):755-758.
[9]陈建国.脂肪肝的研究近况[J].中医药导报,2005,11(5):83-85.
[10]戴 敏,刘青云,訾晓梅.丹皮酚对高脂血症大鼠动脉内皮细胞的保护作用[J].中国中医基础医学杂志,2001,7(2):38-40.
[11]戴 敏,刘青云,顾承刚,等.丹皮酚对脂质过氧化反应及低密度脂蛋白氧化修饰的抑制作用[J].中国中药杂志,2000,25(10):625-627.
[12]曾昭均.均匀设计及其应用[M].沈阳:辽宁人民出版社,1994:3.
[13]Fraser R,Dobbs B R,Roger GW.Lipoproteins and the liver sieve:the role of the fenestrated sinusoidalend othelium in lipoprotein metabolism,atherosclerosis,and cirrhosis[J].Hepatoloogy,1995,21(3):863-874.
[14]Davis R A,Boogaerts JR,Borchardt R A,et al.Intrahepatic assembly of very low density lipoproteins varied synthetic of individual apolipoproteins to fasting[J].JBiol Chem,1985,260(26):14137-44.
[15]古 赛,蒋小黎,何 琳,等.大鼠慢性酒精性脂肪肝的建立[J].重庆医科大学学报,2006,31(1):81-84.
[16]陈小囡.酒精性肝病的实验研究与治疗[J].杭州师范学院学报,2005,5(3):242-245.
[17]刘洪玲.水飞蓟素的化学成分及药理作用研究进展[J].中国民族民间医药,2008,17(7):23-26.
[18]孙 东,胡仕琦,王宇明.水飞蓟药理作用及其在肝病中的临床应用[J].中国全科医学,2007,10(22):1891-1892.
[19]文 毅,曾连招,张春云,等.易善复、水飞蓟宾治疗非酒精性脂肪肝临床疗效观察[J].临床和实验医学杂志,2007,6(6):94-95.
[20]孙铁民,李 铣.水飞蓟素药理研究进展[J].中草药,2000,31(3):229-232.
[21]刘 燕,吴 超.水飞蓟素治疗慢性乙型肝炎疗效观察[J].江苏医药杂志,2000,26(6):445-446.
[22]范建高.脂肪肝[M].上海:上海科技出版社,2000:201.
[23]吕瑞娟,任登先,闫 明.脂肪肝的发病机理和治疗研究进展[J].甘肃科学学报,2001,13(2):57-59.
[24]林 青,张 超,李立纪,等.去脂软肝丸对实验性脂肪肝肝脂的影响[J].中国中医药信息杂志,2002,9(5):33-34.
[25]王钊红,白秀云,纪土超.苦参碱对CCL4高脂低蛋白诱导大鼠脂肪肝变性影响的实验研究[J].中国中医药科技,2006,13(2):108.
R966
B
1001-1528(2015)04-0854-05
10.3969/j.issn.1001-1528.2015.04.036
2014-11-08
安徽省优秀青年基金项目 (8040106905)
颜贵明 (1974—),男,硕士,副教授,主要从事丹皮酚抗脂肪肝作用及机制研究。Tel:(0551)68129301,E-mail:922-119@163.com
*通信作者:戴 敏 Tel:(0551)68129122,E-mail:daiminliao@163.com
