3种比色法测定五味子中多糖
2015-01-17王法琴陆兔林毛春芹
王法琴, 陆兔林, 毛春芹, 张 宁
(1.南京中医药大学药学院,江苏 南京210023;2.江苏省中药炮制重点实验室,江苏 南京 210023;3.南京中医药大学翰林学院,江苏泰州225300)
3种比色法测定五味子中多糖
王法琴1, 陆兔林2*, 毛春芹2, 张 宁3
(1.南京中医药大学药学院,江苏 南京210023;2.江苏省中药炮制重点实验室,江苏 南京 210023;3.南京中医药大学翰林学院,江苏泰州225300)
目的建立定量测定五味子中多糖的比色方法。方法采用硫酸苯酚法、硫酸蒽酮法、3,5-二硝基水杨酸法(DNS)三种显色方式,在相应的最大吸收波长处测其吸收值并对检测结果进行比较。结果硫酸苯酚法、硫酸蒽酮法、3,5-二硝基水杨酸法 (DNS)测定五味子多糖质量分数结果分别为91.3、83.5、97.6mg/g。结论硫酸苯酚法操作简单易行,测定五味子多糖质量分数结果准确可靠。
五味子;比色方法;多糖;苯酚硫酸法;蒽酮硫酸法;3,5-二硝基水杨酸法
五味子,习称北五味子,为木兰科植物五味子Schisandra chinensis(Turcz.)Baill.的果实,具有收敛固涩、益气生津、补肾宁心之功效[1]。研究发现,北五味子含木脂素、有机酸、挥发油、多糖等成分。其中,五味子多糖具有保肝、抗疲劳、免疫促进、抗氧化及抗衰老和抗肿瘤等药理作用,具有较好的临床疗效[2-4]。由于多糖质量是保证五味子临床疗效的重要前提,因此就对五味子中多糖的质量评价,尤其是其质量分数测定的准确性有了更高的要求[5]。
目前检测五味子中多糖的方法主要有高效液相色谱法和比色法,前者因高纯度的五味子多糖对照品难以获得等因素的制约而较少使用,而后者作为测量多糖的经典方法,操作简单易行,结果准确可靠,在五味子多糖的研究中得到了广泛的应用[6-8]。目前测量五味子多糖的比色法主要有硫酸苯酚法、硫酸蒽酮法、3,5-二硝基水杨酸法(DNS)等[9],均是以葡萄糖为对照品,计算出样品中多糖的质量分数。其中硫酸苯酚法和硫酸蒽酮法是通过硫酸水解多糖,脱水生成糠醛或其衍生物,与相应的显色剂显色后在特定波长处有最大吸收[10],而DNS法是通过DNS试剂与还原糖共热产生棕红色化合物,并在特定波长处有最大吸收,然后测定总糖供试液和单糖供试液中的单糖质量分数,计算时再将单糖供试液的单糖质量分数从总糖供试液的单糖质量分数中减去,最终算出多糖质量分数[11]。本研究旨在通过对硫酸苯酚法、硫酸蒽酮法、DNS法的对比,选定一种适合测定五味子多糖质量分数的比色方法。
1 材料与仪器
TU-1901紫外分光光度计 (北京普析通用仪器有限责任公司);FA1104N电子分析天平 (上海精科天平仪器厂);HH-S恒温水浴锅 (巩义市英峪予华仪器有限责任公司);DHG-9023A电热恒温鼓风干燥箱 (上海精宏试验设备有限公司)。
乙醇、葡萄糖、苯酚、蒽酮,亚硫酸氢钠,氢氧化钠,酒石酸钾钠,浓硫酸等均为分析纯;3,5-二硝基水杨酸为化学纯 (国药集团化学试剂有限公司)。
五味子购于无锡李同丰天然药物有限公司,经南京中医药大学陆兔林教授鉴定为木兰科植物五味子(Schisandra chinensis(Turcz.)Baill.)的果实。
3,5-二硝基水杨酸试液根据唐冰等[12]报道的方法配制,将制成的试液储存于棕色瓶中,7 d后使用。
2 方法与结果
2.1 最大吸收波长的选择 紫外分光光谱显示,五味子多糖与葡萄糖分别用硫酸苯酚法、硫酸蒽酮法、DNS法显色后,最大吸收峰位一致,即硫酸苯酚法的最大吸收峰位在490 nm处,硫酸蒽酮法的最大吸收峰位在624 nm处,DNS法的最大吸收峰位在502 nm处。见图1~3。

图1 硫酸苯酚法Fig.1 Phenol-sulfuric acid method
2.2 五味子多糖的质量分数测定
2.2.1 对照品溶液的制备 精密称量葡萄糖对照品25 mg,置于250 mL量瓶中,加蒸馏水稀释至刻度,作为对照品溶液。
2.2.2 标准曲线的制备
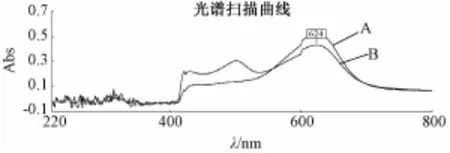
图2 硫酸蒽酮法Fig.2 anthrone sulfuric acid method
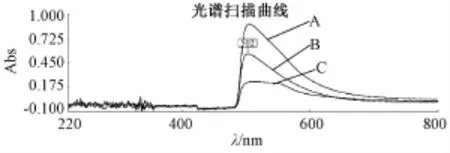
图3 DNS法Fig.3 3,5-dinitrosalicylic acid method
2.2.2.1 硫酸苯酚法 精密吸取质量浓度为0.1 mg/mL标准葡萄糖溶液0.2、0.4、0.6、0.8、1.0 mL分别置于干燥的具塞试管中,分别加水补至2 mL,精密加入5%苯酚1 mL,摇匀,迅速精密加入浓硫酸5 mL,摇匀,放置10 min,置40℃水浴中保温15 min,取出后迅速冷却至室温,以相应的试剂为空白,照紫外分光光度法,在490 nm的波长处测定吸光度,以吸光度为纵坐标,葡萄糖质量浓度为横坐标,绘制标准曲线。线性方程为:y= 54.902x+0.008 8,r=0.998 30。在0.002 54~0.012 7 mg/mL之间,葡萄糖的质量浓度与吸光度呈良好的线性关系。
2.2.2.2 硫酸蒽酮法 精密吸取0.1 mg/m L标准葡萄糖溶液0.2、0.4、0.6、0.8、1.0、1.2 mL分别置于干燥的具塞试管中,分别加水补至2 m L,精密加入硫酸蒽酮试液 (取蒽酮0.1 g,加80%硫酸100 m L溶解)6 mL,置沸水浴中反应15 min,取出后迅速冷却至室温,以相应的试剂为空白,照紫外分光光度法,在624 nm的波长处测定吸光度,以吸光度为纵坐标,葡萄糖质量浓度为横坐标,绘制标准曲线。线性方程为:y=37.508x+0.006 8,r=0.998 85。在0.002 54~0.015 24 mg/mL之间,葡萄糖的质量浓度与吸光度呈良好的线性关系。
2.2.2.3 DNS法 精密吸取0.1 mg/mL标准葡萄糖溶液1.0、2.0、3.0、4.0、5.0、6.0 mL分别置于干燥的具塞试管中,分别精密加入DNS试液2 mL混匀,置于沸水浴中加热5 min,取出,立即冷却至室温,加水补足至8 mL摇匀,以相应的试剂为空白,照紫外分光光度法,在502 nm的波长处测定吸光度,以吸光度为纵坐标,葡萄糖质量浓度为横坐标,绘制标准曲线。线性方程为:y= 10.159x+0.046 4,r=0.996 24。在0.012 7~0.076 2 mg/mL之间,葡萄糖的质量浓度与吸光度呈良好的线性关系。
2.2.3 供试品溶液的制备及比色条件
2.2.3.1 硫酸苯酚法 取干燥五味子粉末5 g,用80%乙醇60 m L回流提取2 h,趁热过滤,药渣加60 mL纯化水回流提取2 h,趁热过滤,合并滤过液,定容至100 mL[13-15]。精密吸取1.0 mL,置于50 m L量瓶内,加蒸馏水稀释至刻度,摇匀。精密量取上述溶液1 mL置于干燥的具塞试管中,加水1.0 mL,照标准曲线的制备项下的方法,自 “各精密加入5%苯酚溶液1 mL”起,依法测定吸光度,从标准曲线上读出供试品溶液中含葡萄糖的质量浓度(mg/m L),计算,即得。
2.2.3.2 硫酸蒽酮法 取干燥五味子粉末5 g,用80%乙醇60 mL回流提取2 h,趁热过滤,药渣加60 m L纯化水回流提取2 h,趁热过滤,合并滤过液,定容至100 mL[13-15]。精密吸取五味子多糖溶液1.0 mL,置于50 mL量瓶内,加蒸馏水稀释至刻度,摇匀。精密量取上述溶液1 mL置于干燥的具塞试管中,加水1.0 mL,照标准曲线的制备项下的方法,自 “精密加入硫酸蒽酮试液 (取蒽酮0.1 g,加80%硫酸100 mL溶解)6 mL”起,依法测定吸光度,从标准曲线上读出供试品溶液中含葡萄糖的质量浓度 (mg/mL),计算,即得。
2.2.3.3 DNS法 (1)总糖溶液[11]:取干燥五味子粉末5 g,用80%乙醇60mL回流提取2 h,趁热过滤,药渣加60 mL纯化水回流提取2 h,趁热过滤,合并滤过液,定容至100 mL[13-15]。精密量取1.0 mL置于50 mL磨口三角烧瓶中,加3 mol/L盐酸溶液20 mL,混匀,密塞,置于沸水浴中加热30min,用流水冷却后加酚酞指示液1滴,用20%氢氧化钠溶液调节至微红色,全部转移至50 mL量瓶中加蒸馏水稀释至刻度,摇匀。精密量取上述溶液3 mL置于干燥的具塞试管中,照标准曲线的制备项下的方法,自“分别精密加入DNS试液2 mL混匀”起,依法测定吸光度,从标准曲线上读出供试品溶液中含葡萄糖的质量浓度 (mg/mL),计算,即得。
(2)单糖溶液的制备[11]:取干燥五味子粉末5 g,用80%乙醇60 mL回流提取2 h,趁热过滤,药渣加60 m L纯化水回流提取2 h,趁热过滤,合并滤过液,定容至 100 mL[13-15]。精密量取 2.0 mL,置于25 mL量瓶内,加蒸馏水稀释至刻度,摇匀。精密量取上述溶液5 mL置于干燥的具塞试管中,照标准曲线的制备项下的方法,自 “分别精密加入DNS试液2 mL混匀”起,依法测定吸光度,从标准曲线上读出供试品溶液中含葡萄糖的质量浓度(mg/m L),计算,即得。
2.2.4 精密度试验 取葡萄糖对照品溶液以及相应的供试品溶液,分别按照硫酸苯酚法,硫酸蒽酮法,DNS法测其吸光度,连续测定6次。各方法对照品、供试品精密度RSD结果,硫酸苯酚法为0.2%、0.3%;硫酸蒽酮法为0.1%、0.3%;DNS法为0.2%、0.1%(总糖)、0.5%(单糖)。结果表明仪器精密度良好。
2.2.5 稳定性试验 取葡萄糖对照品溶液以及相应的供试品溶液,分别按照硫酸苯酚法,硫酸蒽酮法,DNS法测其吸光度,每间隔10 min测定一次,共测6次。硫酸苯酚法对照品、供试品稳定性RSD为0.8%、0.6%;硫酸蒽酮法为0.8%、0.8%;DNS法为1.7%、0.4% (总糖)、2.7% (单糖)。结果表明:硫酸苯酚法,硫酸蒽酮法,DNS法的对照品和供试品溶液在1 h内稳定。
2.2.6 重复性试验 各精密称取5份干燥五味子粉末5 g,按 “2.2.3”项下硫酸苯酚法、硫酸蒽酮法、DNS法的供试品溶液制备方法制备供试品液,显色后测其吸光度,并计算其质量分数。结果5份样品用硫酸苯酚法、硫酸蒽酮法、DNS法测得多糖的平均质量分数分别为:91.3 mg/g、83.5 mg/g、97.6 mg/g(总糖-单糖)。RSD分别为1.6%、2.1%、1.2%。结果表明,硫酸苯酚法,硫酸蒽酮法,DNS法的重复性良好。
2.2.7 准确度试验 各精密称取9份干燥五味子粉末2.5 g,置于圆底烧瓶中,分别加入低、中、高3个质量浓度的葡萄糖对照品溶液 (硫酸苯酚法、硫酸蒽酮法、DNS法使用的对照品质量浓度分别为230.19、210.56、250.34、15.62 mg/mL)0.8、1.0、1.2 mL,按 “2.2.3”项下硫酸苯酚法、硫酸蒽酮法、DNS法的供试品溶液制备方法制备供试品液,并测其吸光度,外标两点法 (各方法线性回归方程分别为:y=62.02x-0.080;y=40.65 x-0.029;y=11.57x+0.007)计算各方法准确度结果。硫酸苯酚法:平均回收率为99.8% (n=9);RSD为1.1%。硫酸蒽酮法:平均回收率为99.2%(n=9);RSD为1.6%。DNS法:总糖平均回收率为99.1% (n=9),RSD为1.5%;单糖平均回收率为99.6% (n=9);RSD为1.8%。见表1~表4。

表1 硫酸苯酚法准确度考察结果Tab.1 Accu racy results for phenol sulfu ric acid method
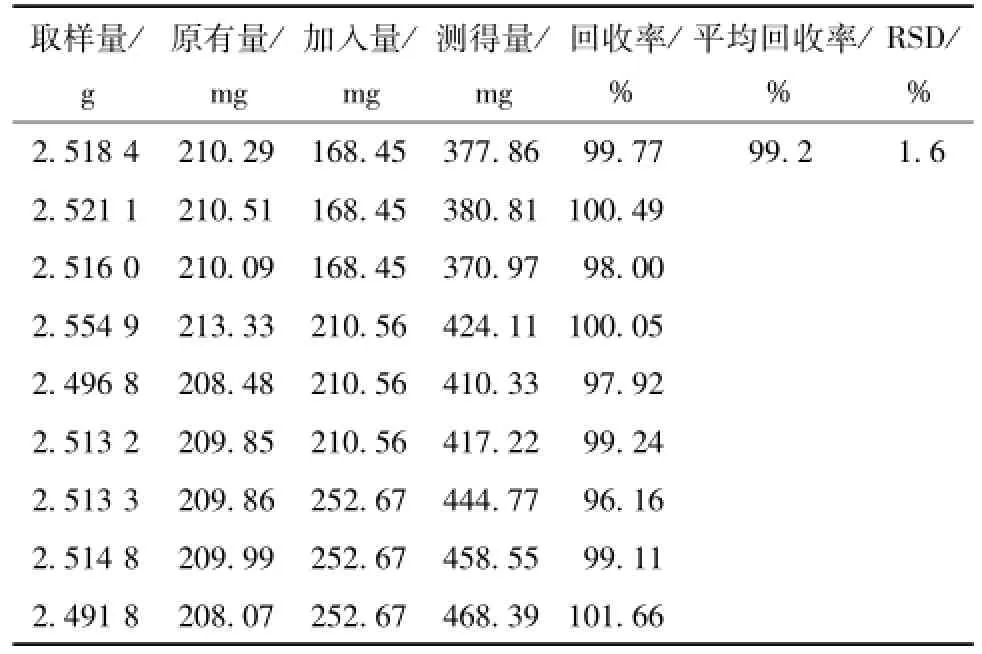
表2 硫酸蒽酮法准确度考察结果Tab.2 Accuracy results for anthrone sulfuric acid method
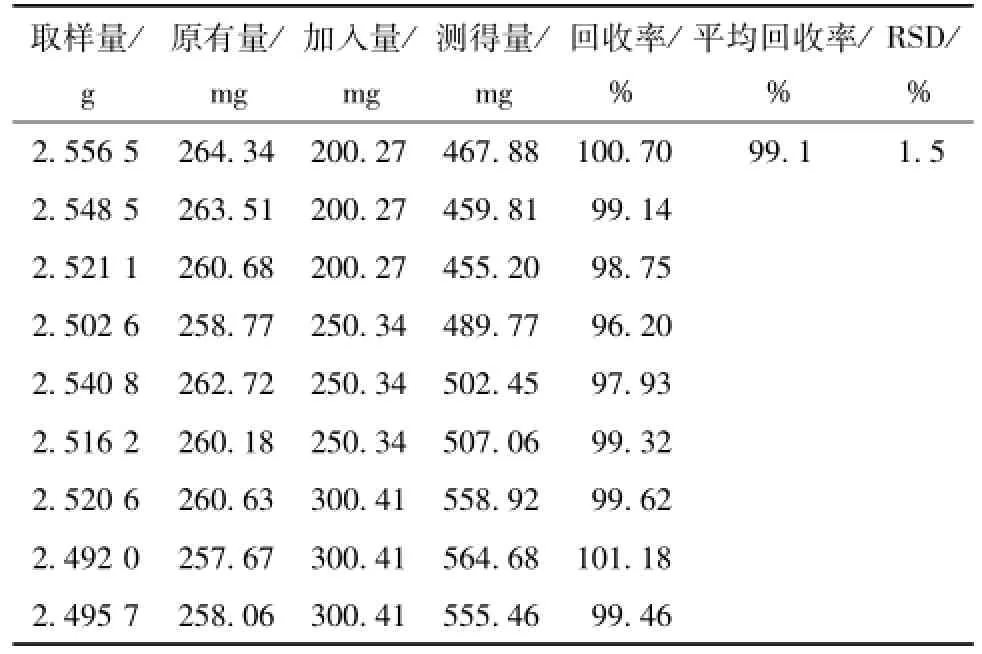
表3 DNS法总糖准确度考察结果Tab.3 Accuracy results of total amoonosaccharide for DNS

表4 DNS法单糖准确度考察结果Tab.4 Accuracy results of amoonosaccharide for DNS
2.2.8 样品中五味子多糖测定 分别取3批北五味子样品,各精密称取5份干燥五味子粉末5 g,按 “2.2.3”项下硫酸苯酚法、硫酸蒽酮法、DNS法的供试品溶液制备方法制备供试品液,显色后测其吸光度,外标两点法计算其质量分数。结果见表5。
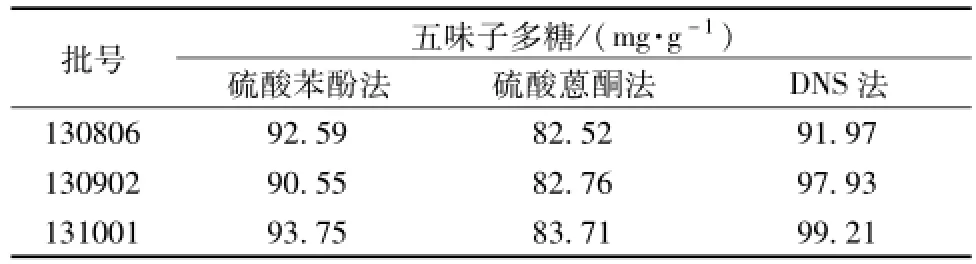
表5 五味子中多糖样品测定结果Tab.5 Content results of polysaccharide from three batches of Fructus Schisandrae
3 讨论
对在相同质量浓度下,葡萄糖标准溶液对应的吸光度值进行比较后发现,硫酸苯酚法大于硫酸蒽酮法及DNS法,因此可认为此法测定结果更为灵敏。
硫酸苯酚法和硫酸蒽酮法显色原理大致相同,均是多糖在强酸性条件下水解成单糖,单糖再进一步脱水形成糖醛衍生物而显色。然而本实验结果显示,两种方法测定五味子中多糖的结果相差近10%,原因可能是组成该成分的不同单糖与硫酸苯酚或硫酸蒽酮试剂在反应条件方面有不同,从而导致实验结果的差异。有关五味子单糖的组成及两种显色方法的最佳反应条件尚有待进一步研究。
用DNS法测定单糖供试品溶液中单糖质量分数时,发现其吸收值极小,几乎可以忽略不计。这一结果表明五味子多糖提取液中单糖质量分数较低,原因可能是本工艺在水提取五味子多糖前用80%乙醇回流,去除木脂素,单糖等杂质,消除了它们对多糖质量分数测定的影响,因此用DNS法的优势不明显。
从各方面的数据分析比较后发现,采用苯酚法测定结果比较稳定,操作简单易行,因而可认为此法是测定五味子中多糖较为理想的方法。但因苯酚容易氧化,见光或遇氧即逐渐氧化成淡红色物质,因此在测定中应该避光,且操作要迅速。
[1]国家药典委员会.中华人民共和国药典:2010年版一部[S].北京:中国医药科技出版社,2010:61-62.
[2]李晓光,高 勤,翁 文,等.五味子多糖的研究概况[J].时珍国医国药,2006,27(6):931-932.
[3]苗明三,方晓艳.五味子多糖对正常小鼠免疫功能的影响[J].中国中医药科技,2003,10(2):87,100.
[4]王 森,谢碧霞.五味子的利用现状与开发前景[J].湖南林业科技,2004,31(5):57-58.
[5]李容芷.从灵芝扶正固本有效成分灵芝多糖的发现讨论中药活性研究的方法途径[J].北京医科大学学报,1987,119(6):431-434.
[6]谭晓虹,王治宝,李如章.北五味子多糖质量分数的测定[J].河北北方学院学报:医学版,2005,22(6):45-46.
[7]季宇彬,郭守东,汲晨锋.野西瓜成熟果实中多糖的质量分数测定及毛细管电泳分析[J].中国药学杂志,2006,41(15):1186-1189.
[8]孟宪军,秦 琴,高晓旭.五味子多糖的分离纯化及清除自由基研究[J].食品科学,2008,29(1):91-94.
[9]王守现,刘 宇,赵 爽,等.白灵菇菌丝体多糖两种测定方法的比较[J].食品研究与开发,2011,32(9):162-164
[10]黄东萍,文东旭,林文翰.天芎注射液中多糖的含量测定[J].华西药学杂志,2005,20(2):167-168.
[11]夏春森,韦史利,钟艳红.3,5-二硝基水杨酸比色法测定黄芪多糖的质量分数[J].中国民族民间医药,2009,18(8):13-14
[12]唐 冰,夏秋瑜,李从发,等.NAG质量分数测定中常见的3种DNS试剂使用效果比较研究[J].热带农业科学,2006,26(2):33-35.
[13]李巧云,居红芳,翟 春.五味子粗多糖提取工艺的研究[J].食品科学,2004,25(5):105-109.
[14]刘晔玮,宋 海,马振远,等.甘草多糖提取工艺的研究[J].中成药,2006,28(5):729-731.
[15]官艳丽,曹 沛,郁开北,等.五味子化学成分的研究[J].中草药,2006,37(2):185-187.
Determ ination of polysaccharides from Schisandrae chinensis Fructus by three colorim etric m ethod
WANG Fa-qin1, LU Tu-lin2*, MAO Chun-qin2, ZHANG Ning3
(1.College of Pharmacy,Nanjing University of Traditional ChineseMedicine,Nanjing 210023,China;2.Key Research Laboratory of ChineseMedicine Processing of Jiangsu Province,Nanjing 210023,China;3.College of Hanlin,Nanjing University of Traditional Chinese Medicine,Taizhou 225300,China)
Schisandrae chinensis Fructus;colorimetric method;polysaccharide;phenol-sulfuric acid method;anthrone sulfuric acid method;3,5-dinitrosalicylic acid method
R284.1
A
1001-1528(2015)04-0814-05
10.3969/j.issn.1001-1528.2015.04.026
2014-06-11
中药饮片质量标准研究 (2012ZX09304005003);江苏省中医药管理局“基于一测多评及其对照提取物的五味子质量标准评价模式构建”(LZ13022);江苏省2013年度普通高校研究生科研创新计划项目,南京中医药大学 “基于微透析技术的五味子醋制入肝效应机制研究”(CXLX13_597)
王法琴(1982—),女,硕士生,研究方向为中药质量标准及新药。Tel:18913857699,E-mail:wangfaqin429@163.com
*通信作者:陆兔林 (1963—),男,教授,研究方向为中药炮制及中药饮片质量。Tel:(025)85811835
