龙胆和坚龙胆对照提取物的制备
2015-01-17程雪梅王长虹王峥涛
玄 敏, 程雪梅,2, 王长虹,2*, 王峥涛,2
(1.上海中医药大学中药研究所,中药标准化教育部重点实验室,上海201203;2.上海中药标准化研究中心,上海201203)
龙胆和坚龙胆对照提取物的制备
玄 敏1, 程雪梅1,2, 王长虹1,2*, 王峥涛1,2
(1.上海中医药大学中药研究所,中药标准化教育部重点实验室,上海201203;2.上海中药标准化研究中心,上海201203)
目的研究龙胆与坚龙胆对照提取物的制备工艺及质量控制方法。方法以龙胆提取物HPLC指纹图谱中龙胆苦苷和另外4个特征峰峰面积为评价指标,采用L9(34)正交试验优化其制备工艺,并建立龙胆和坚龙胆对照提取物指纹图谱。结果最佳制备工艺为药材最粗粉加10倍量水,回流提取3次,每次1 h,获得粗提物;粗提物浓缩至含原药材6.60 g/100 mL,加3倍量乙酸乙酯,萃取2次,萃取液蒸干,真空干燥。龙胆、坚龙胆对照提取物中龙胆苦苷平均质量分数分别为31.37%、25.20%。龙胆对照提取物指纹图谱标定龙胆苦苷和另外4个特征峰,整体相似度大于0.99;坚龙胆对照提取物指纹图谱标定龙胆苦苷和另外4个特征峰,整体相似度大于0.98。结论对照提取物制备工艺稳定,重复性好,可用于龙胆药材、饮片的质量控制。
龙胆;对照提取物;龙胆苦苷;HPLC指纹图谱
龙胆为多基源药材,2010年版 《中国药典》收载的龙胆为龙胆科Gentianaceae龙胆属Gentiana植物龙胆Gentiana scabra Bge.、条叶龙胆Gentiana manshurica Kitag.、三花龙胆Gentiana triflora Pall或坚龙胆Gentiana rigescens Franch的干燥根和根茎,前三种习称 “龙胆”,后一种习称 “坚龙胆”[1]。龙胆主要产地为内蒙古、东北,坚龙胆道地产地为云南。龙胆始载于 《神农本草经》,列为中品[2]。其味苦,性寒,为清肝胆湿热,泻下焦郁火之常用中药。现代药理研究表明,龙胆具有保肝、利胆、健胃、抗炎、抗菌及对中枢系统的作用[3]。龙胆主要化学成分有环烯醚萜类 (iridoids)、三萜类(triterpenes)、黄酮类(flavonoids)、口山酮类(xthantones)等[4-6]。龙胆的质量控制主要集中在以龙胆苦苷(gentiopicroside)、当药苷(sweroside)、当药苦苷(swertiamarin)等环烯醚萜类成分为指标的研究[7-10]。龙胆药材现行质量标准中,以龙胆苦苷为指标进行TLC定性鉴别和HPLC定量测定。
对照提取物是中药标准物质的一种,其易于获得,成本低廉,使用快捷简便,可用于中药材、饮片的多指标质量控制,具有广泛应用前景。2010年版 《中国药典》共收载16种对照提取物,其在中药标准物质中所占比例很小,对中药对照提取物进行研究具有现实意义[11]。龙胆中大极性成分含有量较高,中、小极性成分含有量较低[12-14]。前期研究发现龙胆中的中、小极性成分具有一定的鉴别意义,可用于龙胆和坚龙胆药材的定性质量控制。本实验以龙胆与坚龙胆为研究对象,制备对照提取物,拟作为标准物质快速、简便地用于龙胆药材、饮片的质量控制。
1 仪器与试药
Agilent1260高效液相色谱仪(G1315C型四元梯度泵、G1311B型在线脱气机、G1367E型自动进样器、G1316A型DAD柱恒温箱、G1330B型DAD检测器),Agilent Chemstation色谱工作站;BT-124S电子分析天平(Sartorius公司);GRT-RK型电热套 (郑州长城科工贸有限公司);DZF-6050型真空干燥箱 (上海精宏实验设备有限公司);KQ-250DB数控超声波清洗器 (昆山市超声仪器有限公司)。
龙胆苦苷由上海中药标准化研究中心提供(纯度>98%);龙胆药材购自安国药材市场,坚龙胆药材由兰州佛慈制药股份有限公司馈送,经上海中药标准化研究中心吴立宏研究员鉴定分别为龙胆G.scabra与坚龙胆G.rigescens的干燥根和根茎,凭证标本存放于上海中药标准化研究中心标本室。甲醇、乙腈为色谱纯,水为超纯水,其余试剂为分析纯。
2 方法与结果
2.1 对照提取物制备工艺 本实验前期基于极性导向,在保留大极性成分的基础上,富集龙胆和坚龙胆药材中的中、小极性成分,可用于表征龙胆药材的特征 (另文报道),见图1。
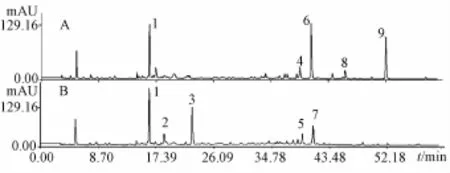
图1 龙胆和坚龙胆药材的特征指纹图谱Fig.1 Characteristic fingerprints of G.scabra and G. rigescens
本研究在龙胆提物制备工艺 (药材最粗粉加10倍量水,回流提取3次,每次回流时间为1 h)[15]的基础上,考察乙酸乙酯萃取法制备提取物的工艺条件。选择粗提物质量浓度 (A)、萃取溶剂/粗提物倍量 (体积) (B)、萃取次数 (C)为考察因素,每个因素设立3个水平,通过L9(34)正交表安排试验,以提取物指纹图谱中的1、4、6、8、9号特征峰 (图1A)峰面积为考察指标(权重系数分别为0.02,0.3,0.08,0.3,0.3),综合评价和筛选龙胆对照提取物萃取工艺,试验因素及水平见表1。
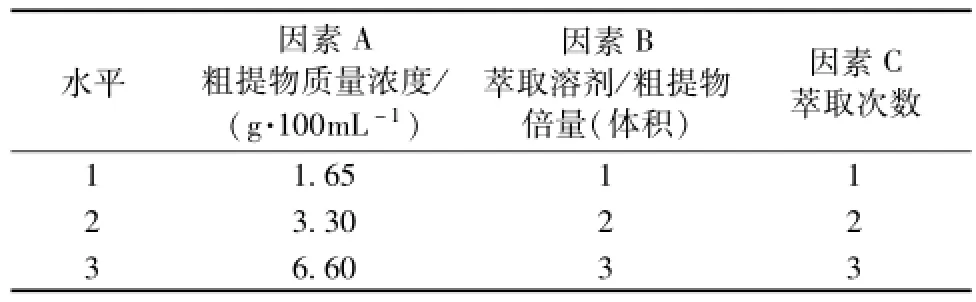
表1 试验因素及水平Tab.1 Factors and levels
取龙胆药材12 g,精密称定,加10倍量水,回流提取3次,1 h/次,离心,合并药液,定容;加乙酸乙酯萃取,乙酸乙酯层蒸干,70%甲醇超声溶解,滤过,得供试品。记录目标特征峰峰面积,计算综合评分,结果见表2。
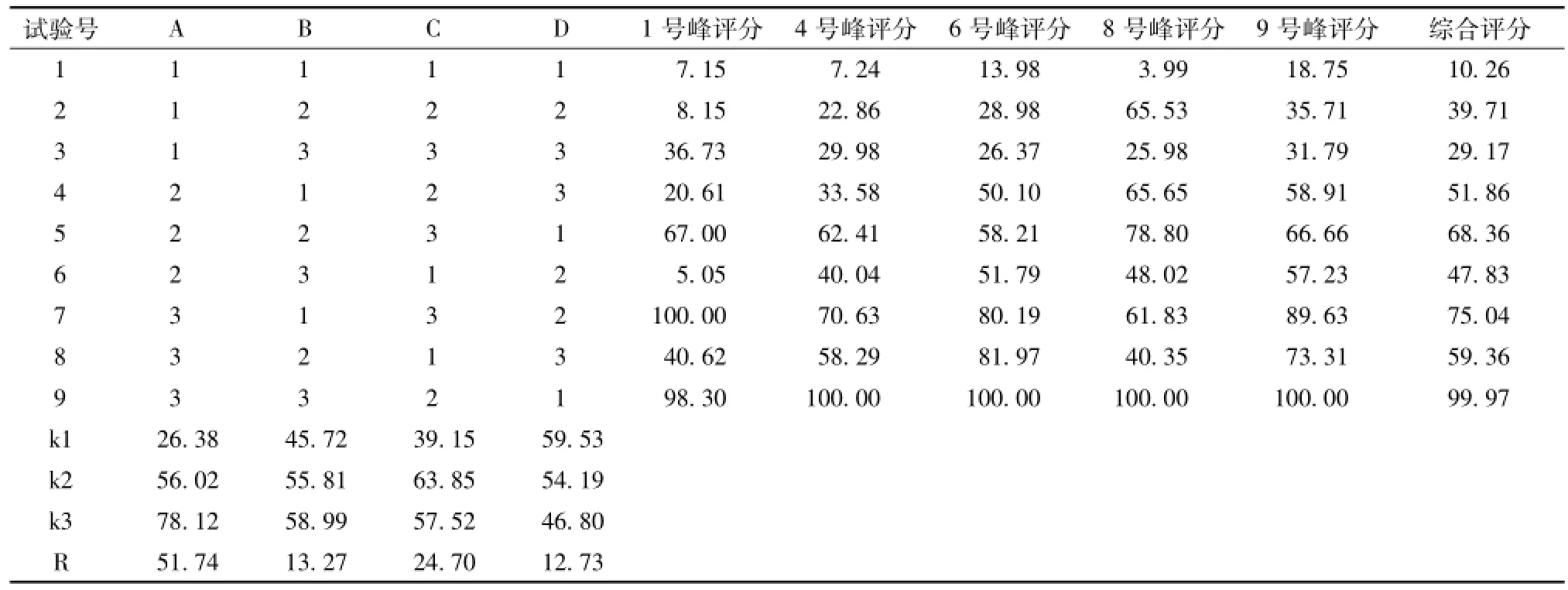
表2 正交试验安排及评分结果 (n=3)Tab.2 Orthogonal experiment arrangements and scores(n=3)
直观分析评分结果知,影响因素从大到小依次为A>C>B。以空白项D作为误差项,进行方差分析,结果见表3。

表3 方差分析Tab.3 Table of variance analysis
方差分析结果显示,因素A(粗提物质量浓度)为萃取效果最主要影响因素 (P<0.05)。结合直观分析和实际生产,确定最佳工艺为A3B3C2,即粗提物质量浓度6.60 g/100 mL,加3倍量 (体积)乙酸乙酯萃取2次。
2.2 工艺验证 根据最佳工艺条件制备3份龙胆对照提取物样品,计算评分,结果见表4。验证试验得分均较高,重复性好。

表4 验证试验结果Tab.4 Resu lts of verification experiments
根据筛选工艺制备坚龙胆对照提取物样品,发现坚龙胆对照提取物图谱特征性强,各特征峰峰高比例协调,所筛选工艺适用于坚龙胆对照提取物的制备。
2.3 对照提取物制备 根据最佳工艺条件分别制备6批龙胆对照提取物和6批坚龙胆对照提取物(表5),龙胆对照提取物平均得率为1.19%,坚龙胆对照提取物平均得率为1.99%。
2.4 对照提取物质量标准研究
2.4.1 龙胆苦苷测定
2.4.1.1 色谱条件 Diamonsil C18(2)Column色谱柱(4.6 mm×250 mm,5μm);流动相为甲醇-水(25:75);体积流量1.0 m l/min;检测波长270 nm;柱温30℃;进样量10μL。色谱图见图2。

表5 龙胆和坚龙胆对照提取物得率、相似度和龙胆苦苷含有量Tab.5 Yield,sim ilarity,and gentiopicroside content of reference extracts from G.scabra and G.rigescens
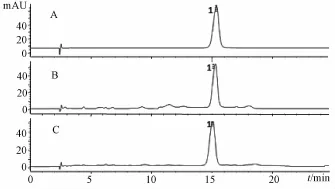
图2 龙胆苦苷测定色谱图Fig.2 Chromatograms for gentiopicroside
2.4.1.2 对照品溶液的制备 取龙胆苦苷对照品适量,精密称定,加甲醇制成每1 mL含1.925 0 mg的贮备液。
2.4.1.3 供试品溶液的制备 取对照提取物约13 mg,精密称定,置25 mL量瓶中,加甲醇振摇溶解并定容至刻度,摇匀,0.45μm微孔滤膜过滤,得供试品溶液。
2.4.1.4 线性关系考察及标准曲线制备 分别精密吸取对照品贮备液,加甲醇稀释成0.385~385 μg/mL的一系列对照品溶液,按“2.4.1”项谱条件测定。以峰面积 (Y)对质量浓度 (X)进行线性回归,得线性回归方程Y=12.137X+4.08(r= 1.000),龙胆苦苷在0.385~385μg/mL时,峰面积与质量浓度线性关系良好。
2.4.1.5 定量限、检测限 配制龙胆苦苷对照品由高到低浓度系列溶液,按信噪比 (S:N)为3:1,计算龙胆苦苷的检测限为0.190μg/m L,按信噪比 (S:N)为10:1,计算龙胆苦苷的定量限为0.385μg/mL。
2.4.1.6 精密度试验 取高、中、低 (385、192.5、77μg/mL)3种质量浓度的对照品溶液,同1 d内连续进样6次,峰面积RSD分别为0.34%、0.82%、0.35%,日内精密度良好;分别连续3 d进样测试,峰面积RSD分别为1.81%、1.56%、1.29%,日间精密度度良好。
2.4.1.7 稳定性试验 取同一供试品溶液 (S1),分别于0、1、2、4、8、12、24、48 h进样,峰面积RSD为0.95%,样品48 h内稳定性良好。
2.4.1.8 重复性试验 取同一批次样品 (S1),按 “2.4.1.3”项下方法平行制备6份供试品溶液,分别进样,龙胆苦苷RSD为1.37%,方法重复性良好。
2.4.1.9 加样回收率试验 采用半程加样。取9份经过准确定量测定的样品13 mg,精密称定,置25 m L量瓶中,加甲醇振摇溶解并定容至刻度,摇匀;取5mL,定容至10mL;分别按已知含有量的50%、100%、150%3个水平加入龙胆苦苷对照品。进样检测,计算加样回收率,结果见表6。龙胆苦苷平均回收率为102.4%,RSD为2.7%。
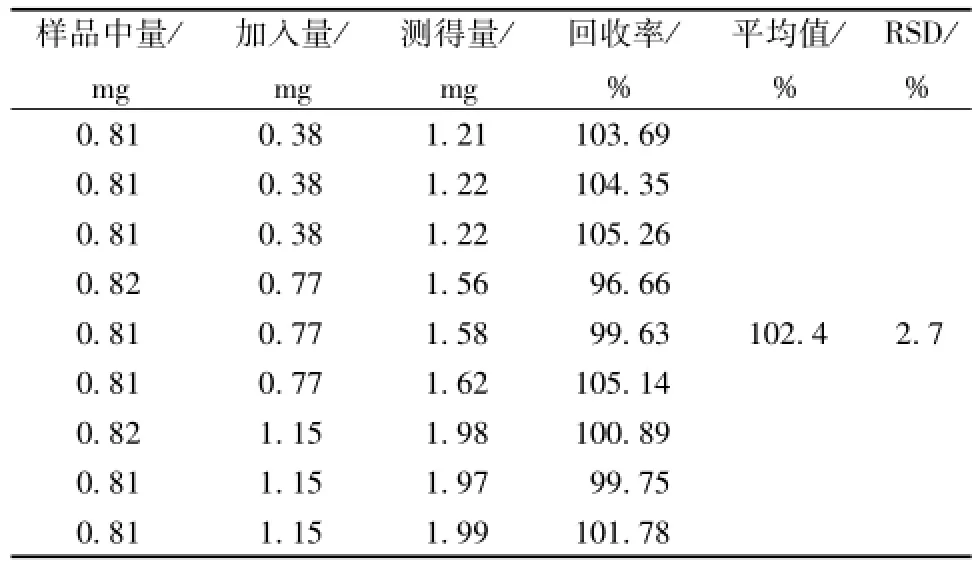
表6 龙胆苦苷加样回收率结果Tab.6 Recoveries of gentiopicroside
2.4.1.10 样品测定 分别取6批龙胆和6批坚龙胆对照提取物样品,按上述方法测定龙胆苦苷峰面积,按标准曲线回归方程计算,对照提取物样品中龙胆苦苷含有量见表5。龙胆对照提取物中龙胆苦苷平均质量分数为31.37%,坚龙胆对照提取物中龙胆苦苷平均质量分数为25.20%。
2.4.2 对照提取物指纹图谱的建立 预试验显示,龙胆对照提取物、坚龙胆对照提取物色谱图差异较大,故分别建立其指纹图谱,并进行相似度分析。
2.4.2.1 指纹图谱色谱条件 流动相为甲醇(A)-乙腈 (B)-0.1%磷酸水 (C),梯度洗脱条件见表7;检测波长240 nm;体积流量 1.0 mL/min;柱温30℃,进样量10 mL。

表7 梯度洗脱条件Tab.7 Gradient elution conditions
2.4.2.2 指纹图谱精密度 取同一供试品溶液(S1,S7),连续进样6次,以龙胆苦苷为参照峰,计算各特征峰相对保留时间、相对峰面积,各特征峰相对保留时间、相对峰面积RSD均小于2%(n=6),仪器精密度良好。
2.4.2.3 指纹图谱稳定性 取同一供试品溶液(S1,S7),室温放置,分别于0、2、4、8、12、24、48 h进样,各特征峰相对保留时间RSD均小于2%、相对峰面积RSD均小于4%(n=7),样品48 h内基本稳定。
2.4.2.4 指纹图谱重复性 取同一批次样品(S1,S7),按 “2.4.1.3”项下方法分别平行制备6份供试品溶液,进样检测。各特征峰相对保留时间、相对峰面积RSD均小于2% (n=6),方法重复性良好。
2.4.2.5 指纹图谱测定与相似度分析 取12批供试品溶液,按 “2.4.2.1”项下方法检测,提取物中成分均可在60 min内洗脱完毕。采用国家药典委员会颁布的 “中药色谱指纹图谱相似度评价系统” (2004A版)软件进行相似度分析,将指纹图谱数据导入相似度评价软件,龙胆、坚龙胆对照提取物指纹图谱分别以S1、S7为参照谱,采用中位数法生成对照特征图谱,相似度分析结果见图3。

图3 相似度分析结果Fig.3 Results of sim ilarity analysis
龙胆、坚龙胆对照提取物各标定5个特征峰,其中1号峰龙胆苦苷为两者共有峰。相似度数据见表5,龙胆对照提取物指纹图谱整体相似度在0.99~1.00,坚龙胆对照提取物指纹图谱整体相似度在0.98~0.99,各批次对照提取物相似度较高,重复性较好。
2.4.2.6 重复性考察 以龙胆苦苷为参照物峰,计算龙胆、坚龙胆对照提取物中各特征峰的相对保留时间,结果见表8。由表8知,各特征峰相对保留时间RSD均小于0.2%,表明制备工艺的重复性良好。
3 讨论
龙胆为多基源药材,2010年版 《中国药典》收载了4种龙胆。其中龙胆和坚龙胆是目前市场流通中的主流产品。条叶龙胆、三花龙胆资源稀缺,本实验仅收集到1批条叶龙胆、1批三花龙胆,样本不足以制备提取物,有待于进一步研究。
以龙胆为研究对象,对龙胆对照提取物制备工艺参数进行了系统研究。前期试验研究表明,坚龙胆指纹图谱中的2、3、5、7号特征峰与龙胆指纹图谱中的4、6、8、9号特征峰的紫外吸收比较相似,其中4、5号峰与6、7号峰保留时间与紫外吸收基本一致,推测其为相同类型的化合物。依据相似相容的原理,可以近似地认为坚龙胆中的小极性成分与龙胆中的小极性成分性质类似。故采用龙胆对照提取物制备工艺制备坚龙胆对照提取物,且通过实验结果 (图3)证明获得了较好的结果。

表8 6批龙胆 (S1~S6)和6批坚龙胆 (S7-S12)对照提取物特征峰相对保留时间Tab.8 Relative retention time of characteristic peaks in reference extract from G.scabra(S1~S6)and G.rigescens(S7-S12)
龙胆对照提取物平均得率较坚龙胆对照提取物低,而龙胆苦苷含有量较坚龙胆对照提取物高。两种对照提取物指纹图谱差异较大 (龙胆对照提取物指纹图谱中的4、6号色谱峰分别与坚龙胆对照提取物指纹图谱中的5、7号峰保留时间相近,紫外吸收光谱相似,但经LC-MS法鉴定为不同成分),说明两种药材化学成分种类及含有量均存在显著差异,有必要分别进行质量控制。
致谢:样品收集得到了兰州佛慈制药股份有限公司的支持,特此致谢。
[1]国家药典委员会.中华人民共和国药典:2010年版一部[S].北京:中国医药科技出版社,2010:89.
[2]Wang Y M,Xu M,Wang D,et al.Review on“Long-Dan”,one of the traditional Chinesemedicinal herbs recorded in Chinese Pharmacopoeia[J].Nat Prod Bioprospect,2012,2(1):1-10.
[3]孔增科.实用中药手册[M].天津:天津科技出版社,1996.
[4]沈 涛,金 航,王元忠,等.中药龙胆化学成分研究进展[J].安徽农业科学,2010(30):16868-16870.
[5]齐静静,宋凤瑞,刘志强,等.高效液相色谱-质谱联用法分析龙胆中的环稀醚萜类成分[J].质谱学报,29(增刊):92-93.
[6]Kim JA,Son N S,Son JK,et al.Two new secoiridoid glycosides from the rhizomes of Gentiana scabra Bunge[J].Arch Pharm Res,2009,32(6):863-867.
[7]冯 波,朱鹤云,关 皎,等.HPLC同时测定龙胆中4中活性成分含量[J].中国实验方剂学杂志,2013,19(13):82-85.
[8]秦 晶,陈国锋,韩丽妹,等.龙胆药材及龙胆总苷提取物的HPLC指纹图谱研究[J].中国新药杂志,2012,21(13):1466-1478.
[9]吴立宏,俞 丽,侴桂新,等.龙胆药材和饮片的质量标准研究[J].中药材,2011,34(4):528-531.
[10]李文龙,陈军辉,殷月芬,等.龙胆药材中龙胆苦苷和马钱子苷酸含量的测定及其指纹图谱研究[J].药学学报,2007,42(5):566-570.
[11]陆兔林,翟为民,蔡宝昌,等.对照提取物在中药质量控制中的应用[J].中国中药杂志,2013,38(3):462.
[12]魏 岚,陈晓辉,张 鹏,等.龙胆药材的高效液相指纹图谱及聚类分析[J].沈阳药科大学学报,2007,24(5):292-294.
[13]江蔚新,钦 浩,何文顺.龙胆药材的HPLC指纹图谱研究[J].中草药,2008,39(10):1563-1565.
[14]李文龙,陈军辉,殷月芬,等.龙胆药材中龙胆苦苷和马钱子苷酸含量的测定及其指纹图谱研究[J].药学学报,2007,42(5):566-570.
[15]鲁艳柳,王长虹,王峥涛.龙胆标准提取物制备及质量标准研究[J].中国药学杂志,2009,43(24):1909-1913.
Preparation and quality control of reference extract from Gentiana scabra and Gentiana rigescens
XUAN Min1, CHENG Xue-mei1,2, WANG Chang-hong1,2*, WANG Zheng-tao1,2
(1.Institute of Chinese Material Medica,Shanghai University of Traditional Chinese Medicine;The MOE Key Laboratory for Standardization of Chinese Medicines,Shanghai 201203,China;2.Shanghai R&D Centre for Standardization of Chinese Medicines,Shanghai201203,China)
AIMTo establish a preparation and quality control of reference extract from Gentiana scabra and G.rigescens.METHODSGentiopicroside and four characteristic peakswere considered as the evaluation index,the preparation processwas optimized through L9(34)orthogonal experiment.HPLC fingerprints of reference extract of G.scabra and G.Rigescens were established respectively.RESULTSThe optimized preparation process was determined as follows:the coarse powdered G.scabra was reflux-extracted with tenfold water for an hour once,three times;the crude extract was concentrated to 6.60 g/100 m L,extracted with threefold ethyl acetate for 2 times,and dried in vacuum.Gentiopicroside(31.37%average content)and four characteristic peaks in reference extractof G.cabras were identified and their overall similarity wasmore than 0.99.Gentiopicroside(25.20%average content)and four characteristic peaks of reference extract from G.Rigescens were detected and their overall similarity wasmore than 0.98.CONCLUSIONThe preparation process of the reference extract from G.scabra presents a good stability and reproducibility.Therefore,it can provide a reference for the quality control of Gentianae Radix slices.
Gentianae Radix;reference extract;gentiopicroside;HPLC fingerprint
R284.2
A
1001-1528(2015)04-0746-06
10.3969/j.issn.1001-1528.2015.04.012
2014-11-20
国家药品标准提高暨2015版药典科研任务资助 (2012)
玄 敏(1988—),女,硕士生,研究方向为药物分析及中药质量标准。E-mail:dfzz-0088@163.com
*通信作者:王长虹,男,研究员,博士生导师,研究方向为中药新制剂与体内过程。Tel:(021)51322511,E-mail:wchcxm@ 163.com
