EV71 及CA16 不同检测方法敏感度及特异性比较
2015-01-16姜广菊何晓娟谢天宏杨水芝朱凡丽龙润乡罗芳宇谢忠平
李 华 杨 婷 姜广菊 何晓娟 岳 磊 谢天宏 杨水芝 朱凡丽 龙润乡 杨 蓉 罗芳宇 谢忠平
手足口病(hand - foot - and - mouth disease,HFMD)是由肠道病毒引起的,为全球性传染病,多发生于5 岁以下儿童,尤以<3 岁儿童发生率最高[1]。可引起手、足、口腔等部位的疱疹,少数患儿可引起心肌炎、肺水肿、无菌性脑膜脑炎等并发症。病毒还可侵犯呼吸系统、中枢神经系统等引起脑炎、肺水肿、驰缓性麻痹、心肌炎等症状,个别重症病例还可导致死亡[2~4]。
引起手足口病的肠道病毒有20 多种,其中以柯萨奇病毒A16 型(coxsackievirus A16,C A16)和肠道病毒71 型(enterovirus 71,EV71)最为常见[2]。国家卫生和计划生育委员会(原卫生部)于2008 年5 月2日将HFMD 纳入丙类法定传染病管理,并制订了相应的诊疗、防控指南[5,6]。2013 年统计手足口病发病1825649 例,死亡人数620 例,占丙类传染病总死亡数百分比是81.50% 。CA16 和EV71 引起的HFMD临床表现相似,难以鉴别。而且EV 71 和CA 16 在遗传学上同源性也较高,核苷酸序列有77%的同源性,氨基酸序列的同源性为89%[7]。因此,研究快速、准确、特异地对EV 71 和CA 16 的诊断方法尤为重要。目前实验室检测手足口病方法,包括病毒分离培养法、血清学中和试验法、ELISA 法、病原体核酸RT -PCR 法及荧光定量PCR 法[8~13]。针对目前品种繁多的检测方法,本试验通过用不同方法、同种方法的不同试剂,检测分离的20 株手足口病病毒(CA16、EV71 各10 株),并进行对比,分析检测方法及检测试剂的敏感度及特异性,同时为自制的ELISA 抗原检测试剂盒找到可参比的试剂和方法。
材料与方法
1.检测用病毒:选本实验室从临床患儿标本中(临床标本的采集及临床研究已申请“知情同意书”免签申请,得到伦理委员会批准)分离、并经过鉴定的EV71 病毒株及CA16 毒株各10 株,进行稀释,选择原倍、10-3及10-63 个浓度,所有的检测方法(试剂)均同时对该20 个毒株的不同浓度(稀释度)病毒进行检测,以确定其敏感度及特异性。
2.检测用细胞:Vero 细胞由笔者单位质量检定室提供。
3.EV71 及CA 16 荧光定量PCR 检测试剂:共选择市场上销售量大的5 个试剂公司生产的荧光定量PCR 检测试剂盒,分别编号为A 公司、B 公司、C 公司、D 公司及E 公司。实验的操作及结果的判定均严格按各试剂的使用说明书进行操作。
4.RT-PCR 检测方法:按表1 设计VP1 引物,引物由生工生物工程(上海)股份有限公司合成[14];采用核酸提取试剂盒(硅胶膜吸附法)提取病毒核酸,用Prime Script One Step RT-PCR Kit(TaKaRa 公司,大连)对VP1 片段进行扩增,产物进行琼脂糖凝胶电泳。

表1 EV71 及CA16 RT-PCR 引物设计序列
5.EV71 及CA16 ELISA 抗原检测试剂:由笔者所在研究室制备[8,9]。
6.细胞培养法:将不同稀释度的病毒接种Vero 细胞,37℃培养7 天观察细胞病变情况,以出现病变的最高稀释度为检测敏感度。
结 果
1.EV71 及CA16 不同检测方法的敏感度:经过对检测结果进行统计分析,其检测方法的敏感度依次为:荧光定量PCR 检测方法、细胞培养病变法(中和法)、普通RT-PCR(VP1)及ELISA 抗原检测法。对于病毒含量达到106CCID50/ml 的样品,所有检测方法的检出率均可达100%;对于病毒含量达到103CCID50/ml 的样品,细胞培养法检出率达100%,荧光定量PCR 检测试剂检出率为80% ~100%,普通RT-PCR(VP1)检测率约50%,而ELISA 抗原检测试剂检出率仅为10%;对于<20 CCID50/ml 病毒载量的样品,则仅有荧光定量PCR 可检出,检出率为0 ~50%(表2、表3)。
2.EV71 及CA16 不同检测试剂的敏感度:CA16检测试剂,对于病毒量达到106CCID50/ml 样品,所用5 个生产厂家的荧光定量PCR 检测试剂均能100%检出;对于病毒量达到103CCID50/ml 级样品,荧光定量PCR 检测试剂检出率为80% ~100%,对于<20CCID50/ml 病毒量的样品,则只有荧光定量PCR 检测试剂才可检出。荧光定量PCR 检测EV71 的敏感度顺序为D >B >A=E=C;荧光定量PCR 检测CA16 的敏感度顺序为C >E >D >B >A (表4、表5)。
3. 检测方法的特异性:经检测ELISA 抗原检测试剂、细胞培养病变法(中和法)及普通RT - PCR(VP1)3 种方法均未发现非特异性假阳性结果,表现为检测方法特异性好,而所用的5 个生产厂家的荧光定量PCR 检测试剂均出现不同程度的非特异性假阳性结果,即荧光定量PCR 检测方法特异性差(表2、表3)。
4.检测试剂的特异性:5 个生产厂家的荧光定量PCR 检测试剂均出现不同程度的非特异性假阳性结果,假阳性率为10% ~100%;通过对5 家EV71 荧光定量检测试剂的特异性进行分析,其顺序为D >A >E >C >B;检测CA16 的特异性顺序为A >C >D >E >B,呈现出假阳性率为高病毒量的样品假阳性率高,低病毒量的样品假阳性率低的趋势(表4、表5)。
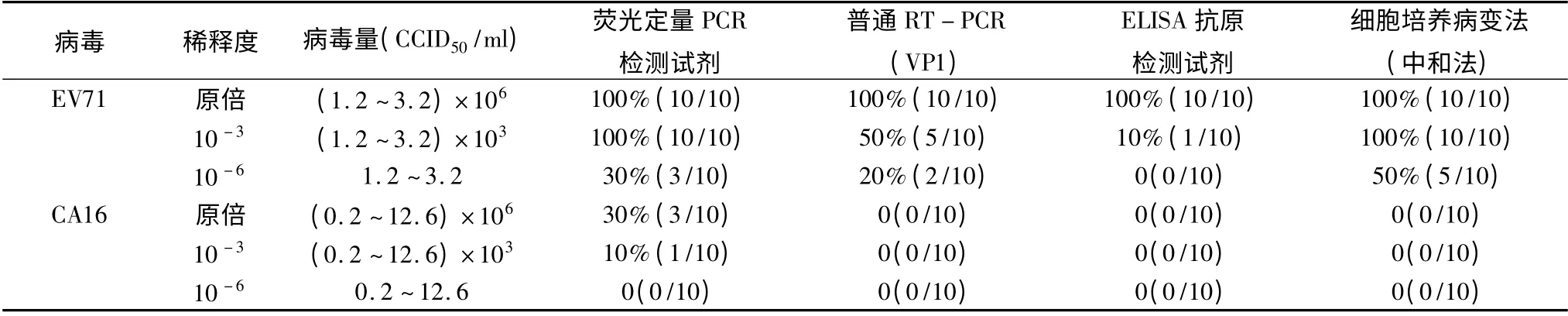
表2 EV71 4 种检测方法敏感度及特异性分析
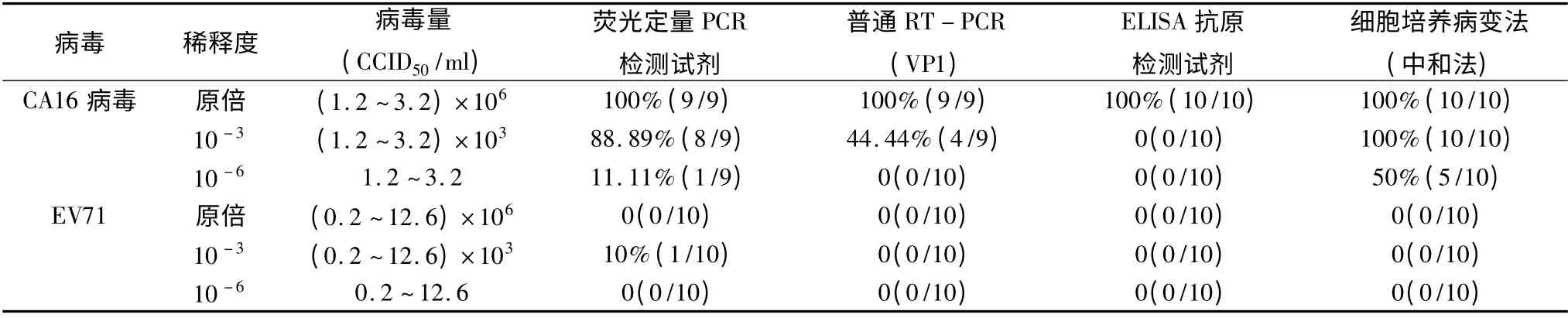
表3 CA16 4 种检测方法敏感度及特异性分析

表4 EV71 检测试剂敏感度及特异性分析
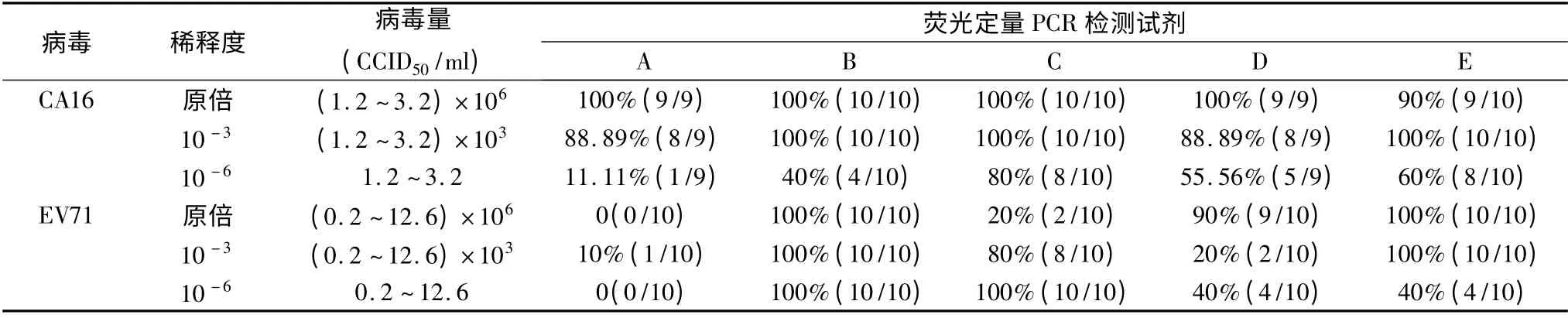
表5 CA16 检测试剂敏感度及特异性分析
5. EV71 及CA16 荧光定量PCR 检测试剂假阳性结果分析:通过对产生假阳性样品的CT 值进行分析,除C 公司EV71 试剂检测CA16 样品CT 值集中在20 ~30 外,其余均集中在>30 的区域,接近阳性标准的上限值,应该是在灰区的范围(表6),所以确定可疑值范围或设定灰区是有必要的。从研究的结果分析,凡CT 值在灰区范围内的样品都应按要求进行重试,这样可以减少非特异阳性结果的产生,保证检测结果的可靠性和准确性。
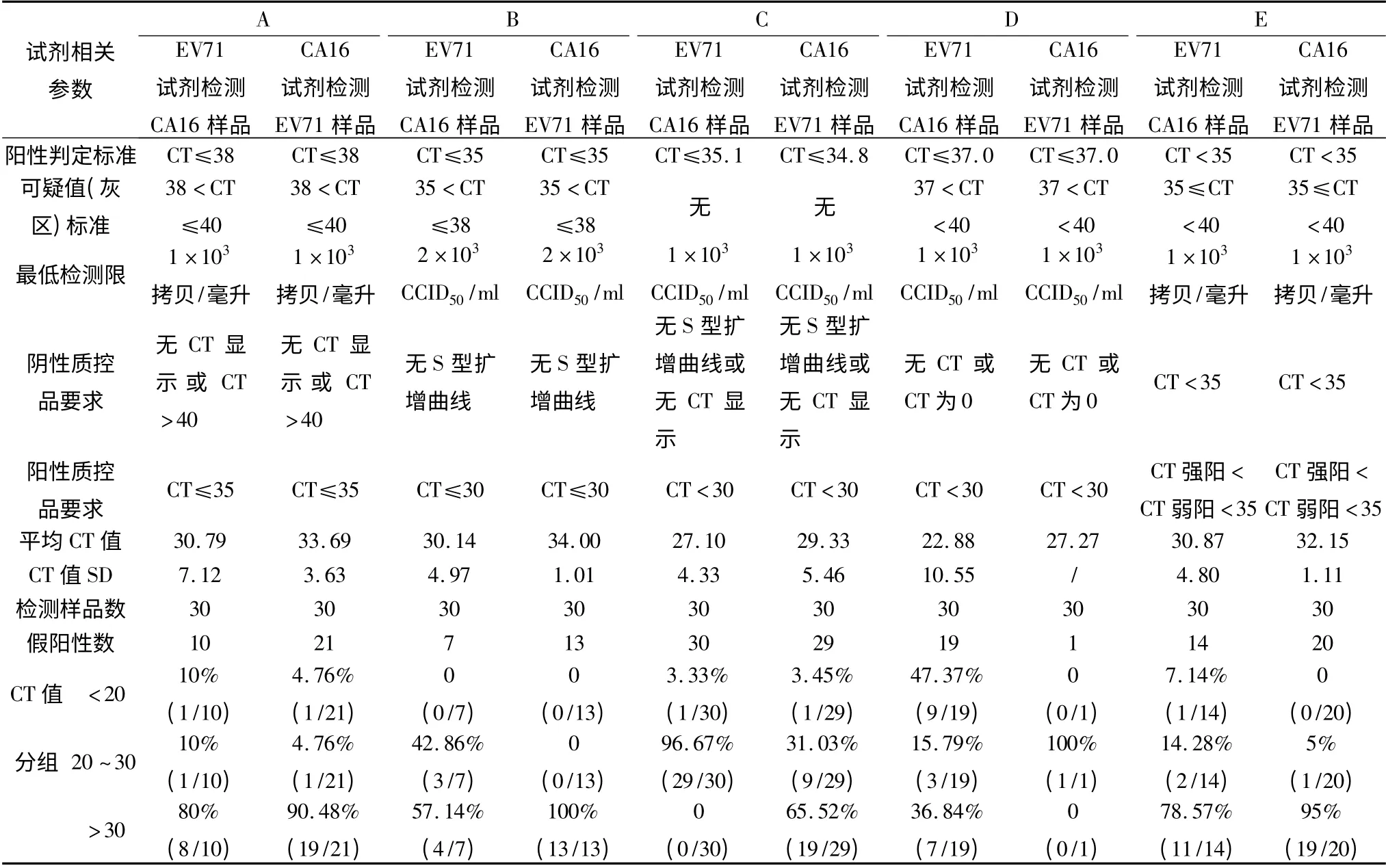
表6 EV71 及CA16 荧光定量PCR 检测试剂假阳性结果CT 值分析
讨 论
对手足口病主要病原体EV71 及CA16 的检测,最初采用病毒培养的方法,但病毒培养方法耗时长,不能满足临床上早期诊断和治疗的要求。随后建立了ELISA 方法,加快了EV71 及CA16 病毒的检测速度。随着分子生物学技术的发展,RT -PCR 及荧光定量PCR 技术获得广泛应用。
从检测样品的分析结果显示,荧光定量PCR 检测法、细胞培养病变法(中和法)、普通RT - PCR(VP1)及ELISA 抗原4 种检测方法,荧光定量PCR检测方法敏感度最高,且可检测到<20CCID50/ml 病毒载量的样品,这与报道一致,荧光定量PCR 检测方法最低检测限达到9.22 ×102PFU/ml 的样本,敏感度比RT-PCR 方法高10 倍[15,16]。但荧光定量PCR检测法也有不足,即特异性差,易造成误差,出现假阳性。对于病毒量达到103CCID50/ml 级样品,细胞培养法能100%检出、荧光定量PCR 检测试剂检出率为80% ~100%不等、普通RT -PCR(VP1)检测率约为50%,而ELISA 抗原检测试剂检出率仅为10%左右,由此试验结果显示,细胞培养法检出率高,是可以与荧光定量PCR 相提并论的,只是由于细胞培养法耗时长,对实验室条件及操作人员要求严格,且一般县级单位不具备细胞培养的硬件设施条件和要求,所以选择荧光定量PCR 或者普通RT -PCR 进行病毒检测。
特异性的检测可以看出所用5 个生产厂家的荧光定量PCR 检测试剂均出现不同程度的非特异性假阳性结果,假阳性率出现的趋势是高病毒量的样品假阳性率高,低病毒量的样品假阳性率低,且假阳性率从10%至100%不等,这与报道不相符[17~19]。这可能是由于本次所用的样品为细胞培养的病毒液,病毒含量相对于临床采集样品具有病毒载量高的原因所致。EV71 及CA16 荧光定量PCR 检测的结果是根据CT 值进行判定的,所以CT 值大于试剂盒阳性判定标准值为阴性,反之为阳性,在灰区为可疑值,应进行重试。在本实验中,EV71 试剂检测CA16 样品有50.0%(15/30)在可疑值范围内、CA16 试剂检测EV71 样品有53.6%(15/28)在可疑值范围内,在此这些样品应按说明书要求进行重试2 次,这样可以减少非特异阳性结果的产生,有必要的还进行敏感细胞的分离培养,降低假阳性的发生率。有研究结果显示,RT -PCR 法与RD 细胞病毒分离法检测出的阳性标本按不同分类统计比较后,差异无统计学意义[20]。从本试验结果看,细胞培养病变法(中和法)及普通RT-PCR(VP1)法检测出的阳性标本按不同分类统计比较后,两者差异也无统计学意义,这与报道一致。
综上所述,分析比较5 个生产厂家检测试剂的敏感度及特异性,可以得出检测EV71 和CA16 分别选择D、C 厂家的荧光定量PCR 试剂效果较好。4 种检测方法中,虽然细胞培养病毒分离是确定手足口病病原体的金标准,但所需时间相对较长,本试验结果显示细胞培养病变法及普通RT -PCR(VP1)法检测的结果一致性高,所以在应急阶段可首选普通RT -PCR(VP1)法。
1 卫生部.手足口病诊疗指南(2010 版)[J]. 国际呼吸杂志,2010,30(24):1473 -1475
2 周世力,杨帆,金奇. 肠道病毒71 型的研究进展[J]. 病毒学报,2003,19 (3):284 -287
3 陆一涵,姜庆五. 人肠道病毒7l 型与手足口病[J]. 疾病控制杂志,2008,12 (3):183 -188
4 李琳琳,何雅晴,朱俊萍,等. 柯萨奇病毒A 组16 型中国分离株(Cox1A16 SHZH0021)全基因组序列测定及分析[J]. 病毒学报,2005,3(21):217 -222
5 中华人民共和国卫生部. 肠道病毒(EV71)感染诊疗指南(2008年版)[S].2008
6 中华人民共和国卫生部.2008 年手足口病预防控制指南[J]. 中华实验和临床感染病杂志,2008,2 (3):210 -213
7 Brown BA,Oberste MS,Alexander JP,et al. Molecular epidemiology and evolution of enterovirus 71 stratus isolated from 1970 to 1998[J].J Virol,1999,73(12):9969 -9975
8 龙润乡,谢忠平,杨蓉,等. EV71 抗原BA-ELISA 检测方法的建立及应用[J]. 中国生物制品学杂志,2009,23(4):1230 -1232
9 刘正玲,李华,龙润乡,等. Cox A16 抗原检测试剂研究及初步应用[J]. 中国卫生检验杂志,2013,23(4):801 -805
10 严菊英,卢亦愚,徐昌平,等. 肠道病毒TaqMan 荧光定量RT -PCR 法快速检测[J].中国公共卫生,2007,23 (7):45 -46
11 王松,许城,张红梅,等. RT - PCR 检测手足口病病原体EV71[J].中华实验和临床感染病杂志,2008,2 (4):30 -31
12 Chen TC,Chen GW,Hsiung CA,et al. Combining multiplex reverse transcription -PCR and a diagnostic microarray to detect and differentiate enterovirus 71 and coxsackievirus A16[J]. J Clin Microbiol,2006,44(6):2212 -2219
13 Thao NT,Ngoc NT,Tu PV,et al. Development of a multiplex polymerase chain reaction assay for simultaneous identification of human enterovirus 71 and coxsackievirus A16[J]. J VirolMethods,2010,170(1 -2):134 -139
14 姜广菊,李华,杨婷,等. 科萨奇病毒A 组16 型临床分离株的生物学特性分析[J]. 中国生物制品学杂志,2014,27(5):607 -611
15 朱坤,高秀杰,邓中平,等.肠道病毒71 型实时荧光RT-PCR 检测方法的建立及临床评价[J].热带医学杂志,2010,10(5):505 -519
16 严菊英,卢亦愚,徐昌平,等. 肠道病毒EV71 荧光定量RT -PCR法快速检测[J].中国公共卫生,2009,25(7):843 -844
17 雷永良,陈秀英,叶碧峰,等. 实时荧光定量PCR 在手足口病肠道病毒快速检测中的应用[J]. 中国病原生物学杂志,2008,10(3):738 -739
18 王成勇,王建,高远征,等.手足口病病原体核酸在患者不同样本中的分布[J]. 中华实验和临床感染病杂志:电子版,2013,7(3):101 -103
19 廖英,谢鸿恩. 手足口病病原学检测及临床特点相关性研究[J].吉林医学,2010,31(24):4075 -4076
20 梁英,怀清杰,张炳丽,等.两种检测方法对EV71 病毒监测结果的影响研究[J].中国卫生检验杂志,2010,20(7):1590 -1592
