2种取代苯对花翅摇蚊毒性和细胞色素P450酶活性的影响
2015-01-16吴韶平李小鹏王志英曹传旺
牛 芳,谢 菲,张 健,吴韶平,李小鹏,王志英,曹传旺*
(1.东北林业大学林学院,黑龙江哈尔滨 150040;2.江西省林业有害生物防治检疫局,江西南昌 330038)
2种取代苯对花翅摇蚊毒性和细胞色素P450酶活性的影响
牛 芳1,谢 菲2,张 健1,吴韶平1,李小鹏1,王志英1,曹传旺1*
(1.东北林业大学林学院,黑龙江哈尔滨 150040;2.江西省林业有害生物防治检疫局,江西南昌 330038)
[目的]明确取代苯类污染物对水生昆虫毒性及细胞色素P450酶活性的影响。[方法]运用药液培养法和酶活性测定法分析了对氯苯酚和对苯二胺对花翅摇蚊4龄幼虫毒性及细胞色素P450酶活体和离体活性的影响效应。[结果]对氯苯酚和对苯二胺对花翅摇蚊4龄幼虫的24 h半数致死浓度(LC50)分别为38.65和78.43 mg/L。对氯苯酚对花翅摇蚊4龄幼虫体内P450酶活性作用主要表现为随作用时间增加抑制作用减小;而对苯二胺则主要表现为随作用浓度增加诱导作用增强。对氯苯酚和对苯二胺对花翅摇蚊4龄幼虫离体P450酶活性的半数抑制浓度(IC50)分别为466.15和594.43 mg/L。[结论]花翅摇蚊细胞色素P450可作为监测对氯苯酚和对苯二胺水体污染的参考生物化学标志物。
花翅摇蚊;对氯苯酚;对苯二胺;细胞色素P450;毒性;活性
取代苯作为一类环境有机污染物,主要以工业废液等形式排放到江、河、湖、海等水体生态系统中[1],一方面对水生生物造成直接危害,另一方面通过污染水生态环境对水生生物的生长发育造成不可逆的影响,从而进一步通过食物链传递和迁移危及到人和牲畜的健康[2-3]。对氯苯酚广泛用于化学工业,是我国优先控制污染物[4]。对苯二胺是目前使用最广泛的氧化型染发剂的重要成分之一,与双氧水混合氧化后形成大分子色素使头发永久性着色[5]。探讨对氯苯酚和对苯二胺在生物体内的代谢途径和生物的应激解毒机制,寻找生物标志物监测该类污染物间接为保证人类健康提供参考。
细胞色素P450酶系作为生物标志物,因其可催化体内多种反应(环氧化作用、O-脱羟基作用、N-脱羟基作用),可代谢包括杀虫剂、多环芳烃、卤化烃等约25万种外源性化合物[6],尤其是生物体内P450酶系活性变化常用于环境污染物的监测[7]。摇蚊是一种水生态系统中普遍存在且数量众多的底栖生物,具有容易饲养、生命周期短、对外界环境污染物暴露敏感等特点,被广泛用于水体污染物致毒机理和污染监测的靶标生物[8]。花翅摇蚊(Chironomuskiinensis)隶属于双翅目(Diptera)摇蚊科(Tendipedidea),为完全变态昆虫,是摇蚊中的优势种。国内外对红裸须摇蚊(Propsilocerusakamusi)生物标记物的研究报道较多,而有关花翅摇蚊生物标记物以及解毒酶系的研究鲜有报道。笔者以花翅摇蚊为对象,在测定了对氯苯酚和对苯二胺对摇蚊幼虫急性毒性基础上进一步研究了2种取代苯对细胞色素P450酶活性的影响,旨在探讨细胞色素P450作为监测取代苯污染物的生物化学标志物的可能性。
1 材料与方法
1.1 材料
1.1.1供试昆虫。花翅摇蚊初始种群来源于中国农业大学昆虫生理与毒理实验室,在室内用暴晒除氯3 d以上的自来水进行饲养,每7 d换一次水和投喂1~3 g金鱼幼虫饲料(产品成分:进口鱼粉、南极虾粉、植物蛋白、维生素、矿物质以及氨基酸),采用50目纱网罩住以防止成虫飞出,自然光照饲养。挑选健壮、颜色、大小一致的4龄幼虫用于试验。
1.1.2主要试剂。考马斯亮蓝G-250、牛血清白蛋白(BSA)、苯甲基磺酰氟(PMSF)、二硫苏糖醇(DTT)、乙二胺四乙酸(EDTA)、丙基硫氧嘧啶(PTU)、还原性辅酶Ⅱ(NADPH)和二甲基亚砜(DMSO)均购自Sigma公司;磷酸二氢钠、浓盐酸、氯仿、乙醇、磷酸、氢氧化钠均为分析纯。对硝基苯甲醚、对硝基苯酚和对氯苯酚(含量99%)购自国药集团化学试剂有限公司;对苯二胺(含量98.5%)购自天津光复精细化工研究所。
1.2 方法
1.2.1摇蚊急性毒性测定。采用药液培养法。将对氯苯酚和对苯二胺用DMSO配制成10 000 mg/L母液,再用蒸馏水配成6~7个浓度梯度,以蒸馏水为空白对照,将供试摇蚊4龄幼虫放入盛有50 ml药液的透明塑料杯中,每处理20头,每浓度3次重复,观察摇蚊的中毒症状并及时挑出死亡个体,分别于6、12、24、48 和96 h统计死亡数,以探针触动摇蚊尾部对机械刺激无反应者视为死亡。
1.2.2致毒处理。将对氯苯酚和对苯二胺用DMSO配制成10 000 mg/L母液,再用蒸馏水稀释成1、10和100 μmol/L 的应用液。随机挑取25头健康、颜色、大小一致的花翅摇蚊4龄幼虫放入50 ml应用液中,不含取代苯蒸馏水作为对照,每个浓度14个处理,处理24和72 h各更换一次药液,分别于6、12、24、48、72、96 h随机挑取40头花翅摇蚊4龄幼虫,滤纸吸收虫体表面药液后,液氮迅速冷冻,立即或放入-80 ℃冰箱内用于P450酶活性测定。
1.2.3细胞色素P450酶活性测定。取花翅摇蚊4龄幼虫40头置于5 ml玻璃匀浆器中,加入4 ml 0.1 mol/L磷酸缓冲液(含0.1 mmol/L DTT、1.0 mmol/L EDTA、1.0 mmol/L PTU、1.0 mmol/L PMSF, pH 7.5),冰上研磨充分,6 907 r/min离心15 min,上清液即为原酶液。将1 ml原酶液、800 μl 0.1 mol/L磷酸缓冲液(pH 7.5)、100 μl 4.8 mmol/L NADPH、100 μl 20.0 mmol/L对硝基苯甲醚底物放入10 ml离心管中充分振荡混匀,30 ℃水浴温育30 min,加入40 μl浓盐酸终止反应,再加入5 ml氯仿,剧烈振荡20 min,静置3~5 min,1 938 r/min、4 ℃离心15 min,吸取下层清液3 ml并转移至10 ml离心管中,加入3 ml 0.5 mol/L 氢氧化钠溶液,剧烈振荡15 min,静置5 min,吸取上层萃取液,于412 nm波长下测定生成对硝基苯酚OD值,空白对照组采用3 ml氢氧化钠溶液,每个处理3次重复。测定不同浓度对硝基苯酚在412 nm波长下的OD值,根据OD值和对硝基苯酚含量制作标准曲线,根据标准曲线计算样品体系中对硝基苯酚的含量。根据反应时间、对硝基苯酚的生成量和蛋白质含量计算细胞色素P450酶比活力。蛋白质含量的测定参照Bradford的考马斯亮蓝G-250法[9]。
1.2.4取代苯对离体细胞色素P450酶活性的抑制。将对氯苯酚配制成浓度为10、50、100、300、500 mg/L的溶液,对苯二胺配制成浓度为10、50、100、500、900、1 000 mg/L的溶液,以蒸馏水为对照组,每个处理随机选取40头花翅摇蚊4龄幼虫用于细胞色素P450酶液制备。反应体系为1 ml原酶液、760 μl 0.1 mol/L磷酸缓冲液(pH 7.5)和40 μl不同浓度的对氯苯酚或对苯二胺溶液,充分混匀,30 ℃水浴5 min,再加入100 μl 4.8 mmol/L NADPH、100 μl 20.0 mmol/L对硝基苯甲醚,充分混匀后迅速放入30 ℃温浴25 min,每个浓度3次重复,其余测定方法同“1.2.3”。
1.3 数据处理采用POLO软件计算取代苯对摇蚊幼虫的LC50及95%置信区间。运用GraphPad InStat软件对同一时间不同浓度间差异采用Tukey检验进行比较分析(P=0.05)。酶活性抑制率=(对照活性-残留活性)/对照活性×100%。以取代苯浓度的对数值(LogM)和酶活性抑制率(%)得出浓度对数-抑制率线性回归方程,根据方程求出抑制率为50%的取代苯浓度,即为IC50。
2 结果与分析
2.1 对氯苯酚和对苯二胺对花翅摇蚊幼虫的毒性对氯苯酚和对苯二胺对花翅摇蚊4龄幼虫半数致死浓度随着作用时间的延长而减小,24 h半数致死浓度分别为38.65和78.43 mg/L,表明对氯苯酚对花翅摇蚊毒性大于对苯二胺(表1)。
表1 对氯苯酚和对苯二胺对花翅摇蚊4龄幼虫的急性毒性
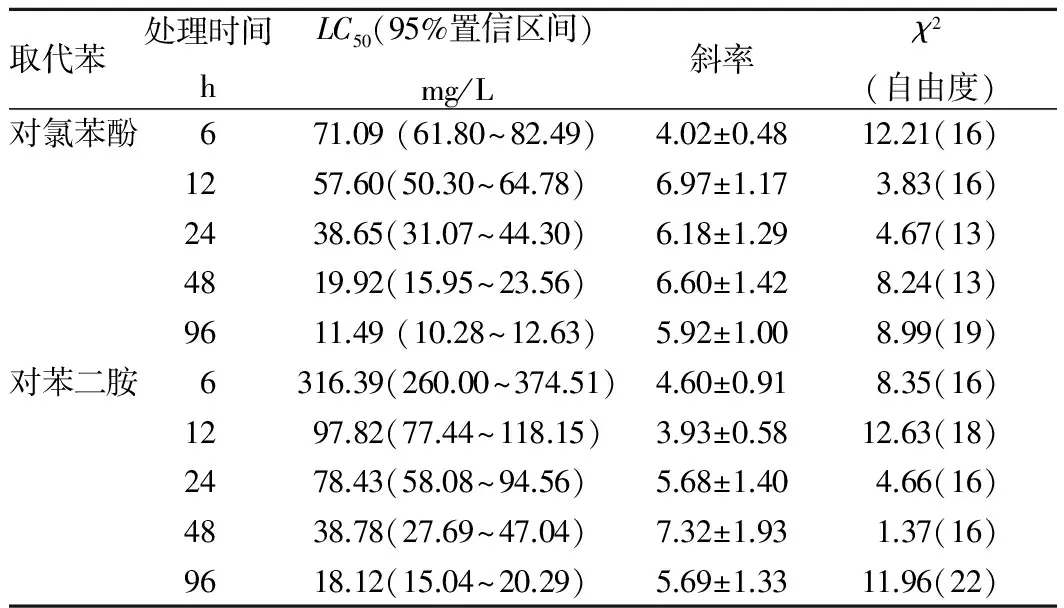
取代苯处理时间hLC50(95%置信区间)mg/L斜率χ2(自由度)对氯苯酚671.09(61.80~82.49)4.02±0.4812.21(16)1257.60(50.30~64.78)6.97±1.173.83(16)2438.65(31.07~44.30)6.18±1.294.67(13)4819.92(15.95~23.56)6.60±1.428.24(13)9611.49(10.28~12.63)5.92±1.008.99(19)对苯二胺6316.39(260.00~374.51)4.60±0.918.35(16)1297.82(77.44~118.15)3.93±0.5812.63(18)2478.43(58.08~94.56)5.68±1.404.66(16)4838.78(27.69~47.04)7.32±1.931.37(16)9618.12(15.04~20.29)5.69±1.3311.96(22)
2.2 对氯苯酚和对苯二胺对花翅摇蚊幼虫细胞色素P450酶体内活性的影响从图1可知,对氯苯酚处理花翅摇蚊4龄幼虫6 h,10和100 μmol/L处理组体内P450酶活性均低于对照,分别为对照组的0.67和0.38倍,表现为显著抑制作用(P<0.05)。暴露12和24 h,摇蚊体内P450酶活性变化相似,均低于对照组,最大抑制率分别为40.88%和70.68%。然而,处理72 h,摇蚊体内P450酶活性均显著高于对照(P<0.05),表现为诱导增强;其中100 μmol/L对氯苯酚最大诱导率为54.01%。暴露96 h,摇蚊体内P450酶活性随浓度增加而降低,100 μmol/L对氯苯酚对P450酶活性抑制率为32.43%。对氯苯酚对花翅摇蚊幼虫体内P450酶活性的影响主要表现为随着作用时间的增加而抑制作用减小。
由图2可知,与对照组相比,暴露对苯二胺6~24 h,摇蚊体内P450酶活性均显著低于对照,表现为显著抑制作用(P<0.05),最大抑制率分别为64.94%、62.31%和55.88%。暴露48 h,1和10 μmol/L处理组P450酶活性显著低于对照组(P<0.05),而100 μmol/L处理组P450酶活性高于对照,表现为诱导作用,诱导率为15.80%。暴露72和96 h,摇蚊体内P450酶活性变化相似,表现为低浓度抑制高浓度诱导作用,其中100 μmol/L对苯二胺诱导率分别为59.47%和29.12%。对苯二胺对摇蚊体内P450酶活性的影响主要表现为随着作用浓度和时间的增加诱导作用增强。
2.3 对氯苯酚和对苯二胺对花翅摇蚊幼虫细胞色素P450酶离体活性的影响由表2可知,对氯苯酚和对苯二胺对花翅摇蚊4龄幼虫P450酶离体活性均有抑制作用,且随浓度的增加而增大。对氯苯酚对P450酶活性半数抑制浓度为466.15 mg/L,而对苯二胺对P450酶活性半数抑制浓度为594.43 mg/L,表明离体P450酶对对氯苯酚敏感性高于对苯二胺。
表2 对氯苯酚和对苯二胺对花翅摇蚊4龄幼虫P450酶半数抑制浓度

取代苯半数抑制浓度mg/L方程相关系数对氯苯酚466.15y=12.58x+16.400.95对苯二胺594.43y=21.18x-8.740.94
3 讨论
具有苯环的芳香烃类取代物因其良好的化学稳定性和热稳定性,不易被分解或生物降解,对水体的污染毒性大且具有“三致”效应和遗传毒性,长期的沉积与污染会对人类健康与水生生物生长发育造成不可逆的危害[10]。环境污染物对水生生物毒性的评价一般以LC50作为评价依据。该研究结果表明,对氯苯酚和对苯二胺对花翅摇蚊4龄幼虫96 h半数致死浓度分别为11.49和18.12 mg/L。根据《化学农药环境安全评价试验准则》[11]中对鱼类的毒性等级划分标准可知,对氯苯酚和对苯二胺对花翅摇蚊属于低毒性的污染物。对苯二胺对泥鳅(Misgurnusangullicaudatus)LC50范围为10~100 mg/L,根据有毒物质对鱼类的急性毒性标准也属于低毒[5]。苯环上的-H被不同取代基取代后表现出对生物的不同毒性差异,该研究表明6~96 h对氯苯酚的LC50均低于对苯二胺,其对氯苯酚对花翅摇蚊4龄幼虫的急性毒性高于对苯二胺。大量研究也表明,苯酚、苯胺、氯苯和硝基苯对三疣梭子蟹(Portunustrituberculatus)的急性毒性大小为硝基苯>苯酚>氯苯>苯胺,基团毒性大小为-NO2>-OH>-Cl>-NH2[12]。取代苯化合物对发光菌的急性毒性研究也表明不同取代基间的化合物毒性大小为对二氯苯>对苯二胺,基团毒性大小为-Cl>-NH2[13];同样,6种取代芳烃化合物对发光菌的急性毒性大小为氯苯>对苯二胺>苯酚[14],由此可见,对二氯苯与氯苯对生物的急性毒性均高于对苯二胺,当芳香族化合物氯苯引入-OH后形成氯酚类化合物,使其极性增强,易与蛋白质中的碱基作用, 表现出较强的亲和力, 从而提高其毒性[15]。同时,由于氯酚中含有-OH会与受体靶分子发生相互作用, 还可以通过氢键结合增加与细胞的脂溶性而增强其毒性,这与该研究结果“对氯苯酚毒性大于对苯二胺”相一致[12]。从元素的电负性角度分析,O、Cl、N电负性大小为O>Cl>N,O、Cl、N随电负性的减小,其得到电子的能力逐渐减弱,与生物分子间的作用力也逐渐变弱[16],而除H元素外,对氯苯酚的取代基含有O和Cl元素,而对苯二胺取代基仅含N元素,从基团的电负性比较,-OH的电负性也要高于-NH2[17]。对氯苯酚毒性高于对苯二胺与元素和基团电负性的大小呈现相一致的结果。
LC50常作为最可信的毒性效应指标,而环境有机污染物对水生生物体内生物标志物系统也产生不同致毒效应。生物标志物能够对1种或多种化学污染物的暴露效应的生化、细胞、生理、行为以及能量上的变化[18],是衡量环境污染物的暴露及效应的生物反应。P450s酶系属于混合功能氧化酶(MFO)的一种,已作为环境中公认的生物标志物,对多环芳烃(PAHs)、多氯联苯(PCBs)等有机污染物极敏感,可通过水体水生生物P450酶来监测这些有机污染物的污染状况[19]。其中,鱼肝细胞色素 P4501A1(CYP1A1)作为有机污染物的生物标志物已经大量应用于野外现场研究[20]。P450酶系作为良好的生物标志物,一是外源化合物可以诱导或抑制P450酶活性表达[21],可通过P450酶的表达量得到监控,同时,其良好的解毒性可将脂溶性有机异生物质转化为水溶性的易被生物排泄的代谢产物,包含生物转化酶和解毒酶,几乎存在于生物体所有组织中[22]。P450酶还可通过电子传递机制和羟基化、环氧化、脱烷基化、脱氯化等过程生物催化不同类型外源物质代谢过程,从而实现对污染物的生物降解[23]。目前,研究表明P450酶系中的亚酶CYP1A1,在二恶英(TCDD)浓度为50.0 nmol/L以上,处理48、72 h的诱导下,CYP1A1的表达上调,存在相应的时间与剂量关系[24],CYP1A1可作为TCDD污染物的检测性物质;黑斑蛙(Rananigromaculata)暴露于Cd溶液30 d,其精巢组织细胞色素P450亚族酶乙氧基异酚恶唑脱乙基酶(EROD)活性在0.5和1.0 mg/L Cd 处理组被显著抑制,对低浓度的Cd溶液较敏感[25]。艾国民等利用高效液相色谱法测定家蝇吡虫啉抗性和敏感品系体内细胞色素P450 O-脱甲基活性,发现抗性品系家蝇的P450 O-脱甲基活性为敏感品系的3.34倍[26]。该研究通过分光光度计法测定细胞色素P450 O-脱甲基活性,结果表明P450酶活性对对氯苯酚与对苯二胺响应存在相应时间与剂量效应。取代苯对氯苯酚和对苯二胺对花翅摇蚊4龄幼虫体内P450酶活性的影响主要表现为抑制作用,96 h作用时间内最大抑制率分别为70.68%和64.94%,而对离体P450酶活性的IC50分别为466.15和594.43 mg/L,均高于LC50。虽然离体P450IC50可以表明花翅摇蚊幼虫对对氯苯酚敏感性高于对苯二胺,但从作为指示性指标来说,水体中对氯苯酚与对苯二胺的浓度远小于LC50,采用摇蚊急性毒性处理的LC50比离体P450酶活性的LC50更为适合。总之,对氯苯酚与对苯二胺对花翅摇蚊4龄幼虫均具有一定的毒性效应,且随着处理时间的延长,花翅摇蚊幼虫对对氯苯酚和对苯二胺的敏感性增大。此外,对氯苯酚和对苯二胺还影响花翅摇蚊体内和体外细胞色素P450酶活性,并随着浓度和暴露时间的延长呈现剂量-时间效应,表明细胞色素P450酶参与了花翅摇蚊对对氯苯酚和对苯二胺的应答机制。然而,由于编码细胞色素P450蛋白的基因是一个超级家族,可能由于不同亚家族基因对对氯苯酚和对苯二胺存在不同时间和浓度表达效应,最终导致P450酶活性呈现无显著的差异规律性,因此,有关细胞色素P450家族基因表达与取代苯类有机污染物胁迫的相关性有待进一步研究。
[1] 刘洪霞. 花翅摇蚊乙酰胆碱酯酶的生化特性及其在水质监测中的应用[D].北京:中国农业大学, 2006.
[2] 陈传平, 张庭廷, 何梅, 等. 苯胺、苯酚对淡水藻类生长的影响[J]. 应用生态学报, 2007, 18(1): 219-223.
[3] SAHA N C, BHUNIA F, KAVIRAJ A. Toxicity of phenol to fish and aquatic ecosystems[J]. Bulletin of Envirionmental Contamination and Toxicology, 1999, 63(2):195-202.
[4] 周文敏, 傅德黔, 孙宗光.中国水中优先控制污染物黑名单的确定[J]. 环境科学研究, 1991, 6(4): 1-3.
[5] 于淑池, 许丽敏, 朱叶莲, 等.对苯二胺对泥鳅的急性毒性及安全评价[J].水生态学杂志,2011, 32(2):131-134.
[6] LEWIS D F, WATSON E, LAKE B G. Evolution of the cytochrome P450 superfamily,sequence alignments and pharmacokinetics[J]. Mutat Res, 1998, 410: 245-270.
[7] 赵于丁, 郭敦明, 范青海, 等. 生物标志物在农药水生态毒理学中应用的进展[J]. 江苏农业学报, 2009, 25(1): 203-209.
[8] 葛士林, 曹传旺, 王志英. 3种农药对红裸须摇蚊体内蛋白质质量分数和AChE活性的影响[J]. 东北林业大学学报, 2011, 39(1): 108-109, 126.
[9] BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein dye binding[J]. Analytical Biochemistry, 1976, 72(2): 248-254.
[10] 匡少平, 孙东亚. 多环芳烃的毒理学特征与生物标记物研究[J].世界科技研究与发展, 2007, 29(2): 41-47.
[11]中国国家标准总局. GB/T31270.12-2014化学农药环境安全评价试验准则 [S].北京:中国标准出版社, 2014.
[12] 李铁军,郭远明,尤矩炬,等. 苯酚、苯胺、氯苯和硝基苯对三疣梭子蟹Portunustrituberculatus(Miers)的急性毒性研究[J]. 现代渔业信息, 2009(1):15-17.
[13] 翟丽华. 部分取代苯化合物对发光菌的急性毒性研究[D].郑州:郑州大学, 2003.
[14] 董玉瑛,冯霄,雷炳莉. 毒性比法量化判定芳烃化合物毒性类型的研究[J]. 大连民族学院学报, 2005(5):12-14, 29.
[15] 王阳峰,吕玉新. 用水生态毒理学方法评价13种硝基苯类化合物的急性毒性[J]. 新乡医学院学报, 2004(6): 456-457, 460.
[16] 聂长明,文松年,李忠海,等. 基态原子价壳层电子能级连接性指数与元素的电负性[J]. 化学学报,2002(2):207-214, 181.
[17] 聂长明. 基团电负性[J]. 武汉大学学报:自然科学版, 2000(2):176-180.
[18] DEPLEDGE M H, AAGAARD A, GYORKOS P. Assessment of trace metal toxicity using molecular, physiological and behavioural biomarkers [J]. Marine Pollution Bulletin, 1995, 31: 19-27.
[19]丁竹红,谢标,王晓蓉. 生物标志物及其在环境中的应用[J]. 农业环境保护, 2002(5):465-467, 470.
[20] 姜元臻. 生物标志物监测环境污染研究新进展[J]. 广东化工, 2010(4):150-152, 154.
[21] 朱琳, 钱芸, 刘广良. 细胞色素P450酶系及其在毒理学上的应用[J]. 上海环境科学, 2001, 20(2): 88-91.
[22] 生秀梅,熊丽,唐红枫,等. 细胞色素P450酶系作为生物标志物在毒理学上的应用[J]. 四川环境, 2005(3):74-78.
[23] 尚卫辉, 李永涛, 舒薇,等. P450酶系对污染物的生物指示和催化降解机制[J]. 环境科学与技术,2009(6):12-16.
[24] 刘移民, YAN YAN, BEVERLY D,等. 多环芳烃受体基因与细胞色素P4501A1/1B1基因表达的调控[J]. 中国职业医学, 2003(3):10-13.
[25] 贾秀英, 施蔡雷, 张杭君. 镉对黑斑蛙精巢细胞色素P450酶及谷胱甘肽转移酶活性的影响[J]. 环境科学学报, 2013, 33(10) : 2892-2896.
[26] 艾国民, 王庆敏, 邹东云, 等. 高效液相色谱法测定家蝇细胞色素P450 O-脱甲基活性[J]. 分析化学, 2009(8):1157-1160.
Toxicity of Two Substituted Benzenes and Their Effects on Cytochrome P450 Activity ofChironomuskiinensis
NIU Fang1, XIE Fei2, ZHANG Jian1, CAO Chuan-wang1*et al
(1. School of Forestry, Northeast Forestry University, Harbin, Heilongjiang 150040; 2. Jiangxi Forest Pest Control and Quarantine Bureau, Nanchang, Jiangxi 330038)
[Objective] The aim was to evaluate the effects of substituted benzenes on the aquatic insect toxicity and the activities of cytochrome P450. [Method] The 4th instarC.kiinensislarvae were used to evaluate the toxicity of p-chlorophenol and p-phenylenediamine and the effects of them on the activities of cytochrome P450 using the method of liquid culture and in vivo and in vitro enzymatic activity assay, respectively. [Result] TheLC50value of p-chlorophenol and p-phenylenediamine to larvae after exposure for 24 h was 38.65 and 78.43 mg/L, respectively. The inhibition of P450 activities in the 4th instarC.kiinensislarvae gradually decreased with the increase of treatment time of p-chlorophenol while the induction of P450 activity increased with the increase of p-phenylenediamine concentration. The median inhibitory concentration (IC50) of the in vitro cytochrome P450 activity for p-chlorophenol and p-phenylenediamine were 466.15 and 594.43 mg/L, respectively. [Conclusion] The cytochrome P450 activity of theC.kiinensiscan be served as a biochemical marker to monitor the water pollution caused by the p-chlorophenol and p-phenylenediamine.
Chironomuskiinensis; P-chlorophenol; P-phenylenediamine; Cytochrome P450;Toxicity;Activity
中央高校基本科研业务费专项(2572014CA10);黑龙江省自然科学基金项目(C201409);东北林业大学青年拔尖人才项目(PYTT-1213-10)。
牛芳(1989-),女,吉林吉林人,硕士研究生,研究方向:昆虫毒理学。*通讯作者,副教授,博士,硕士生导师,从事昆虫毒理学研究。
2015-03-18
S 186
A
0517-6611(2015)12-113-04
