利拉鲁肽治疗2 型糖尿病合并非酒精性脂肪肝患者的临床观察
2015-01-16叶启宝何媛媛吕齐欢马维青
叶启宝 何媛媛 吕齐欢 陈 丽 马维青
随着人们生活方式和饮食结构的改变,2013 年全球糖尿病患病率约8.3%,我国20 岁以上的成年人2010 年年龄标化的糖尿病发生率为11.6%[1,2];而在2 型糖尿病( T2DM) 人群中脂肪肝的伴随率高达60% ~80%[3]。研究结果显示,NAFLD 患者伴有肥胖、糖代谢、脂代谢紊乱和血压增高等特征,与T2DM、代谢综合征( MS) 以及心脑血管疾病密切相关。因此,临床上日益重视2 型糖尿病合并NAFLD的早期诊断,有效控制血糖,减轻体重,改善胰岛素抵抗( IR) ,有利于减缓NAFLD 的进展。对于糖尿病患者在选择治疗伴随疾病的药物时,需要考虑肝脏的安全性。利拉鲁肽是人胰高糖素样肽-1( GLP -1) 类似物,是一种有效的新型抗糖尿病药物,不仅能有效控制血糖,保护胰岛β 细胞,改善胰岛素抵抗,调脂、降压,还能显著减轻患者体重,且无肝脏毒不良反应,已经成为2 型糖尿病治疗药物研究的新热点。本研究分析2 型糖尿病合并NAFLD 患者应用利拉鲁肽治疗的疗效性及安全性,现总结如下。
对象与方法
1.研究对象:选取笔者医院2014 年1 ~8 月收治的30 例在笔者科室住院的初诊或血糖控制不佳2 型糖尿病合并NAFLD 患者;入组标准: ①年龄≥22 岁; ②糖尿病诊断符合1999 年世界卫生组织的诊断标准;糖化血红蛋白( HbA1c) >7%;③NAFLD 的诊断符合《中国非酒精性脂肪性肝病诊疗指南(2010 年修订版) 》的标准[4]; ④BMI >25kg/m2; ⑤无严重肝功能损害,谷丙转氨酶( ALT) <正常值上限2 倍;⑥排除糖尿病的急性并发症以及感染、病毒性肝炎、饮酒史、严重的心、脑、肝、肾等并发症,并除外妊娠期糖尿病。其中,男性23 例,女性7 例,患者年龄23 ~64 岁,平均年龄44.6 ±9.6 岁;其中8 例为初诊患者,其余22 例均已在用胰岛素或口服降糖药物控制血糖,所有入选病例均完成12 周的观察。
2.研究方法:所有患者入组时均为同一名护士测量身高、体重、血压,并计算体重指数( BMI =体重/身高2) ; 测定谷丙转氨酶( ALT) 、谷草转氨酶( AST) 、谷氨酰转肽酶( GGT) 、血尿酸( SUA) 、总胆固醇( TC) 、甘油三酯( TG) 、低密度脂蛋白胆固醇( LDL-C) 、空腹血糖( FPG) 及餐后2h 血糖( 2hPG) 、糖化血红蛋白( HbA1c) 及尿微量白蛋白排泄率( UAER) ;测定空腹C 肽( FC-P) 、空腹胰岛素( FINS) ,计算稳态模型胰岛素抵抗指数( HOMA-IR =FPG×FINS/22.5) ,所有患者均接受健康教育,适当运动。初诊患者直接予以利拉鲁肽治疗,其余患者停用所有降糖药物( 二甲双胍除外) ,加用利拉鲁肽治疗。利拉鲁肽起始剂量为0.6mg,晚上睡前皮下注射,1 周后增至1.2mg/d,或根据血糖情况调整至1.8mg/d,出院后患者每天自我监测空腹及餐后指尖血糖,其中4 例肝功能异常患者每两周复查肝功能。第1 个月每周门诊随访1 次,第2 个月起每两周门诊随访1 次,并记录低血糖情况以及不良反应。治疗12 周后复查入组时所有指标。
3.统计学方法:所有数据采用SPSS 21.0 软件进行分析,数据采用均数±标准差(±s) 表示,治疗前后比较采用配对t检验,以P <0.05 为差异有统计学意义。
结 果
1.治疗前后血糖、HbA1c、C 肽、胰岛素、胰岛素抵抗指数的变化: 治疗后的FPG、2hPG、HbA1c、HOMA-IR 均有明显下降( P <0.01) ; 而FC -P、FINS水平高于治疗前,但差异无统计学意义( P >0.05,表1) 。
表1 治疗前后血糖、FC-P、FINS、HOMA-IR 的比较(±s)

表1 治疗前后血糖、FC-P、FINS、HOMA-IR 的比较(±s)
与治疗前比较,* P <0.01
时间 FPG( mmol/L) 2hPG( mmol/L) HbA1c ( %) FC-P ( nmol/L) FINS( μIU/ml)HOMA-IR治疗前 11.1 ±1.4 15.5 ±2.0 10.1 ±1.2 0.6 ±0.3 12.7 ±6.8 6.2 ±3.0治疗后 6.8 ±0.7* 10.1 ±1.3* 7.6 ±0.8* 0.7 ±0.2 13.7 ±5.2 4.1 ±1.7*
2.治疗前后体重、BMI、血压以及相关代谢指标的变化:利拉鲁肽治疗后患者的体重、BMI、收缩压( SBP) 、ALT、GGT、TG、TC、LDL-C 均明显下降,差异有统计学意义( P <0.01) ; SUA、AST 也较治疗前改善,差异有统计学意义( P <0.05) ; UAER 较治疗前有所降低,但差异无统计学意义( P >0.05,表2) 。
表2 治疗前后其他指标的比较(±s)
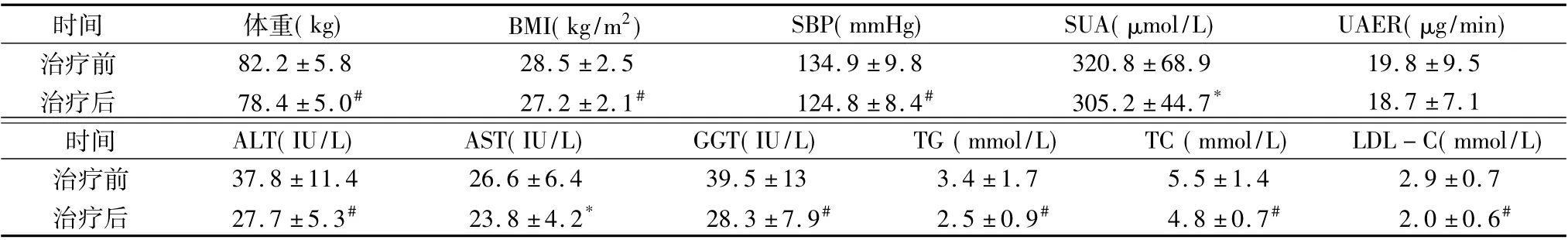
表2 治疗前后其他指标的比较(±s)
与治疗前比较* P <0.05,#P <0.01
时间 体重( kg) BMI( kg/m2) SBP( mmHg) SUA( μmol/L) UAER( μg/min)治疗前 82.2 ±5.8 28.5 ±2.5 134.9 ±9.8 320.8 ±68.9 19.8±9.5治疗后 78.4 ±5.0# 27.2 ±2.1# 124.8 ±8.4# 305.2 ±44.7* 18.7 ±7.1时间 ALT( IU/L) AST( IU/L) GGT( IU/L) TG ( mmol/L) TC ( mmol/L) LDL-C( mmol/L)治疗前 37.8 ±11.4 26.6 ±6.4 39.5 ±13 3.4 ±1.7 5.5 ±1.4 2.9 ±0.7治疗后 27.7 ±5.3# 23.8 ±4.2* 28.3 ±7.9# 2.5 ±0.9# 4.8 ±0.7# 2.0 ±0.6#
3.不良反应:所有患者在治疗过程中均未出现低血糖。不良反应以胃肠道为主,表现为恶心、腹泻和消化不良,共14 例,约占47%,但持续3 ~7 天后可缓解。有1 例发生上呼吸道感染,予以对症治疗后缓解。
讨 论
非酒精性脂肪性肝病是指除外酒精和其他明确的损肝因素所致的肝细胞内脂肪过度沉积为主要特征的临床病理综合征。目前T2DM 合并NAFLD 发生率呈逐年增长的趋势。研究证明T2DM 合并NAFLD患者与血脂代谢紊乱、胰岛素抵抗( IR) 及肥胖等有关,IR 可 能 是NAFLD 发 生、发 展 的 基 础[5]。而NAFLD 也恶化了T2DM 患者的血糖控制,促进糖尿病慢性并发症的发生和进展[6]。T2DM 和NAFLD 之间形成恶性循环,造成糖代谢紊乱和肝病加剧的结局。
传统的降糖方案是胰岛素和口服降糖药,但胰岛素降糖的不利是体重增加,从而导致胰岛素抵抗加重,而口服降糖药则可能导致潜在的肝酶异常,两者都有低血糖的风险。利拉鲁肽是一种人GLP -1 类似物,GLP-1 主要是在糖类的作用下释放入血的,能促进胰岛β 细胞增殖分化,刺激胰岛素的合成与分泌,抑制胰高血糖素的分泌,同时抑制食欲、延缓胃排空、减轻体重等。傅晓莹等[7]研究显示单用利拉鲁肽或联合二甲双胍治疗2 型糖尿病12 周后,无论是FPG、2hPG 还是HbA1c 均明显下降( P <0.05) 。本研究同样也显示应用利拉鲁肽治疗T2DM 合并NAFLD 患者后的FPG、2hPG、HbA1c、HOMA -IR 均较治疗前有明显下降。
众多临床研究都证实了利拉鲁肽能减轻T2DM患者的体重[8]。国内基础研究也显示,建立高脂饮食诱发大鼠NAFLD 模型,GLP -1 治疗4 周体重下降平均可达10.88%[9]。而美国《非酒精性脂肪性肝病诊断和处理实践指南》中提出体重下降3% ~5%以上就可减轻肝脂肪变。本研究观察到利拉鲁肽能有效减轻体重平均为3.8kg( 达4.6%) 。
荟萃分析显示,利拉鲁肽治疗26 周,可降低收缩压,降低LDL -C、游离脂肪酸、TG 水平。利拉鲁肽的降压作用独立于同期服用的降压药物[10]。GLP -1 是一种葡萄糖依赖性肠促胰素,可通过增加脂肪酸氧化,改善肝脏的脂肪病变及氧应激,对非酒精性脂肪肝起到明显的改善作用[11]。GLP -1 调脂的机制可能是通过增加肝脏ApoE 蛋白的表达或上调脂联素水平,显著降低TG、TC 水平,减少LDL - C 的合成[12]。本研究同样也发现利拉鲁肽能显著降低SBP、TG、TC、LDL -C,从而改善T2DM 合并NAFLD患者的脂代谢紊乱。有研究显示,合并NAFLD 的T2DM 患者SUA 和UAER 明显高于无NAFLD 患者,是T2DM 合并NAFLD 的独立危险因素[13,14]。本研究结果提示利拉鲁肽能降低SUA 和UAER,从而降低T2DM 患者发生NAFLD 的风险。本研究还表明利拉鲁肽能降低T2DM 合并NAFLD 患者的ALT、AST、GGT,这与之前的研究是一致的[7]。由于利拉鲁肽是葡萄糖浓度依赖的方式降低血糖,血糖较高时GLP-1 发挥降糖作用,而血糖正常时,则不再进一步降糖,即患者血糖越高时降糖效果越理想,低血糖发生率低。本研究中使用利拉鲁肽降糖后无低血糖发生。通常利拉鲁肽常见的不良反应是以胃肠道为主,表现为恶心、腹泻和消化不良,大多数患者为一过性,可自行缓解[15]。本研究对象胃肠道症状均能在数天后缓解。由此可见,使用利拉鲁肽降糖具有良好的安全性。
综上所述,利拉鲁肽不但可以安全有效地降低血糖,还同时降低血压、减轻体重、改善胰岛素抵抗,尤其适合2 型糖尿病合并非酒精性脂肪肝患者,降低肝酶、血脂,减轻肝脏的脂肪负荷。
1 Hirst M. Diabetes in 2013. The new figures[J]. Diabetes Res Clin-Pract,2013,102:265
2 中华医学会糖尿病学分会. 中国2 型糖尿病防治指南( 2013 年版) [J].中华糖尿病杂志,2014,(07) :447 -498
3 Vernon G,Baranova A,Younossi ZM.Systematic review: the epidemiology and natural history of non-alcoholic fatty liver disease and non- alcoholic steatohepatitis in adults[J]. Aliment Pharmacol Ther,2011,34:274 -285
4 中华医学会肝病学分会脂肪肝和酒精性肝病学组.中国非酒精性脂肪性肝病诊疗指南( 2010 年修订版) [J].中国医学前沿杂志:电子版,2012,(7) :4 -10
5 王凯军,苏湖梅.2 型糖尿病患者非酒精性脂肪肝的临床及代谢特点分析[J].中国医师杂志,2012,14(2) :212 -214
6 Gariani K,Philippe J,Jornayv az FR. Non - alcoholic fatty liver disease and insulin resistance: from bench to bedside[J]. Diabetes Metab,2013,39(1) :16 -26
7 傅晓莹,杨华章.利拉鲁肽治疗2 型糖尿病的疗效及安全性[J].广东医学,2013,34(23) ;3651 -3653
8 Dharmalingam M,Sriram U,Baruah MP. Liraglutide: A review of its therapeutic use as a once daily GLP-1 analog for the management of type 2 diabetes mellitus[J].Indian J Endocrinol Metab,2011,15:9 -17
9 关丽嫦,徐丽姝.利拉鲁肽对非酒精性脂肪肝大鼠模型生化及炎症指标的影响[J].实用医学杂志,2013,29(14) ;2270 -2272
10 Fonseca V,Plutzky J,Montanya E,et al.Liraglutide,a once-daily human GLP-1 analog,lowers systolic blood pressure( SBP) independently of concomitant antihypertensive treatment[J].Diabetes,2010,59( suppl 1) :296 -PO
11 Svegliati - Baroni G,Saccomanno S,Rychlicki C,et al. Glucagon -like peptide -1 receptor activation stimulates hepatic lipid oxidation and restores hepatic signalling alteration induced by a high-fat diet in nonalcoholic steatohepatitis[J].Liver Int,2011,31(9) :1285 -1297
12 李龙辉,李伶,杨刚毅,等.利拉鲁肽对低脂联素血症小鼠胆固醇代谢相关基因的影响[J].中华内分泌代谢杂志,2011,27( 7) :10-11
13 李明珍,郝久营,孙丽荣.2 型糖尿病患者血尿酸水平与非酒精性脂肪肝的相关性研究[J].中华内分泌代谢杂志,2012,28(3) :215-216
14 张育仁,吴静,李春燕.2 型糖尿病患者非酒精性脂肪肝与尿蛋白排泄率的关系[J].中华临床医师杂志:电子版,2012,6(15) :4225-4228
15 Buse JB,Rosenstock J,Sesti G,et al.Liraglutide once a day versus exenatide twice a day for type 2 diabetes:a 26 -week randomised,parallel-group,multinational,open -label trial( LEAD -6) [J]. Lancet,2009,374(9683) :39 -47
