实时荧光定量PCR检测血流感染常见病原菌的临床应用
2015-01-13井发红慕玉东李敬梅西安医学院第一附属医院检验科西安70077陕西省肿瘤医院检验科通讯作者mailkttw008com
井发红,慕玉东,辛 娜,李敬梅,康 炜(西安医学院第一附属医院检验科,西安 70077;陕西省肿瘤医院检验科;通讯作者,E-mail:kttw008@6.com)
成人和儿童菌血症都是高发病率和高死亡率的疾病,每年世界范围内菌血症患者有2 000万例[1]。因病原菌不能鉴定而应用广谱抗生素或不适当抗生素治疗所导致的死亡率非常高,美国血流感染的总体病死率可高达14%-63%,但在明确病原菌后采用针对性治疗,其死亡率可降至5%-17%[2-4],因此及时快速诊断病原菌对合理用药、缩短疗程等具有重要意义。迄今为止,血培养仍然是诊断血流感染的金标准[5],它不仅可以检测血液中有无病原菌,还可对分离出的病原菌进行药敏试验,因此血培养对血流感染的诊治具有重要意义。然而,血培养一般至少需要3-5 d的时间,且易受标本质量、标本中病原体数量、培养条件以及抗生素治疗等多种因素的影响,阳性率较低;同时,有些病原体虽能被培养出,但应用传统的方法很难对其进行鉴定,这些远远不能满足临床对血流感染快速诊断和治疗的需要[6]。近年来,分子生物学和基因诊断技术的不断发展为血流感染的检测提供了新的思路。病原菌的基因组较生化指标稳定,通过基因扩增及其后续技术可以快速、准确地检测病原菌。本研究主要构建熔解曲线分析法,并进行特异性验证。检测不同拷贝浓度稀释液进行敏感性分析。利用绝对定量法测定血液及穿刺引流液中鲍曼不动杆菌、肺炎克雷伯菌和表皮葡萄球菌的含量。
1 材料与方法
1.1 检测菌种与PCR扩增靶基因的确定
本研究选择的标准菌株鲍曼不动杆菌(Acinetobacter baumannii A601)、肺炎克雷伯菌(Klebsiella pneumoniae ATCC700603)、表皮葡萄球菌(Staphylococcus epidermidis ATCC 8558)由卫生部临床检验中心提供。针对鲍曼不动杆菌的ITS、肺炎克雷伯菌的phoE和表皮葡萄球菌的gseA基因作为PCR扩增的靶基因。
1.2 引物设计
分别对靶基因序列使用Primer Primer5.0软件设计引物,经BLAST比对选择特异性较高引物,引物均由上海生物工程技术有限公司合成。实验中PCR扩增所用靶基因、引物序列、产物大小和退火温度(见表1)。

表1 实验中PCR扩增所用引物Table 1 Primers for PCR amplification
1.3 主要试剂与仪器
PCR反应试剂(包括Taq酶及缓冲液,MgCl2、dNTP)以及DL1000 DNA Marker和pMD®18-T载体均为大连TaKaRa产品,细菌基因组DNA提取试剂盒、质粒小提试剂盒(离心柱型)和感受态DH5a均为北京天根产品,SanPrep柱式PCR产物纯化试剂盒为上海生工产品。SYBR Green Realtime PCR Master Mix是日本TOYOBO产品。CFX96 TM realtime定量PCR系统:美国Bio-rad产品;PCR扩增仪(GeneAmp PCR System 2720)为美国ABI产品;电泳仪(DYY6C)为北京六一产品;紫外凝胶成像系统(Ingenius LHR SYSTEM,200V)为英国 Syngene产品;NanoPhotometerTM为德国IMPLEN产品。
1.4 细菌基因组DNA的提取与扩增产物纯化
细菌基因组DNA的提取:应用“天根细菌基因组DNA提取试剂盒”提取经纯培养后的标准菌株的基因组DNA,用琼脂糖凝胶电泳分析DNA大小。
扩增产物纯化:用上海生工“SanPrep柱式PCR产物纯化试剂盒”对扩增产物进行纯化,具体步骤按试剂盒说明书进行。
质粒的提取:将DNA片段与pMD18-T载体的连接,然后将连接体转化到感受态细菌DH5a上,进行蓝白斑筛选挑取培养板上白色单菌落过夜培养待培养液明显浑浊后准备提取质粒,应用天根“TIAN-prep Mini Plasmid Kit”进行质粒提取,具体步骤按试剂盒说明书进行。取增菌后的菌液1 ml,由上海生工生物工程有限公司进行测序鉴定。
1.5 引物的特异性验证
对上述引物用标准菌株进行常规PCR扩增,同时设置阳性对照与阴性对照。常规PCR反应的总体积为 50 μl,其中 10 × Buffer 5 μl,25 mol/L 的MgCl24 μl,2.5 mol/L 的 dNTP 4 μl,5 U/μl Taq 酶0.2 μl,上、下游引物各 1 μl,模板 DNA 4 μl,灭菌超纯水30.8 ml。反应条件为95℃预变性5 min;95℃变性30 s;56℃退火30 s;72℃延伸30 s,30个循环;最后72℃延伸7 min。PCR扩增产物用2%琼脂糖凝胶电泳检测,电泳的电压为6 V/cm,采用溴化乙锭(EB)染色20 min,拍照保存。
1.6 标准曲线的制作
用NanoPhotometerTM微量核酸/蛋白检测仪测定所提重组质粒浓度(ng/μl),利用 Avogadro’s常数(1 mol溶液大约有6.022 141 5×1023拷贝数)计算出溶液中质粒拷贝数,为制作标准品原液。将原液进行倍比稀释,对倍比稀释液进行熔解曲线分析法实验。
1.7 实时荧光定量PCR反应体系与反应条件
用鲍曼不动杆菌、肺炎克雷伯菌和表皮葡萄球菌这三种特异性引物分别进行熔解曲线分析法实验。20 μl反应体系包括SYBR Green Realtime PCR Mix 10 μl,10 μmol/L 的上、下游引物各 0.8 μl,DNA 模板 2 μl,灭菌超纯水 6.4 μl。反应条件为:95℃预变性5 min;95℃变性10 s;60℃退火15 s;72℃延伸45 s,40个循环;于60℃15 s后采集荧光信号,熔解曲线分析条件为65℃ 10 s,0.5℃/s升温至95℃并收集荧光信号。通过软件得到绝对定量的标准曲线(standard curve)、熔解曲线(melt curve)的Ct值、对数浓度值等数据。
1.8 实时荧光定量PCR对临床标本的检测
用构建好的熔解曲线法检测血液及穿刺引流液中鲍曼不动杆菌、肺炎克雷伯菌、表皮葡萄球菌的含量。
2 结果
2.1 引物特异性的验证
菌种特异性引物扩增标准菌株,可见其PCR扩增产物与预期DNA片段大小吻合(见图1):鲍曼不动杆菌208 bp,肺炎克雷伯菌142 bp,表皮葡萄球菌194 bp,且扩增条带亮度较高,反映引物特异性较好,阴性对照无污染。
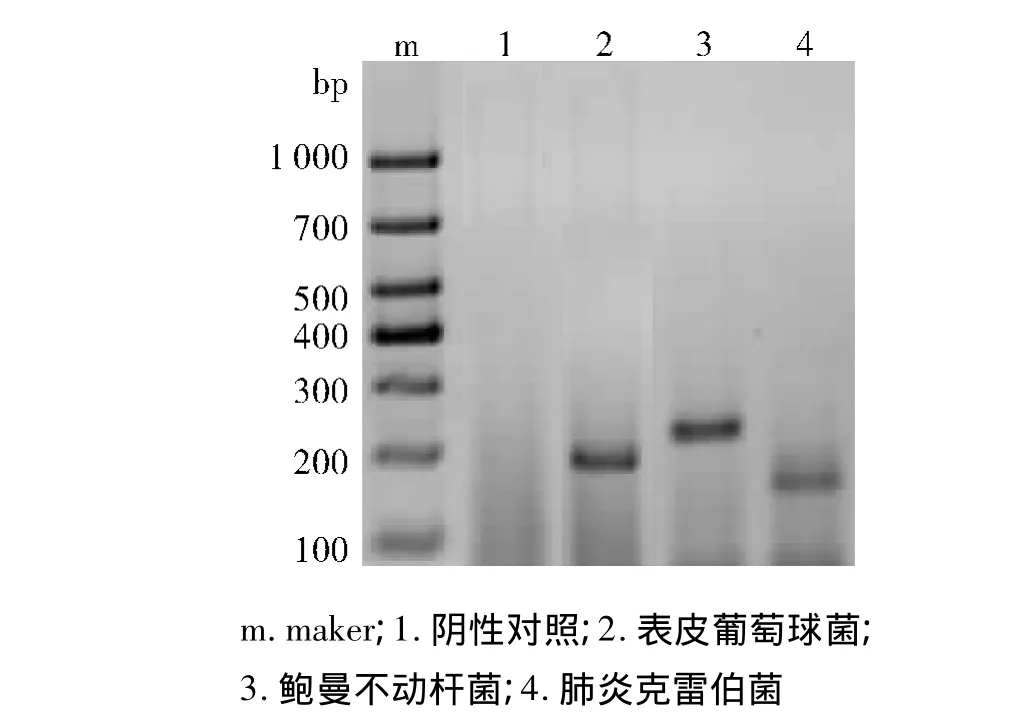
图1 特异性引物扩增结果Figure 1 PCR results of specific primers
2.2 标准曲线绘制结果
以肺炎克雷伯菌为例,将标准品原液按10倍倍比稀释后做定量 PCR,得到5.80×108-5.80×103个拷贝的模板循环数与荧光强度的扩增曲线,从图2中可以看到扩增曲线间距基本对等,与倍比稀释的模板吻合。以各倍比稀释拷贝数的对数为横轴,反应过程中达到荧光阈值的初始循环数(Ct)为纵轴,得到检测该菌的标准曲线(图3),该曲线是检测样本的参照标准,参数为:E=88.7%,R=0.986,Slope=-3.625,熔解曲线分析为单峰,说明扩增产物单一,无非特异性扩增,排除反应过程中假阳性结果的出现,熔解温度为88.5℃(见图4,5)。
2.3 实时荧光定量PCR结果
定量分析血液标本和穿刺引流液标本中结果表明:三种菌在临床血液标本中的含量在103-107copy/ml之间,在穿刺引流液标本中含量为104-108copy/ml(见表2)。
3 讨论
实时荧光定量PCR正在快速地替代传统的微生物检测方法。该技术在封闭的反应管中将PCR反应与产物分析过程一次完成,并能自动进行实时动态监测和数据分析,大大减少了交叉污染的几率,操作简单、检测速度快、定量精确、敏感度高且重复性好。
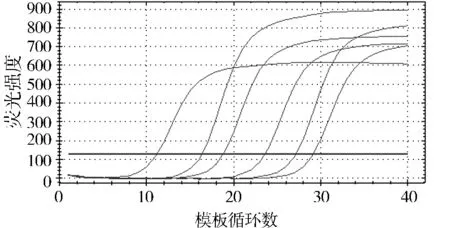
图2 肺炎克雷伯菌标准品扩增曲线Figure 2 Standard amplification curve of Klebsiella pneumoniae
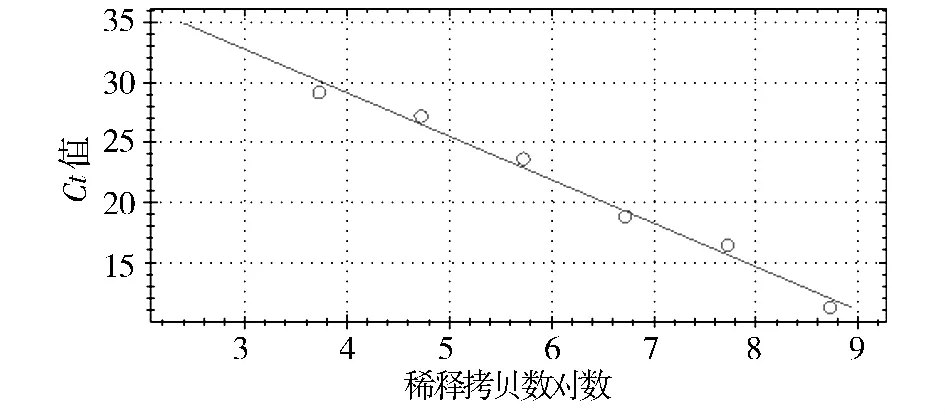
图3 肺炎克雷伯菌标准曲线Figure 3 Standard curve of Klebsiella pneumoniae
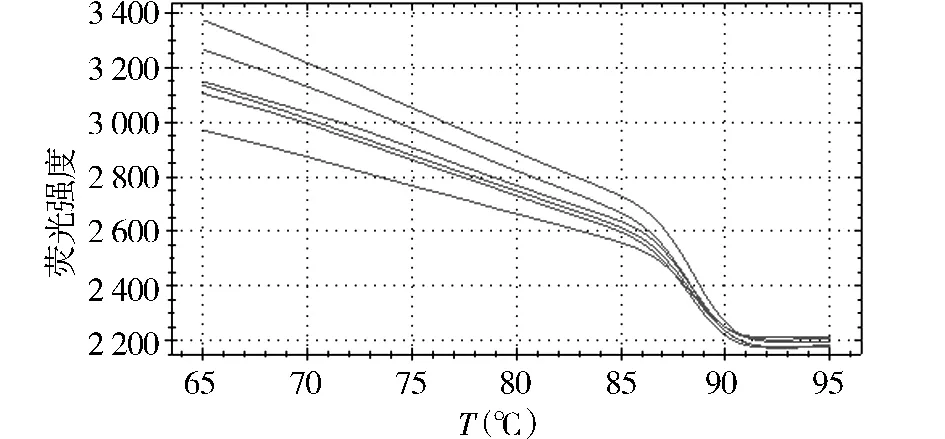
图4 肺炎克雷伯菌熔解曲线Figure 4 Melting curve of Klebsiella pneumoniae
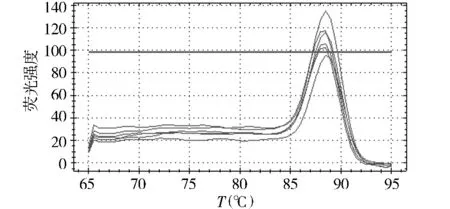
图5 肺炎克雷伯菌熔解峰图Figure 5 Peak melting curve of Klebsiella pneumoniae

表2 标本中表皮葡萄球菌、肺炎克雷伯菌、鲍曼不动杆菌定量结果 (copy/ml)Table 2 The quantitative RT-PCR results of Staphylococcus epidermidis,Klebsiella pneumoniae Acinetobacter baumannii(copy/ml)
目前,应用于血流感染的分子定量测定方法较少,而培养方法计算的CFU只能代表在平板接种过程中存活下来的活的微生物而不能计数死细胞、不能形成菌落的细胞以及从破碎细胞中释放出来的游离微生物DNA。因此,人们对血流感染病人血中病原菌DNA的真正含量知之甚少。
许多败血症病人被收治到ICU中进行靶抗生素治疗可以极大地减少死亡率。一份来自美国和加拿大15个ICU的2 600多病例的研究表明,从败血症休克开始到有效地抗生素应用前,败血症的死亡危险率每小时增加6%-10%[7]。不幸的是,目前实验室鉴定和分型血流感染病原菌的方法太慢,得到培养及药敏结果所需时间长,不能为临床提供及时的参考;而且,由于前期经验性广谱抗生素大量应用、血中微生物含量低等原因,使得败血症病人的血培养往往呈现假阴性。据报道,脑膜炎球菌在未经抗生素治疗前,从血培养检出率可达50%,而在经过抗生素治疗后的患者检出率不足5%[8]。抗生素的大量应用不仅导致培养阳性率低,而且增加花费,还可能导致病人抗生素中毒,并可能促进微生物耐药性的发生。
本实验应用实时荧光定量PCR方法对血流及穿刺引流液中的鲍曼不动杆菌、肺炎克雷伯菌、表皮葡萄球菌进行定量分析,结果显示qRT-PCR方法可准确、敏感地检测临床标本中的细菌含量。实验中采用SYBR Green荧光染料的方法,该染料可以与DNA非特异性结合,为排除PCR反应过程中可能形成的非特异性扩增和引物二聚体等对实验结果的影响,我们不断优化反应体系和程序,并设定熔解曲线,提高实验结果的可靠性。同时,为了准确定量,我们选择了绝对定量的实验方案,目的是得到临床标本中细菌的绝对拷贝数。首先分别从标本中和标准菌株中扩增目的基因来制作定量标准品和标准曲线,结果发现直接从标本中扩增目的基因来制作标准品的方法符合定量PCR实验的要求,特异性高、浓度稳定、无非特异性片段等,因而可以作为实验的标准品。完成三种细菌标准品和标准曲线的制作后,分别检测了各菌在临床标本中的含量。本实验结果表明血流细菌含量在103-107copy/ml之间,穿刺引流液中细菌含量在104-108copy/ml之间;引流液中的细菌含量比血液中要高。本部分实验为阐明菌量与感染的关系以及抗生素的应用对血流中细菌量的影响奠定了基础。
[1]Zaidi AK,Thaver D,A1i SA,et al.Palhogens associated wilh sepsis in newborns and young infants in developing countries[J].Pediatr Infect Dis J,2009,28(Suppl1):10-18.
[2]Rangel-Frwusto MS.The epiderriology of bacterial Sepsis[J].Infect Dis Clin North Am,1999,13(2):299-303.
[3]Weinstein MP,Towns ML,Quartey SM,et al.The clinical significance of positive blood cultures in the 1990s:a prospective comprehensive evaluation of the microbiology,epidemiology,and outcome of bactefemia and fungemiaia in adults[J].Clin Infect Dis,1997,24(4):584-602.
[4]Zarrouk V,Habibi A,Zahar JR,et al.Blood stream infection in adults with sickle cell disease:association with venous catheters,Staphylococcus aureus,and bone-joint infections[J].Medicine(Baltimore),2006,85(1):43-48.
[5]Magadia RR,Weinstein MP.Laboratory diagnosis of bacteremia and fungemia[J].Infect Dis Clin North Am,2001,15(4):1009-1024.
[6]周庭银,倪语星,王明贵.血流感染实验诊断与临床诊治[M].上海:上海科学技术出版社,2011:41-42,108-109,120-121.
[7]Kumar A,Roberts D,Wood KE,et al.Duration of hypotension before initiation of effective antimicrobial therapy is the critical determinant of survival in human septic shock[J].Crit Care Med,2006,34(6):1589-1596.
[8]Newcombe J,Cartwright K,Palmer WH,et al.PCR of peripheral blood for diagnosis of meningococcal disease[J].J Clin Microbiol,1996,34(7):1637-1640.
