人参皂苷Rg1 减轻脂多糖诱导的小鼠急性肺损伤的作用机制研究
2015-01-13张天柱杨世海代文意吴国梁
张天柱, 杨世海, 代文意, 吴国梁
(1. 长春中医药大学,吉林 长春130117;2. 吉林农业大学,吉林 长春130117)
急性肺损伤(ALI)是以肺血管内皮细胞及肺泡上皮细胞广泛损伤为病理特征的一种失控的炎症反应[1]。近年来,ALI/急性呼吸窘迫综合征 (ARDS)越来越受到重视[2]。国内发病率和病死率达20% ~40%,尤其ICU 病房中达到50%左右,目前没有效治疗手段[3]。有报道发现,有40%的脓毒症患者伴发ALI/ARDS[4];革兰氏阴性细菌是脓毒症的重要致病因子,其细胞壁的脂多糖(LPS)可通过多种途径导致ALI[5-6]。ALI/ARDS 是脓毒症患者死亡的主要原因。对ALI /ARDS 发病机制的大量研究表明炎症反应在其发病过程中起重要作用[7-9]。因此,寻找有效药物治疗LPS 诱导ALI 对脓毒症的治疗具有重要临床意义。
人参皂苷Rg1(ginsenoside Rg1)是人参、三七等药材主要有效成分之一,如促进血管生成与组织再生,治疗老年痴呆,对抗缺血再灌注损伤及神经保护作用等[10-11]。及抗肿瘤抗衰老雌激素样作用免疫调节调节糖代谢等[12-15]。目前对人参皂苷Rg1抗炎和镇痛作用研究较少,尤其对于急性肺损伤作用报道鲜见,本研究重点探讨人参皂苷Rg1对脂多糖诱导的急性肺损伤的保护作用的机制。
1 材料与方法
1.1 动物 清洁级BABL/C 小鼠,雄性,6 ~8 周龄,体质量21 ~23 g,小鼠分笼饲养,自由饮水进食,中国药科大学动物中心提供,动物批准文号SCXK (苏)20070001。
1.2 药品与试剂 人参皂苷Rg1(批号110703-201326)购自中国食品药品检定研究院;LPS (L2880,大肠杆菌055 类型B5)购自Sigma 公司;IL-6 (批号20130527)、IL-1 β (批号20131112)、TNF-α (批号20130401)购自南京建成生物有限公司;NF-кBp65 (4764s)、COX-2 (4842s)抗体购自CST 公司。
1.3 实验分组及模型建立 将雄性BALB/c 小鼠50 只随机分为5 组,每组10 只,即对照组(control)、LPS 组、地塞米松组 (Dex,2 mg/kg)、人参皂苷Rg1(10 mg/kg)组、人参皂苷Rg1(20 mg/kg)组。分别以双蒸水(0.1 mL/10 g)、双蒸水(0.1 mL/10 g)、地塞米松(2 mg/kg)、Rg1(10 mg/kg,0.1 mL/10 g)、Rg1(20 mg/kg,0.1 mL/10 g)灌胃,每日1 次,连续3 d 给药。第3 天灌胃后1 h,腹腔注射生理盐水(0.1 mL/10 g)或LPS (10 mg/kg,0.1 mL/10 g),6 h 后处死,取血清冻存,肺组织置4%甲醛溶液中,用于HE 染色,其余肺组织-80 ℃冻存,以便用于Westen blot 检测。
1.4 病理学检查 腹腔注射生理盐水或LPS 后6 h 处死小鼠,切取左肺,以4%的甲醛固定,常规石蜡包埋,切片及常规HE 染色,光镜下观察肺组织病理学改变。
1.5 肺泡灌洗液炎症因子(IL-6、IL-1β、TNF-α)检测取已处死动物,打开胸腔,结扎左支气管肺门部;分离气管,于气管环状软骨下方剪一V 型切口,插入前端磨平的2.5 mL 注射器针头,结扎固定,以1.5 mL 生理盐水分3次灌洗,每次0.5 mL。取一滴灌洗液至血细胞计数池中,静置后显微镜下读白细胞总数。1 000 r/min 室温下离心10 min,吸出上清液,按照IL-6、IL-1β、TNF-α 试剂盒说明书进行检测。
1.6 Western blot 检测 将肝组织置于冰冷的裂解液收集裂解物总蛋白,组织蛋白行SDS-PAGE 并转印至PVDF 膜;室温封闭2 h,分别与NF-кBp65 和COX-2 一抗孵育,膜经漂洗后再与辣根过氧化物酶偶联的二抗反应,增强化学发光法(ECL)发光试剂显影,灰度成像软件(UVP,UK)测定主带的光密度值以计算NF-кB p65 和COX-2 蛋白表达水平。
2 结果
2.1 人参皂苷Rg1对急性肺损伤小鼠血液SOD、MDA 的影响 与空白组相比,急性肺损伤模型组的血清的SOD 水平显著降低、MDA 水平显著增加,给予人参皂苷Rg1治疗后血清SOD 显著升高,MDA 显著降低(图1)。

图1 人参皂苷Rg1 对急性肺损伤小鼠血液SOD、MDA 的影响
2.2 人参皂苷Rg1对急性肺损伤小鼠肺泡灌洗液炎症因子(IL-6、IL-1β、TNF-α)的影响 与空白组相比,急性肺损伤模型组的肺泡灌洗液炎症因子(IL-6、IL-1β、TNF-α)水平显著增加,给予人参皂苷Rg1治疗后肺泡灌洗液炎症因子(IL-6、IL-1β、TNF-α)显著降低(图2)。
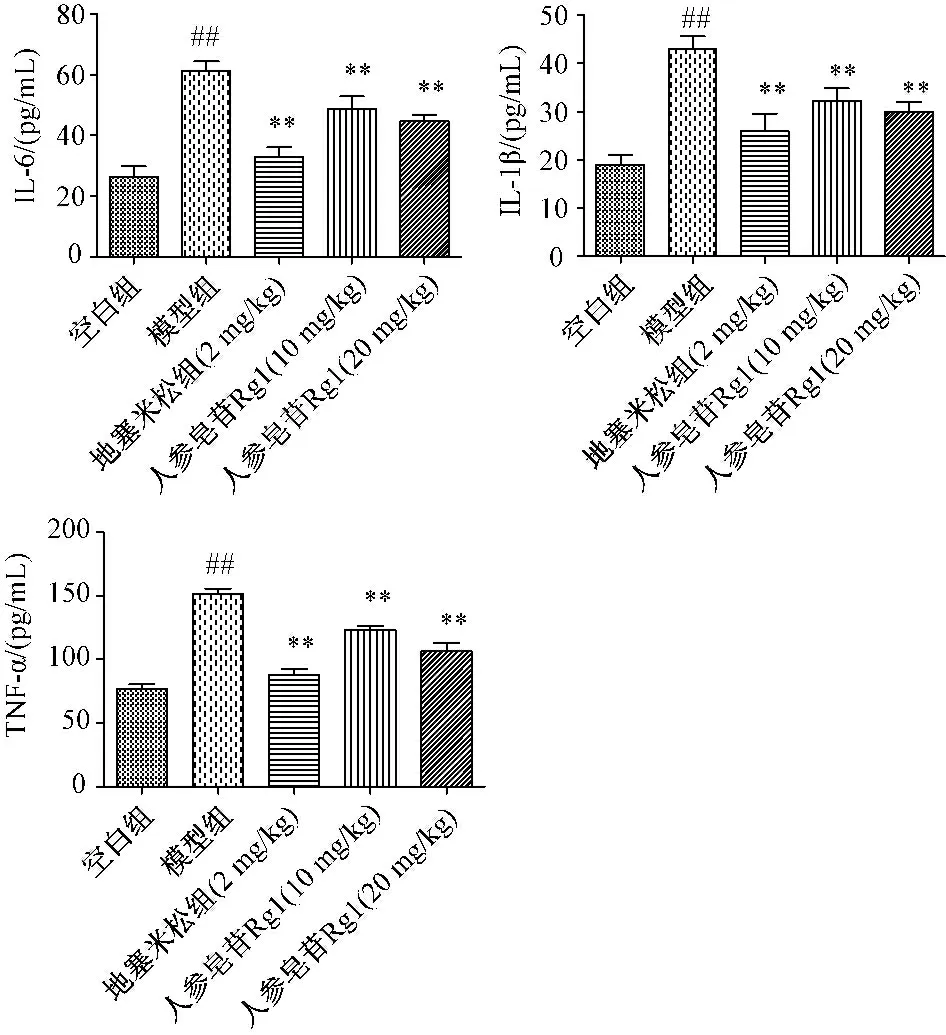
图2 人参皂苷Rg1 对急性肺损伤小鼠肺泡灌洗液炎症因子(IL-6、IL-1β、TNF-α)的影响
2.3 气道病理学检测 空白组肺部被覆上皮完整,未见明显坏死、脱落,固有层及黏膜下层中未见充血、水肿及炎细胞浸润,外膜可见完好的透明软骨支架。模型组可见肺部中度炎细胞浸润,主要包括中性细胞,淋巴细胞、巨噬细胞及少量浆细胞。较之模型组,各给药组病变都有减轻趋势,见图3。
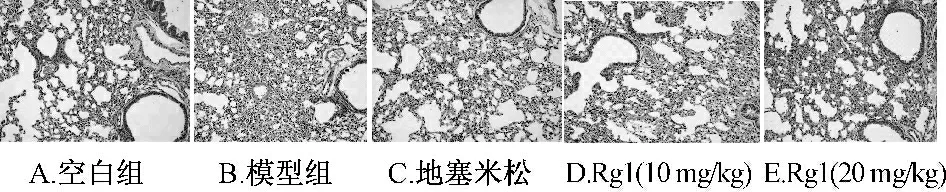
图3 人参皂苷Rg1 显著改善LPS 诱导的肺损伤小鼠的肺部病理学变化(×200)
2.4 人参皂苷Rg1对急性肺损伤小鼠肺NF-кBp65 和COX-2 的影响 与空白组相比,急性肺损伤模型组的NF-кBp65和COX-2 显著增加,给予Rg1治疗后肺NF-кBp65 和COX-2显著降低(图4)。
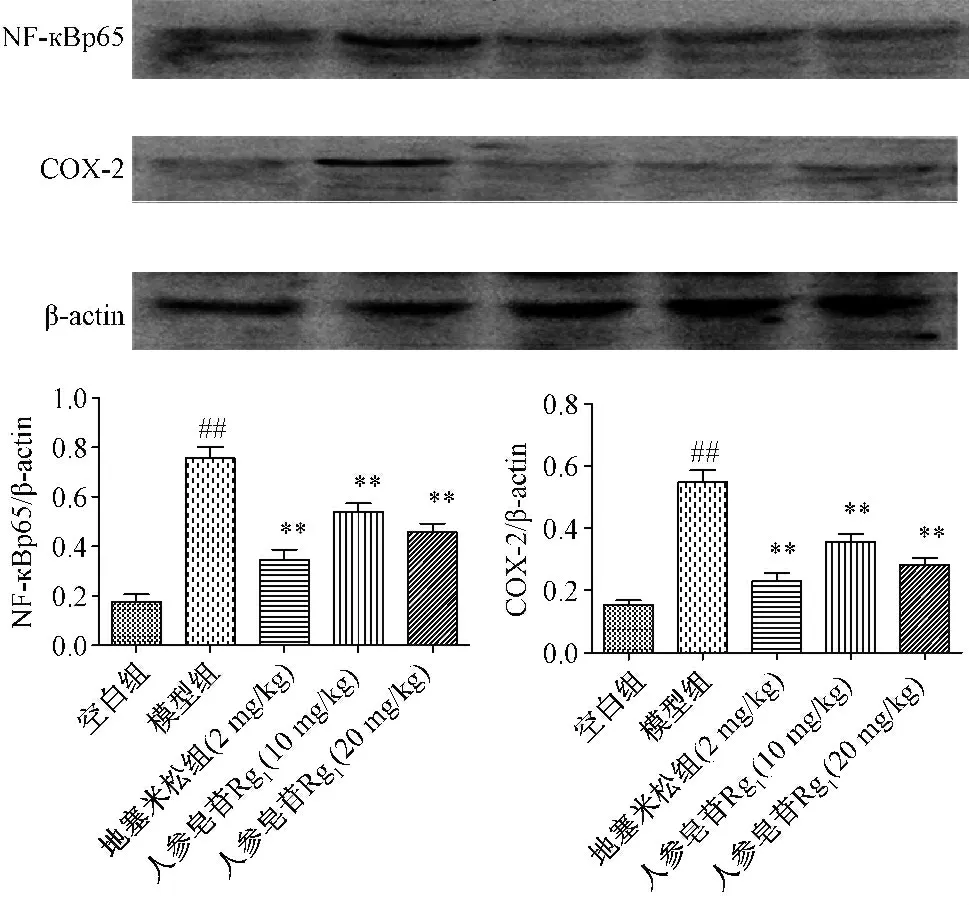
图4 人参皂苷Rg1 对急性肺损伤小鼠肺NF-кBp65 和COX-2 的影响
3 讨论
ALI 是以中性粒细胞浸润的炎症反应微血管和肺泡上皮弥漫性损伤肺水肿及肺间质纤维化等为病理特征的一种临床综合征,严重者即为ARDS,可由创伤肺炎和脓毒症等引起。本实验利用脂多糖建立急性肺损伤模型来评价Rg1抗肺损伤药理机制,发现Rg1能显著降低肺损伤小鼠肺泡灌洗液中的炎症因子,能显著降低血清中MDA 水平,提高SOD 水平,并能抑制肺部NF-кBp65 和COX-2 蛋白表达,提示Rg1可能通过调节NF-кBp65 和COX-2 蛋白表达来保护脂多糖诱导的急性肺损伤。
[1] 钱桂生. 急性肺损伤和急性呼吸窘迫综合征研究现状与展望[J]. 解放军医学杂志,2003,28(2):97-101.
[2] 中华医学会重症医学分会. 急性肺损伤/急性呼吸窘迫综合征诊断与治疗指南(2006)[J]. 中华内科杂志,2007,46(5):430-434.
[3] 蔡栩栩. 败血症性急性肺损伤的研究现状[J]. 小儿急救医学,2000,7(3):159-160.
[4] Hudson L D,Milberg J A,Anardi D,et al. Clinical risks for development of the acute respiratory distress syndrome[J]. Am J Respir Crit Care Med,1995,151(2Pt 1):293-301.
[5] Chen H,Bai C,Wang X. The value of the lipopolysaccharideinduced acute lung injury model inrespiratory medicine[J]. Expert Rev Respir Med,2010,4(6):773-783.
[6] 冯英凯,杨庆华,钱桂生,等. 炎症介质与内毒素肺损伤[J]. 国外医学:呼吸系统分册,2004,24(5):329-335.
[7] Matsud A N,Hattor I Y,Jesmin S,et al. Nuclearfactor-kappa B decoy oligodeoxynucleotides prevent acute lunginjury in mice with cecal ligation and puncture-induced sepsis[J]. Mol Pharmacol,2005,67(4):1018-1025.
[8] Christman J W,Lancastwr L H,Blackwell T S. Nuclear factor kappa B:a pivotal role in the systemic inflammatory response syndrome and new target for therapy[J]. Intensive Care Med,1998,24(11):1131-1138.
[9] Idell S. Coagulation,fibrinolysis,and fibrin deposition in acute lung injury[J]. Critical Care Med,2003,31(4 Suppl):S213-S220.
[10] 安 明,赵国君,韦新成. 人参皂苷Rg1保护心血管和中枢神经系统的药理活性研究进展[J]. 中国临床药理学杂志,2012,28(1):75-77.
[11] 李文娜,肖 苑,黄燮南. 人参皂苷Rg1非心血管和神经系统药理活性研究进展[J]. 中国药理学通报,2012,28(6):751-754.
[12] 商 义,张才全. 人参皂苷Rgl对体外人胃癌细胞增殖的抑制作用及机制[J]. 中国细胞生物学学报,2011,33(3):269-274.
[13] 王红丽,吴 铁,吴志华. 人参皂甙抗皮肤衰老作用实验研究[J]. 广东药学院学报,2003,19(1):25-27.
[14] Kim S J,Yuan H D,Chuan S H. Ginsenoside Rg1suppresses hepatic glucose production via AMP-activated protein kinase in hepG2 cells[J]. Biol pharmbull,2010,33(2):325-328.
[15] Xie X S,Yang M,Liu H C,et al. Influence of ginsenoside Rg1,a panaxatriol saponin from Panax notoginseng,on renal fibrosis in rats with unilateral ureteral obstruction[J]. J Zhejiang Univ Sci B,2008,9(11):885-894.
