中药纳米制剂在脑部疾病治疗中的应用
2015-01-13王璐婷奉建芳胡凯莉
王璐婷, 奉建芳 , 胡凯莉
(上海中医药大学穆拉德中药现代化研究中心,上海201203)
近年来,中枢神经系统(central nervous system,CNS),特别是脑部肿瘤和神经退行性疾病的发病率及死亡率持续上升。血脑屏障(blood-brain barrier,BBB)是机体参与固有免疫的内部屏障之一,一方面,对维系脑的稳态起重要作用,保护脑免受病原生物、毒性分子甚至机体自身免疫系统等的侵扰;另一方面,也阻碍了98%以上治疗药物的进入,限制了药物从血液向脑内转运,成为脑病治疗中难以逾越的障碍[1-2]。中医古籍记载,有很多能循经入脑的中药,也是中医治疗脑病的常用药,尤其是一些难治疗、成因不确切的脑部疾病,中药的多因素、多靶点特色更有利于疾病的治疗。然而,这些用于治疗脑部疾病的中药有效成分透过血脑屏障的能力仍有限,极大限制了其疗效的进一步发挥和应用。因此,如何提高血脑屏障透过性,对提高中药在脑部疾病治疗领域中的应用具有非常重要的意义。目前,纳米制剂因其具有缓释性、靶向性等优点,成为近年来药物制剂领域中研究的热点,而中药纳米制剂也得到了国内外科研工作者的广泛关注[3-5]。中药有效成分经纳米系统包载或表面靶向修饰,可通过提高药物的稳定性和长循环特性,或利用靶向分子促进药物透过血脑屏障,用于提高药物的脑内浓度[6-7]和多种脑部疾病的治疗效果。本文以聚合物纳米粒、固体脂质纳米粒、脂质体、胶束和纳米混悬剂等中药纳米制剂为代表,探讨中药纳米制剂在脑胶质瘤、脑缺血再灌注损伤和阿尔茨海默症等疾病治疗方面的应用,对其在脑部疾病治疗方面的最新研究进展作一综述。
1 血脑屏障
血脑屏障是哺乳动物中枢神经系统特有的防御机构,脑组织内的脑毛细血管内皮细胞(brain microvascular endothelial cells,BMEC)紧密相连,且毛细血管外表面几乎均被星形胶质细胞(astrocyte,AC)和周细胞包围,这种特殊结构形成了保护大脑的生理屏障[8],见图1。然而,它在阻挡有毒物质从血液进入脑组织和脑脊液内,保护中枢神经系统免受侵害的同时,也阻碍了药物进入,严重影响了治疗脑部疾病药物疗效的发挥。药物通过血脑屏障的机制(见图2)主要有[9-10]: (1)通过吸附或受体介导的包吞作用跨脑血管内皮细胞入脑;(2)脂溶性药物通过吸附于脑毛细血管壁,被动扩散跨过脑血管内皮细胞入脑;(3)部分水溶性小分子药物可通过细胞旁通路被动扩散入脑;(4)氨基酸和葡萄糖等可通过脑毛细血管内皮细胞上的特定载体转运入脑。纳米制剂可通过延长药物在毛细血管壁的滞留时间及提高血管内外药物的浓度梯度,促进药物被动扩散入脑。其中,某些表面活性剂可提高血管内皮细胞膜脂质的溶解度,使流动性增加,提高血脑屏障对药物的通透性;另一些表面活性剂(如聚山梨酯-80)能抑制外排泵(如P-糖蛋白)的外排作用,从而增加药物的入脑。此外,通过在纳米制剂表面接枝不同的配体,以及借助受体和吸附介导的胞吞转运,促进所载药物入脑。
2 中药纳米制剂的脑内递送
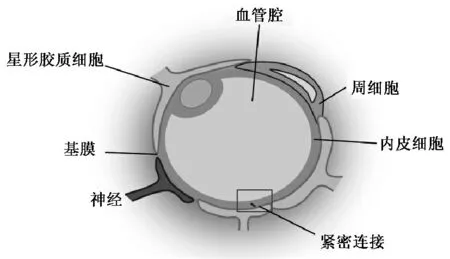
图1 血脑屏障的结构
2.1 中药纳米制剂脑内递送的优势 中药在脑部疾病的预防和治疗效果上有优于西药之处,具体为针对难治的、成因不确切的脑部疾病,中药可发挥其自身多环节、多靶点的保护作用,如中药单一成分通过多个药效团共同发挥治疗作用,而多种成分则通过作用于同一疾病的多通路、多靶点发挥协同作用来提高疗效。然而,由于中药有效成分透过血脑屏障量的限制,其治疗作用仍有待于进一步提高。通过纳米技术将中药制成纳米制剂后,与传统中药相比,不仅大大增加了其血脑屏障透过量,有利于发挥多通路、多靶点的治疗作用,还在一定程度上降低了其不良反应[11-13]。

图2 各种物质透过血脑屏障的途径
2.2 纳米粒 纳米粒(nanoparticles,NPs)是将药物包载于载体材料骨架中,或通过共价连接/吸附作用修饰在载体材料表面所形成的具有紧实结构的纳米级药物递释系统,在中药脑内递送方面的应用最为广泛。根据材料不同,常见的纳米载体可分为固体脂质纳米粒和聚合物纳米粒。
2.2.1 固体脂质纳米粒 固体脂质纳米粒(solid lipid nanoparticles,SLNs)是以毒性低、生物相容性好、可降解的固态天然或合成类脂(如卵磷脂、三酰甘油等)为载体,将药物包裹或夹嵌于类脂核中所制成的纳米给药系统,具有可控释、提高药物稳定性等优点。而且,它自身具有一定的脑靶向性,静脉或口服给药后均能转运入脑,可提高包载药物的脑内递释效果[14-15]。
Martins 等[16]采用高剪切均质和超声波技术制备了喜树碱固体脂质纳米粒,其平均粒径为(159.7 ±8.0)nm,PDI值为0.16 ±0.01,Zeta 电位值为(-24.0 ±2.9)mV,包封率为(96.5 ±1.9)%。静脉给药后,喜树碱固体脂质纳米粒与其原药混悬液相比,脑内平均滞留时间MRT 延长1.83倍,AUC 增大8.34 倍,Cmax增大6.25 倍,表明它可显著促进喜树碱穿越血脑屏障入脑。
Pandita 等[17]采用改良溶剂注入法制备了紫杉醇固体脂质纳米粒,其平均粒径为(96 ±4.4)nm,PDI 值为0.162 ±0.04,Zeta 电位值为(39.1 ±0.8)mV,包封率和载药量分别为(75.42 ±1.5)%和(31.5 ±2.1)%。口服给药后,紫杉醇固体纳米粒与其溶液相比,AUC 增大2 倍,Cmax增大3.3 倍,t1/2延长2.1 倍,表明它可显著促进紫杉醇入脑。
Luo 等[18]采用溶剂注入法制备了葛根素固体脂质纳米粒(Pue-SLNs),其平均粒径为160 nm,Zeta 电位值为-35.43 mV。口服给药后,Pue-SLNs 与其混悬液相比,脑内AUC 增大2.30 倍,Cmax增大2.52 倍,表明可穿越血脑屏障进入脑组织。
2.2.2 聚合物纳米粒 聚合物纳米粒是一种新型的药物载体,其多变性可赋予载药系统许多新的特点,目前用于中药脑部给药常见的材料有聚乙二醇修饰的阳离子聚合物类、聚酯类等,其中聚酯类材料因其生物可降解性、良好的生物相容性、安全性而得到广泛应用[19-20]。例如,聚乳酸-羟基乙酸共聚物[poly(lactic-co-glycolic acid),PLGA]已经通过美国食品药品监督管理局(FDA)验证,作为药物辅料收录于《美国药典》[21-22]。聚合物纳米粒静脉注射给药后,由于其粒径小以及体内循环时间长,故具有一定的被动靶向作用,进一步经转铁蛋白 (Tf)、低密度脂蛋白受体(LDLR)配体和peptide-22 等修饰后,可通过主动靶向作用以进一步提高效果[23-24],然后把药物定向输送到中枢神经系统来发挥作用。
Zhao 等[25]采用阴离子聚合法制备了葛根素PBCN 纳米粒,其平均粒径为201.2 nm,PDI 值为0.387,Zeta 电位为-7.72 mV。静脉给药后,葛根素PBCN 纳米粒与其溶液相比,脑内平均滞留时间MRT 延长了19 倍,AUC 和Cmax分别提高了4.36 和1.72 倍,表明它可显著促进葛根素跨越血脑屏障入脑。
Tsai 等[26]采用高压乳化溶剂挥发法制备了姜黄素-PLGA 纳米粒(C-NPS),其平均粒径为(163 ±8.1)nm,PDI值为0.053 ±0.021,Zeta 电位值为(-12.5 ±2.8)mV,包封率为(46.9 ±8.2)%。静脉给药后,C-NPS 与其溶液相比,脑内平均滞留时间(MRT)延长1.33 倍,而且在大脑皮质区和海马区的MRT 分别延长2.0 和1.8 倍,AUC 增大1.41 倍,t1/2增大1.61 倍,可促进姜黄素的转运入脑。
Guo 等[23]采用复乳法制备了转铁蛋白修饰白藜芦醇纳米粒(Tf-PEG-PLA-RSV),其平均粒径为(153.37 ±28.2)nm,Zeta 电位值为(-9.6 ±0.4)mV,载药量和包封率分别为(4.35 ± 0.15)% 和 (78.2 ± 4.8)%。腹腔给药后,Tf-PEG-PLA-RSV 与其溶液以及未修饰者相比,脑内白藜芦醇量分别增大了2.43 和1.89 倍,表明它可在一定程度上促进白藜芦醇入脑,并且经转铁蛋白修饰后,可进一步提高其入脑转运效率。
Zhang 等[24]利用EDC/NHS 技术制备了低密度脂蛋白受体介导的peptide-22 修饰的双靶向PEG-PLA 紫杉醇纳米粒(PNP-PTX),其平均粒径为(124.7 ±2.7)nm,Zeta 电位值为 (- 29.2 ± 0.8)mV,包封率和载药量分别为(29.1 ±0.67)%和(2.0 ±0.049)%。静脉给药后,PNPPTX 与未修饰者相比,脑内AUC 增大2.3 倍,跨血脑屏障转运率分别是其溶液和未修饰者的2.59 和1.60 倍,修饰组正常和胶质瘤脑组织的荧光强度分别是未修饰组的1.37和2.48 倍,表明它可有效穿越血脑屏障进入脑组织,并且在肿瘤组织部位有更好的靶向效果。
2.3 胶束 胶束(micelle)是两亲性分子通过自组装作用所形成的具有核壳结构的药物载体,其疏水性内核可包载疏水性或难溶性药物以提高稳定性,而亲水性片段有利于减少网状内皮系统的吞噬作用。胶束给药系统一般通过静脉注射用于脑部药物的递释[27-28],从而延长药物的作用时间和靶向传递。另外,通过转铁蛋白(Tf)和RGD 等修饰后给药,可进一步提高靶向效果[29]。
Song 等[27]采用透析法将姜黄素(CUR)包载于聚乳酸-聚乙二醇-聚乳酸共聚物中,制备成CUR 胶束,其平均粒径为26.29 nm,Zeta 电位值为-0.71 mV,包封率和载药量分别为(70 ±0.34)%和(6.4 ±0.02)%。静脉给药后,CUR 胶束与其溶液相比,脑内AUC 增大14.31 倍,Cmax增大2 倍,表明它可有效促进姜黄素跨越血脑屏障入脑。
Zhang 等[28-29]采用透析法制备了转铁蛋白修饰的紫杉醇混合胶束(TPM),其平均粒径为(87.85 ±2.32)nm,PDI 值为0.232,Zeta 电位值为(-12.33 ±1.46)mV,包封率和载药量分别为(89.9 ±3.4)%和(3.46 ±0.07)%。尾静脉注射给药后1 h,TPM 中的紫杉醇浓度约为未修饰者的1.8 倍,表明它可在一定程度上提高紫杉醇的入脑效果。此外,他们还制备了转铁蛋白与c [RGDfK]共修饰的紫杉醇混合胶束(TRPM),其平均粒径为(98.44 ±2.67)nm,PDI 值<0.22,Zeta 电位值为(-8.71 ±0.78)mV,包封率和载药量分别为(82.9 ±2.9)%和(3.18 ±0.10)%。它不仅具有缓释效应,在72 h 内持续缓慢地完全释放,而且在尾静脉注射给药后1 h 内,可提高脑部药物浓度至其溶液的8 倍,表明它可进一步提高紫杉醇的脑部转运。
2.4 脂质体 脂质体能在一定程度上保护药物避免在血浆中降解,并绕开外排转运蛋白(如P-gp),从而利于药物靶向入脑,也被广泛应用于脑部药物传递的研究[30]。
Lazar 等[31]采用薄膜水化技术制备了姜黄素纳米脂质体(CnLs),其平均粒径为(207.2 ±8.0)nm,PDI 值为0.255,Zeta 电位值为(-10.5 ±1.2)mV。在刚果红染色阿尔茨海默症病变部位的研究中,高达70%的CnLs 分布到老年斑块中的Aβ 区域,证实它可有效穿越血脑屏障进入脑组织。
黄静等[32]采用逆向蒸发和高压均质法制备了天麻素纳米脂质体,其平均粒径为(97.52 ±0.79)nm,PDI 值为0.273,Zeta 电位值为(-1.36 ±0.57)mV。尾静脉给药后,天麻素纳米脂质体与其水溶液相比,脑内AUC 提高1.46 倍,总靶向效率提高1.22 倍,表明它可有效促进天麻素跨越血脑屏障入脑。
Liu 等[33]采用薄膜水化法制备了RGD 修饰的紫杉醇脂质体(PTX-RGD-lipo),其平均粒径为(105.2 ±1.4)nm,PDI 值为0.187 ±0.007,Zeta 电位值为(-7.14 ±0.19)mV,包封率为(94.87 ±1.20)%。在bEnd.3 细胞体外实验中,PTX-RGD-lipo 的荧光探针信号比未修饰者增大约1.72 倍,表明它可在一定程度上促进紫杉醇入脑。
2.5 纳米混悬剂 纳米混悬剂(NSPS)系采用少量表面活性剂稳定纯药物粒子所形成的一种亚微米胶体分散体系[34-35],其给药方式多为尾静脉注射和口服给药。近年来研究发现[36-37],它不仅能增加药物的溶出度、生物利用度、稳定性,还可在一定程度上促进药物的脑内转运,从而增强其靶向性。
李学明等[38]采用高压均质机法制备了紫杉醇纳米混悬剂,其平均粒径为(214 ±5.03)nm,PDI 值为0.09,Zeta电位值为-22.7 mV。尾静脉给药后,紫杉醇纳米混悬剂与其注射液相比,脑内AUC 增大294.27 倍,表明它可显著提高紫杉醇的脑内浓度。
马丽等[39]采用油包油法制备了川芎嗪油纳米混悬剂,其平均粒径为(92.96 ±0.76)nm。口服给药后,川芎嗪油纳米混悬剂与其溶液相比,MRT 延长2.83 倍,AUC 和Cmax分别增大1.97 和2.22 倍,表明它可在一定程度上促进川芎嗪跨越血脑屏障入脑。
Han 等[40]采用沉淀-超声法制备了厚朴酚纳米混悬剂,其平均粒径为(116.2 ±1.77)nm,PDI 值为0.12 ±0.02,Zeta 电位值为 (- 44.7 ± 1.7)mV,载药量为 (50.4 ±0.6)%。灌胃给药后,厚朴酚纳米混悬剂与其混悬液相比,脑内AUC 和Cmax分别增大1.29 和1.25 倍。而且,腹腔给药能进一步提高其脑内转运,与灌胃给药相比,腹腔给药时脑内AUC 和Cmax分别增大14.67 和10.22 倍。
3 中药纳米制剂在治疗脑部疾病中的应用
中药纳米制剂能有效增强药物的溶解性和溶出速率,如脂质体、纳米粒等可有效改善难溶或不溶性中药的溶解度和溶出度,并能提高靶向性,降低毒副作用。尤其是经表面功能化修饰后,能进一步促进药物有效地透过血脑屏障,提高药物的脑内浓度,有利于其发挥多通路、多靶点的治疗作用。目前,中药纳米制剂在阿尔茨海默病、脑缺血再灌注损伤和脑胶质瘤等脑部疾病治疗方面有广泛研究。
3.1 阿尔茨海默病 阿尔茨海默病(Alzheimer's disease,AD)是一种进行性神经退变性疾病,它有3 个主要病理特征,分别为老年斑 (senile plague,SP)、神经纤维缠结(neurofibrillary tangles,NFT)和神经元,尤其是胆碱能神经元的缺失。β 淀粉样蛋白(Amyloidβ-peptide,Aβ)是SP的核心成分,也是其他AD 脑病变产生的基础,而且对神经元具有神经营养和神经毒双重作用。低浓度的Aβ(pmol/L ~nmol/L)对未成熟分化的神经元表现出营养作用,但随着其浓度升高(mol/L),对成熟分化的神经元开始呈现出神经毒性,使树突和轴突萎缩,导致神经元减少或缺失。大量研究证实,Aβ 的生成、聚集和沉积是AD 致病的核心因素,其大量沉积所形成的淀粉样斑块即老年斑,继而出现神经元丧失、神经纤维缠结等病理特征[41]。
姜黄素是中药姜黄的主要活性成分之一,具有抗菌、抗病毒、抗氧化、抗衰老、抗肿瘤、抗纤维化以及调节血脂等多种生物活性,更具有下调Aβ 前体(APP)和早老素1 (PS-1)等病理变化的表达,减少AD 脑组织中Aβ 异常聚集的功能[42]。
Tiwari 等[43]采用乳化溶剂挥发法制备了姜黄素PLGA纳米粒(Cur-PLGA-NPs),发现以50 mg/kg 剂量注射给药后,与姜黄素原药溶液组相比,Cur-PLGA-NPs 组不仅脑内姜黄素的浓度增高,神经球的数量和大小分别增加约1.3和1.4 倍,而且海马区颗粒细胞层与脑室下区中Brdu+的数量、海马切片中磷酸化组蛋白H3 的有丝分裂、巢蛋白与PAX-6 的mRNA 相对表达以及β-catenin 核转运率等指标也有1.3 ~1.6 倍的上调。在行为学研究中,Cur-PLGA-NPs 组与姜黄素原药溶液组相比,学习和记忆条件性回避行为分别增加1.7 和2 倍,表明它能促进姜黄素通过提高大脑的自我修复机制和激活β-catenin 途径,用于诱导成年神经再生,有望成为一种治疗AD 的有效药物。
Taylor 等[44]等采用薄膜水化法分别制备了包载姜黄素纳米脂质体和点击化学法姜黄素表面修饰脂质体。硫磺素T 荧光(ThT)测试结果显示,与空白脂质体相比,两者对Aβ1-42纤维沉淀的抑制率分别增大约2.3 和2.4 倍,表明它们均能显著提高姜黄素抑制Aβ1-42纤维沉淀的作用。
Mourtas 等[45]采用薄膜水化法制备了姜黄素修饰的纳米脂质体。表面等离子共振(SPR)研究显示,它与空白脂质体相比,与Aβ1-42单体的结合亲和力增加约200 倍,与Aβ1-42纤维的结合亲和力增加约320 倍,与牛血清白蛋白的结合亲和力增加约120 倍,表明姜黄素纳米脂质体与Aβ1-42的亲和力较高,有望应用于AD 的诊断或成为治疗AD 致病物的标记药物。
3.2 脑缺血-再灌注(I/R)损伤 I/R 后神经元损伤的病理机制涉及到脑组织能量代谢障碍、细胞内Ca2+超载、氧自由基大量产生以及兴奋性氨基酸细胞毒性等。由于缺血缺氧而产生的大量自由基(FR)攻击细胞膜,引起脂质过氧化反应,生成MDA,同时SOD 等抗氧化物酶被消耗,FR的清除剂减少,FR 将直接对脑组织产生强大的破坏作用,并使脑组织发生脂质过氧化反应,造成神经元损伤,而线粒体膜损伤和能量代谢障碍发生后则可导致细胞死亡。因此,通过检测SOD 活性和MDA 水平变化可间接反应氧自由基水平和脂质过氧化反应的强弱,而且脑组织中的Na+-K+-ATPase 标志着细胞活力和状态的改变,当脑缺血缺氧时,细胞内ATP 减少,依赖ATP 供能的钠泵活动减弱,Na+不能向细胞外主动转运,细胞内Na+潴留,水分大量进入细胞内,导致脑水肿的发生。另外,Na+- K+-ATPase 还可通过Na+/Ca2+交换调节细胞内Ca2+浓度,控制神经递质释放,从而操纵神经元之间的兴奋性传递,因此Na+-K+-ATPase 活性的高低也可作为评价I/R 后神经元损伤的指标之一。另外,细胞凋亡是I/R 损伤早期的细胞死亡形式,由Bcl-2 蛋白家族参与调控的细胞凋亡在I/R损伤过程中起着重要作用。Bcl-2 基因是一种原癌基因,它所编码的膜相关蛋白是一种重要的抗凋亡基因,可通过抑制自由基、调控凋亡执行蛋白Caspase 激活因子等途径来发挥抗I/R 损伤作用[46-47]。已有研究表明,一些中药活性成分(如丹参酮[48-49]、姜黄素[50-51]、葛根素[52]等)能有效改善I/R 损伤,如果将这些药物用纳米载体包载,则可进一步提高其相关作用。
3.2.1 丹参酮ⅡA 丹参酮ⅡA 是丹参中重要的有效活性成分,具有扩张血管、改善微循环、抗凝抗血小板聚集、降低血黏度、抑制内皮素分泌、清除氧自由基、抗炎和保护血管内皮细胞等多种药理作用[48-49]。
陈峰等[53]采用球磨法制备丹参酮ⅡA-PEG 纳米粒,然后和尼莫地平对照组分别以25 和6 mg/kg 剂量灌胃给予I/R 损伤模型鼠。结果,丹参酮ⅡA-PEG 纳米粒组的脑组织MDA 水平和Na+-K+-ATPase 活性值与对照组相比,分别降低和升高12.29%和1.17 倍,表明它具有较好的神经元细胞保护作用,能保护I/R 后Na+-K+-ATPase 酶的活性。
3.2.2 姜黄素 姜黄素是一种从姜科植物姜黄的根茎中提取得到的酸性多酚类物质,近年来研究证实,它具有缩小脑梗死面积、抗脂质过氧化、抗自由基、抑制血小板聚集和抗血栓形成等多种作用[50-51]。
Kakkar 等[54]采用复乳法制备了姜黄素固体脂质纳米粒(C-SLNs)。静脉注射给药后,C-SLNs 与其溶液相比,保留传输延迟值(RTL)降低35.15%,最初传输延迟值(ITL)提高1.35 倍,出现在目标象限的游泳时间(TSTQ)提高2.66 倍,脂质过氧化水平值(LPO)降低49.91%,还原性谷胱甘肽水平(GSH)提高14.72 倍,超氧化物歧化酶活力值(SOD)提高2.18 倍,表明姜黄素制成固体脂质纳米粒后,对I/R 损伤的治疗效果显著增强,有望成为一种有效的相关药物。
3.2.3 葛根素 葛根素是中药葛根的主要有效成分,它对缺血性脑卒中、老年性痴呆和I/R 损伤等病理过程所导致的中枢神经系统损伤具有保护作用[55]。
Zhao 等[24]采用阴离子聚合法制备了葛根素PBCN 纳米粒(PUE-PBCN),然后以20 mg/kg 剂量静脉注射I/R 模型小鼠和大鼠。结果,PUE-PBCN 与其溶液相比,神经系统缺陷分数减少44.44%,抑制体质量下降能力增加1.26 倍,另外以10 mg/kg 剂量静脉给药后,PUE-PBCN 的脑梗死体积减少约42.86%,表明它能显著提高葛根素对I/R 损伤的治疗效果。
Tao 等[53]采用复乳法制备了HP-β-CD-PLGA-葛根素纳米粒。CT 扫描结果显示,纳米粒组与葛根素溶液组相比,在脑缺血后的第3 和第7 天,平均核心(脑)梗死体积分别减少29.41%和27.27%;脑电图结果显示,纳米粒组的脑频率、脑振幅、峰谷值和脑梗死修复后面积分别增加1.31、1.50、1.36 和1.36 倍,而且应用HP-β-CD-PLGA-葛根素纳米粒治疗后,脑缺血各指标的提高程度均接近假手术组,表明它能显著提高葛根素对脑缺血再灌注损伤的治疗效果,有望成为一种有效的I/R 损伤治疗药物。
Zhu 等[56]制备了葛根素固体脂质纳米粒,然后免疫组织化学法检测I/R 脑组织中Bcl-2、Caspase-3 和HSP70 的蛋白表达。结果显示,纳米粒组与葛根素注射剂对照组相比,海马区和大脑皮质区的Bcl-2 细胞数分别增加1.44 和2.05倍,Caspase-3 细胞数分别减少29.39% 和7.99%,HSP70细胞数分别增加1.42 和1.17 倍,表明它可显著提高葛根素对I/R 脑组织的保护作用,改善I/R 后的病理改变,提高脑组织海马区和皮质区Bcl-2 及HSP70 蛋白表达,下调Caspase-3 蛋白表达。
3.3 脑胶质瘤 神经胶质瘤是大脑中最具侵略性的原发性恶性肿瘤,寻找一种有效并且副作用低的治疗方法依然是一个巨大的挑战。脑胶质瘤治疗的第一障碍物是血脑屏障保护作用,大多数抗肿瘤药物对正常脑组织具有高毒性,使其难以跨越血脑屏障入脑,即使少量药物进入脑组织后,由于肿瘤部位的高细胞密度和高间质压力,阻碍其进入脑内肿瘤部位[57-58]。研究表明,一些中药活性成分(如姜黄素[59-60]、鸦胆子油[61-64]、白藜芦醇[65]、紫杉醇[66]等)能有效抑制脑胶质瘤的生长能力,但进入血脑屏障的能力较差。因此,研究人员正利用纳米系统包载及靶向修饰来克服上述两道障碍,用于实现有效且副作用低的神经胶质瘤治疗。
3.3.1 姜黄素 多酚植物提取物姜黄素具有抗肿瘤、抗氧化和抗炎作用,由于它能抑制多种肿瘤的发生、发展和转移,并且作为食物和传统中药的提取物[59-60],其药物安全性可靠,因此成为肿瘤治疗中前景非常广阔的药物。
Zanotto-Filho 等[67]采用界面沉淀法制备了姜黄素纳米脂质体,然后腹腔给药大鼠。结果,姜黄素纳米脂质体与其溶液相比,脑胶质瘤抑制率增加约2 倍,生存时间延长约1.5 倍,表明它能有效提高姜黄素的抗肿瘤效果。
3.3.2 鸦胆子油和冰片 鸦胆子油(Brucea javanica oil)是从苦木科植物鸦胆子Brucea javanica (L.)Merr 的干燥成熟果实中提取的脂肪油,具有低毒、高效和抗肿瘤类型广等诸多优点,并有抑制脑胶质瘤和降低颅内压的作用,显示出良好的应用前景[61-64]。除此之外,冰片可携带多种药物透过血脑屏障,亦能增加其通透性,具有脑保护作用[68]。
吕长江等[69]采用转相法制备了平均粒径为(47.60 ±0.57)nm 的冰片-鸦胆子油纳米乳(BBNE),然后尾静脉注射给药大鼠。结果,BBNE 组与鸦胆子油注射剂组相比,肿瘤体积减小37.5%,质量减小28.57%,肿瘤抑制率增加1.56 倍,表明它有效提高了鸦胆子油的脑靶向性和肿瘤抑制效果。
3.3.3 白藜芦醇 白藜芦醇是许多植物受到真菌感染、紫外线照射或病理状况时所产生的一种抗毒素,已知有70 多种天然植物中包含白藜芦醇及其苷。目前研究表明,它不仅具有抗血栓、抗突变、抗氧化、抗炎等功效,而且还有着抑制肿瘤的作用[65]。
Guo 等[24]采用复乳法制备了转铁蛋白修饰的白藜芦醇纳米粒(Tf-PEG-PLA-RSV),然后腹腔给药脑胶质瘤模型大鼠。结果,Tf-PEG-PLA-RSV 和白藜芦醇溶液与未修饰者相比,大鼠生存时间分别延长约1.64 和1.53 倍,脑胶质瘤抑制率分别增加约2.31 和1.5 倍,表明它能显著提高白藜芦醇的抗脑胶质瘤效果。
3.3.4 紫杉醇 紫杉醇(Paclitaxel,PTX)是从红豆杉属植物紫杉的树干和树皮中提取出的一种天然抗癌活性成分,能通过抑制微管分解,使细胞分裂阻断在G2 期和M 期,促进肿瘤细胞死亡。临床研究表明[66],它在治疗多种实体瘤方面有着显著的作用。然而,紫杉醇是P-gp 的底物,在治疗脑部疾病的过程中受到脑内皮细胞上P-gp 的外排作用,故采用纳米技术将其制成纳米制剂后[29,34,70-72],能有效地提高紫杉醇治疗脑部疾病的效果。
Cui 等[70]采用复乳溶剂挥发法和EDC/NHS 技术制备了转铁蛋白修饰阿霉素-紫杉醇磁性二氧化硅PLGA 纳米粒(DOX-PTX-NPs-Tf),然后静脉注射给药。结果,未修饰Tf的阿霉素和紫杉醇纳米粒(DOX-PTX-NPs)的脑内肿瘤荧光强度与生理盐水组相比,降低22.22%;转铁蛋白修饰后阿霉素纳米粒 (DOX-NPs-Tf)和修饰后紫杉醇纳米粒(PTX-NPs-Tf)的脑内肿瘤荧光强度与DOX-PTX-NPs 相比,分别降低28.57%和50.00%;DOX-PTX-NPs-Tf 的脑内肿瘤荧光强度与DOX-PTX-NPs 相比,降低98.57 倍,表明它可有效提高紫杉醇的抗肿瘤效果。
Zhan 等[71]采用薄膜水化法制备了CDX 肽修饰的聚乙二醇-聚乳酸紫杉醇胶束(CDX-PEG-PLA-PTX)和c (RGDyK)修饰的聚乙二醇-聚乙烯亚胺pORF-hTRAIL 纳米粒(RGD-PEG-PEI/pORF-hTRAIL),然后尾静脉注射给药荷瘤大鼠。结果,CDX-PEG-PLA-PTX 组单独给药、RGD-PEGPEI/pORF-hTRAIL 组单独给药和两组联合给药后,大鼠生存时间分别是生理盐水组的1.14、1.19 和1.56 倍,表明两者联合给药能有效提高抗肿瘤效果。
Zhang 等[30]采用透析法制备了转铁蛋白修饰的紫杉醇混合胶束(TPM)。在抗胶质瘤活性研究中,小鼠经尾静脉注射给药后,TPM 组与紫杉醇原药溶液组相比,其生存时间延长了1.18 倍,表明它能显著提高紫杉醇的抗肿瘤效果。
Liu 等[35]采用薄膜水化法制备了RGD 修饰的紫杉醇脂质体(PTX-RGD-lipo)。在抗胶质瘤活性研究中,小鼠经尾静脉注射给药后,PTX-RGD-lipo 组与紫杉醇原药溶液组比,其生存时间延长1.19 倍,表明它在一定程度上能提高紫杉醇的抗肿瘤效果。
Li 等[72]采用膜分散法制备了分别加入甘露糖-维生素E衍生物(MAN-TPGS1000)与地喹氯铵-脂质衍生物(DQAPEG2000-DSPE)这两种功能材料的紫杉醇和蒿甲醚多功能脂质体。在抗癌活性研究中,紫杉醇和蒿甲醚多功能脂质体与紫杉醇原药溶液以及未修饰者相比,肿瘤抑制率分别增加2.98 和2.45 倍,生存时间分别延长1.59 和1.45 倍,表明两者均能显著提高多烯紫杉醇和蒿甲醚的抗肿瘤效果。
4 总结
近年来,随着脑部疾病发病率的不断升高,脑部药物递送技术越来越引起人们的关注。在相关疾病(如脑胶质瘤、脑缺血再灌注损伤、阿尔茨海默病等)的治疗过程中,血脑屏障的存在使很多药物难以进入脑病变部位,从而无法发挥作用,导致许多脑部疾病不能得到有效治疗。目前研究结果表明,纳米载药系统能够在一定程度上克服血脑屏障,转运药物至脑,而且具有一定的脑内缓释效果。其中,聚合物纳米粒和固体脂质纳米粒的效果较理想,其以毒性低、生物相容性好、生物可降解的载体,通过将药物吸附或包裹于载体中制成,具有药物释放可控、避免药物降解泄漏以及修饰后具有良好靶向性等优点,但其转运入脑的能力还有待进一步提高。
中药纳米制剂对多种脑部疾病均有一定疗效,尤其是在脑胶质瘤治疗方面效果显著。将中药治疗脑部疾病的优势结合纳米载体来应用于中药制剂,不仅有助于中药剂型的改良,也有利于中药疗效的提高。然而,由于中药体系的复杂性以及纳米载体现存的某些不足,其应用尚处于起步阶段,相关制剂的研制目前还面临着不少亟待解决的问题,例如现有的中药纳米制剂主要集中在单味药,且以单体有效成分为主,但关于中药复方的研究很少;多数制剂停留在实验室研制阶段,材料、工艺、质量控制等方面还不够成熟等等。因此,随着纳米药物载体理论和技术的不断完善,在中医药思想的指导下,开发出高效、可控、稳定、安全的现代中药纳米制剂必将为脑部疾病治疗带来更多的选择。
[1] Chen Y,Liu L. Modern methods for delivery of drugs across the blood-brain barrier[J]. Adv Drug Deliv Rev,2012,64(7):640-665.
[2] Patabendige A,Skinner R A,Abbott N J. Establishment of a simplified in vitro porcine blood-brain barrier model with high transendothelial electrical resistance[J]. Brain Res,2013,1521:1-15.
[3] Le Broc-Ryckewaert D,Carpentier R,Lipka E,et al. Development of innovative paclitaxel-loaded small PLGA nanoparticles:study of their antiproliferative activity and their molecular interactions on prostatic cancer cells[J]. Int J Pharm,2013,454(2):712-719.
[4] Kakkar V,Kaur I P. Evaluating potential of curcumin loaded solid lipid nanoparticles in aluminium induced behavioural,biochemical and histopathological alterations in mice brain[J].Food Chem Toxicol,2011,49(11):2906-2913.
[5] Wohlfart S,Gelperina S,Kreuter J. Transport of drugs across the blood-brain barrier by nanoparticles[J]. J Control Release,2012,161(2):264-273.
[6] Alyautdin R,Khalin I,Nafeeza M I,et al. Nanoscale drug delivery systems and the blood-brain barrier[J]. Int J Nanomedicine,2014,9:795-811.
[7] Wong H L,Wu X Y,Bendayan R. Nanotechnological advances for the delivery of CNS therapeutics[J]. Adv Drug Deliv Rev,2012,64(7):686-700.
[8] Kang E J,Major S,Jorks D,et al. Blood-brain barrier opening to large molecules does not imply blood-brain barrier opening to small ions[J]. Neurobiol Dis,2013,52:204-218.
[9] Lee G,Dallas S,Hong M,et al. Drug transporters in the central nervous system:brain barriers and brain parenchyma considerations[J]. Pharmacol Rev,2001,53(4):569-596.
[10] Kreuter J. Drug delivery to the central nervous system by polymeric nanoparticles:What do we know?[J]. Adv Drug Deliv Rev,2014,71:2-14.
[11] Patel M M,Goyal B R,Bhadada S V,et al. Getting into the brain:approaches to enhance brain drug delivery[J]. CNS Drugs,2009,23(1):35-58.
[12] Kurakhmaeva K B,Djindjikashvili I A,Petrov V E,et al.Brain targeting of nerve growth factor using poly (butyl cyanoacrylate)nanoparticles[J]. J Drug Target,2009,17 (8):564-574.
[13] 吴 云,严国俊,蔡宝昌. 纳米技术在中药领域的研究进展[J]. 中草药,2011,42(2):403-408.
[14] Venishetty V K,Komuravelli R,Kuncha M,et al. Increased brain uptake of docetaxel and ketoconazole loaded folate-grafted solid lipid nanoparticles[J]. Nanomedicine,2013,9 (1):111-121.
[15] Jin J,Bae K H,Yang H,et al. In vivo specific delivery of c-Met siRNA to glioblastoma using cationic solid lipid nanoparticles[J]. Bioconjug Chem,2011,22(12):2568-2572.
[16] Martins S M,Sarmento B,Nunes C,et al. Brain targeting effect of camptothecin-loaded solid lipid nanoparticles in rat after intravenous administration[J]. Eur J Pharm Biopharm,2013,85(3 Pt A):488-502.
[17] Pandita D,Ahuja A,Lather V,et al. Development of lipidbased nanoparticles for enhancing the oral bioavailability of paclitaxel[J]. AAPS Pharm Sci Tech,2011,12(2):712-722.
[18] Luo C F,Yuan M,Chen M S,et al. Pharmacokinetics,tissue distribution and relative bioavailability of puerarin solid lipid nanoparticles following oral administration[J]. Int J Pharm,2011,410(1-2):138-144.
[19] Chang J,Jallouli Y,Kroubi M,et al. Characterization of endocytosis of transferrin-coated PLGA nanoparticles by the bloodbrain barrier[J]. Int J Pharm,2009,379(2):285-292.
[20] Xia H,Gao X,Gu G,et al. Penetratin-functionalized PEGPLA nanoparticles for brain drug delivery[J]. Int J Pharm,2012,436(1-2):840-850.
[21] Md S,Ali M,Baboota S,et al. Preparation,characterization,in vivo biodistribution and pharmacokinetic studies of donepezilloaded PLGA nanoparticles for brain targeting[J]. Drug Dev Ind Pharm,2014,40(2):278-287.
[22] Simsek S,Eroglu H,Kurum B,et al. Brain targeting of Atorvastatin loaded amphiphilic PLGA-b-PEG nanoparticles[J]. J Microencapsul,2013,30(1):10-20.
[23] Guo W,Li A,Jia Z,et al. Transferrin modified PEG-PLA-resveratrol conjugates:In vitro and in vivo studies for glioma[J].Eur J Pharmacol,2013,718(1-3):41-47.
[24] Zhang B,Sun X,Mei H,et al. LDLR-mediated peptide-22-conjugated nanoparticles for dual-targeting therapy of brain glioma[J]. Biomaterials,2013,34(36):9171-9182.
[25] Zhao L X,Liu A C,Yu S W,et al. The permeability of puerarin loaded poly (butylcyanoacrylate)nanoparticles coated with polysorbate 80 on the blood-brain barrier and its protective effect against cerebral ischemia/reperfusion injury[J]. Biol Pharm Bull,2013,36(8):1263-1270.
[26] Tsai Y M,Chien C F,Lin L C,et al. Curcumin and its nanoformulation:the kinetics of tissue distribution and blood-brain barrier penetration[J]. Int J Pharm,2011,416(1):331-338.
[27] Song Z,Feng R,Sun M,et al. Curcumin-loaded PLGA-PEGPLGA triblock copolymeric micelles:Preparation,pharmacokinetics and distribution in vivo[J]. J Colloid Interface Sci,2011,354(1):116-123.
[28] Zhang P,Hu L,Yin Q,et al. Transferrin-conjugated polyphosphoester hybrid micelle loading paclitaxel for brain-targeting delivery:Synthesis,preparation and in vivo evaluation[J]. J Control Release,2012,159(3):429-434.
[29] Zhang P,Hu L,Yin Q,et al. Transferrin-modified c [RGDfK] -paclitaxel loaded hybrid micelle for sequential blood-brain barrier penetration and glioma targeting therapy[J]. Mol Pharm,2012,9(6):1590-1598.
[30] Lai F,Fadda A M,Sinico C. Liposomes for brain delivery[J].Expert Opin Drug Del,2013,10(7):1003-1022.
[31] Lazar A N,Mourtas S,Youssef I,et al. Curcumin-conjugated nanoliposomes with high affinity for Aβ deposits:possible applications to Alzheimer disease[J]. Nanomedicine,2013,9(5):712-721.
[32] 黄 静,何 文,李秀芳,等. 天麻素纳米脂质体的研制及其脑靶向性的初步研究[J]. 广东药学院学报,2011,27(4):345-350.
[33] Liu Y,Ran R,Chen J,et al. Paclitaxel loaded liposomes decorated with a multifunctional tandem peptide for glioma targeting[J]. Biomaterials,2014,35(17):4835-4847.
[34] Ghosh I,Bose S,Vippagunta R,et al. Nanosuspension for improving the bioavailability of a poorly soluble drug and screening of stabilizing agents to inhibit crystal growth[J]. Int J Pharm,2011,409(1-2):260-268.
[35] Caruso G,Raudino G,Caffo M,et al. Nanotechnology platforms in diagnosis and treatment of primary brain tumors[J].Recent Pat Nanotechnol,2010,4(2):119-124.
[36] Bhavna,Md S,Ali M,et al. Donepezil nanosuspension intended for nose to brain targeting:In vitro and in vivo safety evaluation[J]. Int J Biol Macromol,2014,67:418-425.
[37] Shubar H M,Lachenmaier S,Heimesaat M M,et al. SDS-coated atovaquone nanosuspensions show improved therapeutic efficacy against experimental acquired and reactivated toxoplasmosis by improving passage of gastrointestinal and blood-brain barriers[J]. J Drug Target,2011,19(2):114-124.
[38] 李学明,程晓丹,王永禄,等. 紫杉醇纳米混悬剂的制备及其在动物体内药动学与组织分布研究[J]. 中国药学杂志,2011,46(9):680-685.
[39] 马 丽,吴鸿飞,鲁传华,等. 川芎嗪油基纳米混悬剂在小鼠体内的组织分布研究[J]. 时珍国医国药,2013,23(10):2415-2417.
[40] Han M,Yu X,Guo Y,et al. Honokiol nanosuspensions:preparation,increased oral bioavailability and dramatically enhanced biodistribution in the cardio-cerebro-vascular system [J].Colloids Surf B Biointerfaces,2014,116:114-120.
[41] Querfurth H W,LaFerla F M. Alzheimer's disease[J]. N Engl J Med,2010,362(4):329-344.
[42] Mulik R S,Mönkkönen J,Juvonen R O,et al. ApoE3 mediated poly (butyl)cyanoacrylate nanoparticles containing curcumin:study of enhanced activity of curcumin against beta amyloid induced cytotoxicity using in vitro cell culture model[J]. Mol Pharm,2010,7(3):815-825.
[43] Tiwari S K,Agarwal S,Seth B,et al. Curcumin-loaded nanoparticles potently induce adult neurogenesis and reverse cognitive deficits in Alzheimer’s disease model via canonical Wnt/β-catenin pathway[J]. ACS Nano,2014,8(1):76-103.
[44] Taylor M,Moore S,Mourtas S,et al. Effect of curcumin-associated and lipid ligand-functionalized nanoliposomes on aggregation of the Alzheimer's Aβ peptide[J]. Nanomedicine,2011,7(5):541-550.
[45] Mourtas S,Canovi M,Zona C,et al. Curcumin-decorated nanoliposomes with very high affinity for amyloid-β1-42 peptide[J].Biomaterials,2011,32(6):1635-1645.
[46] Wang X,Han W,Du X,et al. Neuroprotective effect of Bax-inhibiting peptide on neonatal brain injury[J]. Stroke,2010,41(9):2050-2055.
[47] Iriyama T,Kamei Y,Kozuma S,et al. Bax-inhibiting peptide protects glutamate-induced cerebellar granule cell death by blocking Bax translocation[J]. Neurosci Lett,2009,451 (1):11-15.
[48] Dong K,Xu W,Yang J,et al. Neuroprotective effects of Tanshinone IIA on permanent focal cerebral ischemia in mice[J].Phytother Res,2009,23(5):608-613.
[49] Chen Y,Wu X,Yu S,et al. Neuroprotective capabilities of Tanshinon ⅡA against cerebral ischemia/reperfusion injury via anti-apoptotic pathway in rats[J]. Biol Pharm Bull,2012,35(2):164-170.
[50] Zhao J,Yu S,Zheng W,et al. Curcumin improves outcomes and attenuates focal cerebral ischemic injury via antiapoptotic mechanisms in rats[J]. Neurochem Res,2010,35 (3):374-379.
[51] Zhang J,Wei H,Lin M,et al. Curcumin protects against ischemic spinal cord injury:The pathway effect[J]. Neural Regen Res,2013,8(36):3391-3400.
[52] Tao H Q,Meng Q,Li M H,et al. HP-β-CD-PLGA nanoparticles improve the penetration and bioavailability of puerarin and enhance the therapeutic effects on brain ischemia-reperfusion injury in rats[J]. Naunyn Schmiedebergs Arch Pharmacol,2013,386(1):61-70.
[53] 陈 峰,叶龙彬,辛中帅,等. 丹参酮ⅡA 纳米制剂对大鼠全脑缺血再灌注损伤的保护作用[J]. 中国临床药理学与治疗学,2009,14(4):391-396.
[54] Kakkar V,Muppu S K,Chopra K,et al. Curcumin loaded solid lipid nanoparticles:an efficient formulation approach for cerebral ischemic reperfusion injury in rats[J]. Eur J Pharm Biopharm,2013,85(3 Pt A):339-345.
[55] Xuan N,Zhou Y H,Yang R L,et al. Improvement of ocular blood flow and retinal functions with puerarin analoys[J]. J Ocul Pharmacol Ther,1999,15(3):207-216.
[56] Zhu L,Luo C F,Yuan M,et al. Molecular mechanism of protective effect of puerarin solid lipid nanoparticle on cerebral ischemia-reperfusion injury in gerbils[J]. J Chin Med Mater,2010,33(12):1900-1904.
[57] Van Meir E G,Hadjipanayis C G,Norden A D,et al. Exciting new advances in neuro-oncology:the avenue to a cure for malignant glioma[J]. CA Cancer J Clin,2010,60(3):166-193.
[58] Jiang X,Xin H,Gu J,et al. Solid tumor penetration by integrin-mediated pegylated poly (trimethylene carbonate)nanoparticles loaded with paclitaxel[J]. Biomaterials,2013,34(6):1739-1746.
[59] Perry M C,Demeule M,Régina A,et al. Curcumin inhibits tumor growth and angiogenesis in glioblastoma xenografts[J].Mol Nutr Food Res,2010,54(8):1192-1201.
[60] Kundu P,Mohanty C,Sahoo S K,et al. Antiglioma activity of curcumin-loaded lipid nanoparticles and its enhanced bioavailability in brain tissue for effective glioblastoma therapy[J]. Acta Biomater,2012,8(7):2670-2687.
[61] Nie Y L,Liu K X,Mao X Y,et al. Effect of injection of Brucea javanica oil emulsion plus chemoradiotherapy for lung cancer:a review of clinical evidence[J]. J Evid Based Med,2012,5(4):216-219.
[62] Cui Y X,Wu Z M,Liu X X,et al. Preparation,safety,pharmacokinetics,and pharmacodynamics of liposomes containing Brucea javanica oil[J]. AAPS PharmSciTech,2010,11(2):878-884.
[63] Yang F,Yu X H,Qiao F,et al. Formulation and characterization of Brucea javanica oil microemulsion for improving safety[J]. Drug Dev Ind Pharm,2014,40(2):266-277.
[64] 尹绍成,石文建,赵喜庆,等. 鸦胆子油乳注射液对C6 胶质瘤细胞增殖影响的实验研究[J]. 西部医学,2014,26(6):686-688.
[65] Ryu J,Ku B M,Lee Y K,et al. Resveratrol reduces TNF-α-induced U373MG human glioma cell invasion through regulating NF-kB activation and uPA/uPAR expression[J]. Anticancer Res,2011,31(12):4223-4230.
[66] Zhan C,Gu B,Xie C,et al. Cyclic RGD conjugated poly(ethylene glycol)-co-poly (lactic acid)micelle enhances paclitaxel anti-glioblastoma effect[J]. J Controlled Release,2010,143(1):136-142.
[67] Zanotto-Filho A,Coradini K,Braganhol E,et al. Curcuminloaded lipid-core nanocapsules as a strategy to improve pharmacological efficacy of curcumin in glioma treatment[J]. Eur J Pharm Biopharm,2013,83(2):156-167.
[68] Yu B,Ruan M,Dong X P,et al. The mechanism of the opening of the blood-brain barrier by borneol:A pharmacodynamics and pharmacokinetics combination study[J]. J Ethnopharmacol,2013,150(3):1096-1108.
[69] 吕长江,张蓉蓉,周 军,等. 冰片鸦胆子油纳米乳的制备及对大鼠脑胶质瘤的抑瘤作用研究[J]. 中国现代应用药学,2014,31(7):780-786.
[70] Cui Y,Xu Q,Chow P K,et al. Transferrin-conjugated magnetic silica PLGA nanoparticles loaded with doxorubicin and paclitaxel for brain glioma treatment[J]. Biomaterials,2013,34(33):8511-8520.
[71] Zhan C,Wei X,Qian J,et al. Co-delivery of TRAIL gene enhances the anti-glioblastoma effect of paclitaxel in vitro and in vivo[J]. J Control Release,2012,160(3):630-636.
[72] Li X Y,Zhao Y,Sun M G,et al. Multifunctional liposomes loaded with paclitaxel and artemether for treatment of invasive brain glioma[J]. Biomaterials,2014,35(21):5591-5604.
