UHPLC-ESI-MS/MS 法测定大鼠血浆中的山姜素和小豆蔻明
2015-01-13陈伟康方建和
陈伟康, 熊 蔚, 许 妍, 方建和
(1. 江西省药品检验检测研究院,江西 南昌330029;2. 江西中医药大学,江西 南昌330004)
草豆蔻为姜科植物草豆蔻Alpinia katsumadai Hayata 的干燥近成熟种子[1],药理研究表明,它具有抗炎、抗肿瘤等作用[2-5]。该植物主要含有挥发油类及小豆蔻明、山姜素、松属素和7,4’-二羟基-5-甲氧基双氢黄酮等[6]黄酮类成分,其中山姜素和小豆蔻明主要存在于姜科植物中,为其抗炎、抗肿瘤的主要活性成分[7-9],由于两者为同分异构体,故研究它们在体内的药动学过程具有一定意义。然而,虽然目前国内外已有采用HPLC[10-12]及胶束电泳法[13]来测定草豆蔻中这两种成分的含有量,但其灵敏度仅达到微克级,不能满足检测要求,因此建立一种灵敏度更高的方法,对开展相关药动学研究具有重要意义。本实验应用UHPLCESI-MS/MS 法测定大鼠血浆中山姜素和小豆蔻明的浓度,并进行方法学验证。结果发现,该方法简单、灵敏(定量限为0.2 ng/mL),可应用于血药浓度监测及药代动力学研究。
1 仪器与材料
1.1 仪器 Agilent 1290 UHPLC 色谱仪、Agilent真空固相萃取缸(美国Agilent 公司);API 4000三重串联四极杆质谱仪(美国ABSCIEX 公司);SORVALL® Biofuge Pico 高速离心机(美国Sorvall公司);Vortex WX 涡旋混合仪(意大利VELP 公司);Thermo 移液枪 (美国Thermo 公司);NEVAPTM112 氮吹仪(美国Oranomation Associates公司);Waters Oasis® HLB 固相萃取小柱(美国Waters 公司)。
1.2 药品与试剂 山姜素 (批号110762-200304)、小豆蔻明(批号110763-200403)、土大黄苷(批号110794-201306)对照品(中国食品药品检定研究院)。草豆蔻药材购自江西樟树药材市场,经鉴定为姜科植物草豆蔻Alpinia katsumadai Hayata 的干燥近成熟种子 (含有量按干燥品计算),并且其中山姜素、乔松素和小豆蔻明的总含有量为1.40%,桤木酮的含有量为0.61%,符合《中国药典》2010 年版要求。甲醇、乙腈和甲酸均为色谱纯 (美国Sigma-Aldrich 公司);纯化水(Milli-Q® 超纯水器制备,美国Millipore 公司)。
1.3 实验动物 雄性SD 大鼠,体质量(220 ±20)g (湖南斯莱克景达实验动物有限公司,许可证号SCXK [湘]2009-0004)。
2 方法与结果
2.1 色谱条件 Phenomenex® Luna C18色谱柱(150 mm×2.0 mm,3 μm);流动相为乙腈-0.1%甲酸水溶液(20 ∶80),等度洗脱;体积流量0.4 mL/min;柱温40 ℃;自动进样器样品室温度4 ℃;进样量3 μL;数据采集时间6 min。
2.2 质谱条件 电喷雾离子源;正离子检测模式;喷雾电压5 000 V;脱溶剂气温度500 ℃;脱溶剂气、喷雾气及气帘气均为零级空气,压力分别为60、50、20 psi;碰撞气为高纯氮气,压力为6 psi;多反应监测(MRM)检测离子,山姜素和小豆蔻明的定量离子对均为m/z 271.1→167.2,土大黄苷(内标物)为m/z 421.2→259.1,三者化学结构见图1,子离子扫描图见图2。然后,对其解簇电压(DP)、碰撞能量(CE)、入口电压(EP)和出口电压(CXP)进行优化,结果见表1。
图1 山姜素、小豆蔻明及土大黄苷的化学结构Fig.1 Chemical structures of alpinetin,cardamonin and rhapontin

图2 山姜素、小豆蔻明和土大黄苷的子离子扫描图Fig.2 Product ion spectra of alpinetin,cardamonin and rhapontin

表1 质谱条件参数优化结果Tab.1 Optimized result of mass parameters
2.3 对照品溶液的配制 分别精密称取山姜素和小豆蔻明对照品各10.0 mg,置于100 mL 量瓶中,加甲醇溶解,稀释至刻度,摇匀,制成100 μg/mL对照品贮备液。然后,精密吸取适量,置于量瓶中,加甲醇稀释,制成10、50、200、500、2 500、5 000、10 000 ng/mL 标准液。再精密称取土大黄苷对照品10.0 mg,置于100 mL 量瓶中,加甲醇溶解并稀释至刻度,摇匀,制成100 μg/mL 内标贮备液。然后,精密吸取1 mL,置于100 mL 量瓶中,加甲醇溶解,稀释至刻度,摇匀,制成1 μg/mL内标溶液,即得,保存于4 ℃冰箱中。
2.4 血浆样品的处理 精密吸取大鼠血浆100 μL,置于1.5 mL 离心管中,分别加入乙腈100 μL、土大黄苷内标溶液 (1 μg/mL)100 μL、乙腈700 μL,涡旋混合1 min,再置于高速离心机内离心5 min (13 000 r/min)。然后,精密吸取上清液500 μL,氮吹仪吹干,加5%甲醇溶液500 μL 复溶,上Waters Oasis® HLB 固相萃取柱(先用甲醇1 mL预洗,再加水3 mL 冲洗),5%甲醇溶液1 mL 淋洗,弃去淋洗液,再加50%甲醇1 mL 洗脱,收集洗脱液,氮吹仪吹干,加流动相500 μL 复溶,溶液经0.22 μm 微孔滤膜过滤,取其中3 μL 注入液质联用仪中进行分析。
2.5 方法学考察
2.5.1 专属性试验 分别取空白血浆、空白血浆加山姜素、小豆蔻明和土大黄苷(内标物)以及给药30 min 后的大鼠血浆适量,按“2.4”项下方法制成样品溶液分析,结果见图3。在“2.1”项色谱条件下,山姜素、小豆蔻明、土大黄苷内标的保留时间分别为4.3、5.4、3.1 min,表明血浆内源性物质对待测组分无干扰。
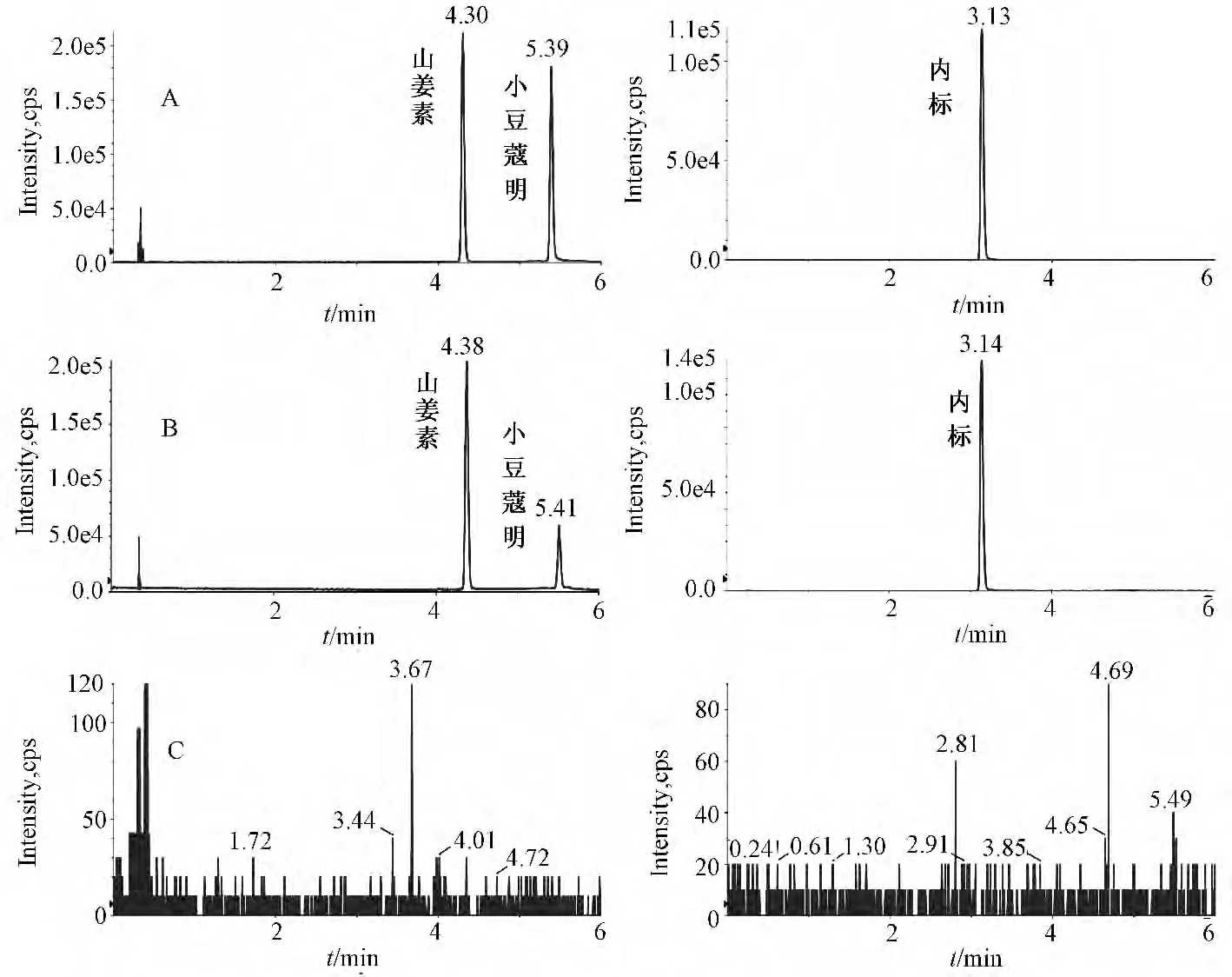
图3 典型MRM 色谱图Fig.3 Typical MRM chromatograms
2.5.2 线性关系、检出限与定量限 精密吸取空白血浆100 μL,置于1.5 mL 离心管中,分别加入山姜素和小豆蔻明混合标准溶液100 μL、土大黄苷内标溶液(1 μg/mL)100 μL 和乙腈700 μL,按“2.4”项下方法制成含山姜素和小豆蔻明1、5、20、50、250、500、1 000 ng/mL 的标准溶液。然后,分别精密吸取3 μL,注入液质联用仪中测定,以山姜素和小豆蔻明质量浓度为横坐标(c),其与内标峰面积比值为纵坐标(y),采用Analyst©1.5.2 工作站,以1/x2权重拟合标准曲线。结果,山姜素的标准曲线方程为y=0.002 53c+0.005 62,r=0.997 2,而小豆蔻明的标准曲线方程为y =0.001 98c+0.006 53,r =0.996 2,两者线性范围均在1 ~1 000 ng/mL 之间。另外,这两种成分在血浆样品中的最低检出限质量浓度均为0.05 ng/mL,最低定量限质量浓度均为0.2 ng/mL(n=6)。
2.5.3 日内及日间精密度 精密吸取空白血浆100 μL,加入混合标准品溶液,按“2.4”项下方法制成质量浓度分别为5、250、800 ng/mL 的质控样品,进样分析,结果见表2,表明仪器的精密度良好。
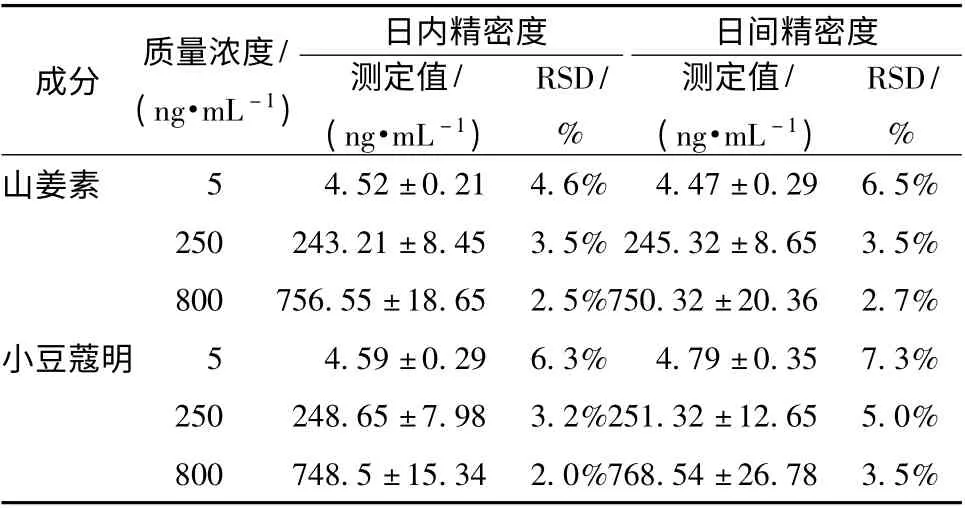
表2 山姜素和小豆蔻明的日内和日间精密度试验Tab.2 Intra-day and inter-day precision tests of alpinetin and cardamonin
2.5.4 稳定性试验 空白血浆中加入混合标准品溶液,按“2.4”项下方法制成质量浓度分别为5、250、800 ng/mL 的质控样品,每个质量浓度各3份。第一份质控样品反复冰冻(-80 ℃)—解冻(20 ℃)3 次,以考察其冻融稳定性;第二份质控样品放置在20 ℃环境下24 h,以考察其短期稳定性;第三份质控样品放置在-80 ℃冷冻柜中15 d,以考察其长期冻存稳定性。结果显示,3 个质量浓度样品的RSD 均小于8%,表明山姜素和小豆蔻明在上述条件下均无明显降解。
2.5.5 基质效应 取空白血浆适量,按“2.4”项下方法制成空白溶液,再分别加入“2.3”项下的山姜素、小豆蔻明及土大黄苷对照品溶液,得到山姜素和小豆蔻明质量浓度分别为5、250、800 ng/mL 的样品溶液,注入液质联用仪,记录基质中两者的峰面积。然后,取其50% 甲醇溶液 (5、250、800 ng/mL),注入液质联用仪,记录峰面积,再将基质和50%甲醇中待测物的峰面积相除,用于计算基质效应(%)。结果,小豆蔻明和山姜素的平均基质效应分别为94.6%和93.4%,RSD均小于5%,表明该方法无显著基质效应。
2.5.6 方法回收率 取空白血浆18 份,每份100 μL,分成低、中、高3 个浓度组,每组6 份,加入质量浓度分别为50、2 500、8 000 ng/mL 的山姜素和小豆蔻明混合标准溶液100 μL、土大黄苷内标溶液 (1 μg/mL)100 μL 及乙腈700 μL,按“2.4”项下方法制成质量浓度分别为5、250、800 ng/mL 的质控样品,每个样品6 份,测定其中山姜素和小豆蔻明的浓度,并计算回收率,结果见表3,表明该方法准确可靠。
表3 大鼠血浆中山姜素和小豆蔻明的回收率(±s,n=6)Tab.3 Recoveries of alpinetin and cardamonin in rat plasma (±s,n=6)
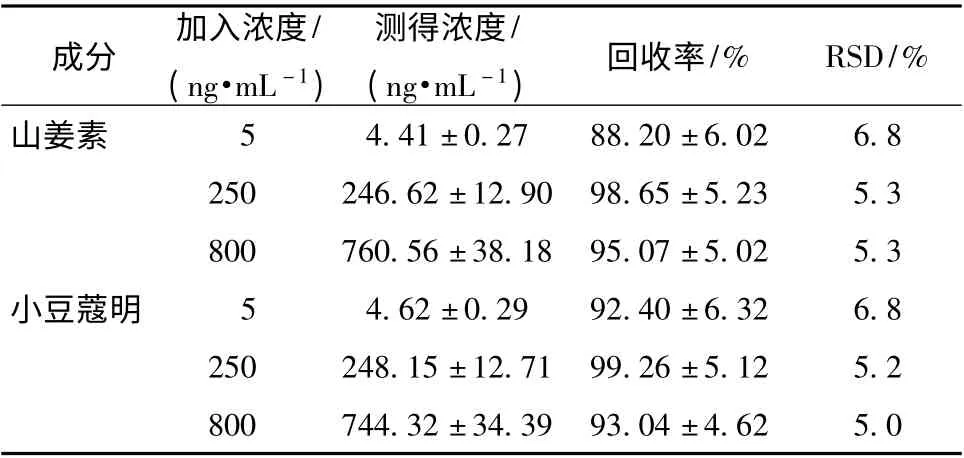
表3 大鼠血浆中山姜素和小豆蔻明的回收率(±s,n=6)Tab.3 Recoveries of alpinetin and cardamonin in rat plasma (±s,n=6)
成分 加入浓度/(ng·mL -1)测得浓度/(ng·mL -1) 回收率/% RSD/%5 4.41 ±0.27 88.20 ±6.02 6.8 250 246.62 ±12.90 98.65 ±5.23 5.3 800 760.56 ±38.18 95.07 ±5.02 5.3小豆蔻明 5 4.62 ±0.29 92.40 ±6.32 6.8 250 248.15 ±12.71 99.26 ±5.12 5.2山姜素800 744.32 ±34.39 93.04 ±4.62 5.0
2.6 草豆蔻提取物溶液的制备及药动学研究
2.6.1 草豆蔻提取物溶液的制备 取草豆蔻0.2 kg,粉碎,过三号筛,加10 倍量70%乙醇,回流提取1 h,过滤,减压浓缩至滤液无醇味,加1.5%羧甲基纤维素钠溶液,稀释至1 000 mL,混匀,即得。然后,参考《中国药典》2010 年版,测定其中山姜素和小豆蔻明的含有量,结果每1 mL提取物溶液中含山姜素1.02 mg/mL,含小豆蔻明0.55 mg/mL。
2.6.2 药动学研究 取SD 大鼠6 只,给药前12 h禁食不禁水,灌胃给予草豆蔻提取物(含5 mg/kg 山姜素和2.5 mg/kg 小豆蔻明)。然后,分别于给药前及给药后0.083、0.33、0.5、1.5、2、4、6、8 h 眼眶取血约0.4 mL,置于1 mL 肝素钠离心管中,涡旋2 s,离心10 min (转速2 500 r/min), -20 ℃下保存备用。当测定血药浓度时,取血浆100 μL,按“2.4”项下方法制成待测溶液,进样分析,DAS 3.0 软件绘制药时曲线,以非房室模型来计算药动学参数,结果见图4 和表4。
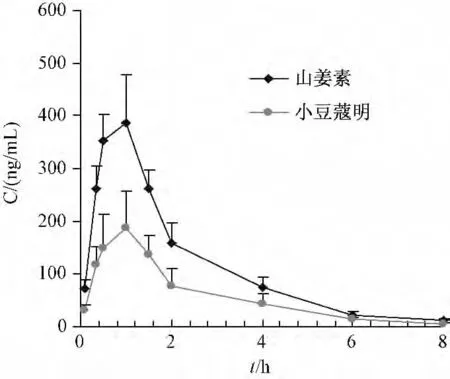
图4 灌胃给药后山姜素和小豆蔻明在大鼠体内的平均血药浓度-时间曲线图(±s,n=6)Fig.4 Mean plasma concentration-time curve of alpinetin and cardamonin in rats after intragastric administration (±s,n=6)
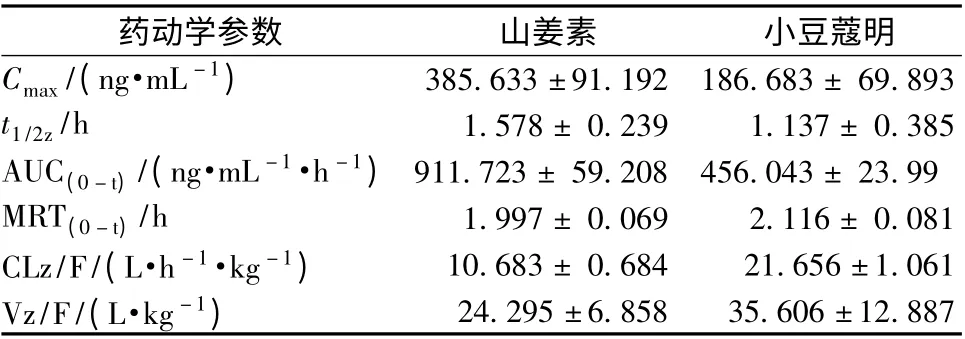
表4 灌胃给药后山姜素和小豆蔻明在大鼠体内的主要药动学参数Tab.4 Main pharmacokinetic parameters of alpinetin and cardamonin in rats after intragastric administration
3 讨论
本实验比较了两种血浆样品中乙腈沉淀蛋白和乙腈沉淀蛋白后固相萃取以去除内源性干扰物的前处理方法,其中,固相萃取比较时采用Aglea Cleanert® C18和Waters Oasis® HLB 固相萃取柱。结果显示,仅用乙腈去除蛋白的效果不理想,故选择乙腈去除蛋白后再上固相萃取柱。另外还发现,Waters HLB 固相萃取柱能有效消除基质干扰,并且有更好的回收率。
之后,又比较了乙腈-水和乙腈-0.1%甲酸水溶液,发现当采用后者作为流动相时,各待测物的灵敏度显著提高,背景噪声得到有效抑制,而且峰形较好。因此,以乙腈-0.1% 甲酸水溶液(20 ∶80)作为测定血浆中待测物的流动相。
同时,还比较了正、负离子电离模式的质谱条件。结果发现,当采用正离子模式检测待测物及内标离子时,强度高、重复性好,表明该模式更为可靠。另外,通过对山姜素、小豆蔻明和土大黄苷进行子离子扫描,可知山姜素和小豆蔻明的母离子m/z 均为271.1,而且均产生m/z 为167.2 的子离子碎片,故采用m/z 271.1→167.2 定量离子对进行检测;土大黄苷内标m/z 421.2→259.1 离子对的响应较高,故采用该定量离子对进行检测。
由于山姜素和小豆蔻明为同分异构体,均为黄酮类成分,而且结构相似,因此两者在大鼠体内代谢的特性相似。由药动学数据及药时曲线可知,灌胃给药后,两者均在大鼠体内吸收迅速,然后很快在血浆中达到峰值浓度,代谢速率较快。
本实验建立了专属性强、灵敏度高的UHPLCESI-MS/MS 法,用于测定大鼠血浆中山姜素和小豆蔻明的含有量,并对其进行了充分验证。结果显示,该方法操作简单、回收率好、精密度高,适合测定大批量血浆样品,可应用于山姜素和小豆蔻明的药代动力学研究。
[1] 国家药典委员会. 中华人民共和国药典:2010 年版一部[S]. 北京:中国医药科技出版社,2010 :222.
[2] 霍美霞. 山姜素体外体内抗炎作用研究[D]. 长春:吉林大学,2013.
[3] 叶丽香,阮冠宇,李 鹏. 草豆蔻中总黄酮体外抗肿瘤活性研究[J]. 海峡药学,2012,24(6):263-264.
[4] 李元圆,杨 莉,王长虹,等. 草豆蔻化学成分及体外抗肿瘤作用研究[J]. 上海中医药大学学报,2010,24(1):72-75.
[5] 杨 健,戴 岳,黄文哲,等. 草豆蔻抗脓毒症有效成分研究[J]. 中药药理与临床,2008,24(3):54-57.
[6] 丁杏苞,仲 英,王晓静,等. 草豆蔻化学成分的研究(Ⅰ)[J]. 中草药,1997,28(6):333.
[7] Huo M,Chen N,Chi G,et al. Traditional medicine alpinetin inhibits the inflammatory response in Raw 264.7 cells and mouse models[J]. Int Immunopharmacol,2012,12(1):241-248.
[8] Qin Y,Sun C Y,Lu F R,et al. Cardamonin exerts potent activity against multiple myeloma through blockade of NF-kappaB pathway in vitro[J]. Leuk Res,2012,36(4):514-520.
[9] Park M K,Jo S H,Lee H J,et al. Novel suppressive effects of cardamonin on the activity and expression of transglutaminase-2 lead to blocking the migration and invasion of cancer cells[J].Life Sci,2013,92(2):154-160.
[10] 李爱峰,李晓鹏,孙爱玲,等. 高速逆流色谱分离纯化草豆蔻中山姜素和小豆蔻明[J]. 中草药,2011,42(4):687-690.
[11] 邹毓兰,吕海涛. 草豆蔻中山姜素和小豆蔻明的HPLC 测定及提取工艺优化[J]. 中成药,2011,33(1):145-148.
[12] 梁嘉敏,何敬愉,彭 维,等. HPLC 法测定草豆蔻中山姜素、小豆蔻明的含量[J]. 中药材,2007,30(3):299-300.
[13] Wang S,Zhou L,He W,et al. Separation and determination of alpinetin and cardamonin by reverse micelle electrokinetic capillary chromatography[J]. J Pharm Biomed Anal,2007,43(4):1557-1561.
