活血通腑方对术后腹腔粘连大鼠单核细胞趋化蛋白-1 及CD40/CD40L的影响
2015-01-13李文林毛春芹宁子琬
曾 莉, 颜 帅, 李文林, 毛春芹, 宗 阳, 宁子琬, 杨 斓
(1. 南京中医药大学第一临床医学院,江苏 南京210023;2. 南京中医药大学图书馆,江苏 南京210023;3. 南京中医药大学药学院,江苏 南京210023)
术后腹腔粘连(Postoperative Peritoneal Adhesion,PPA)是指盆、腹腔外科术后因腹膜损伤后形成处于分离状态的腹腔脏器或与腹壁间的异常纤维带,该病除发病率较高,可引起诸如慢性疼痛、机械性肠梗阻、女性不孕以及增加二次手术风险等严重并发症,给患者精神和经济上带来双重负担[1-2]。如何避免或减少术后腹腔粘连的发生,是外科学者们一直以来研究的热点。近年有文献表明,手术和外伤深刻地影响着机体先天免疫和适应性免疫反应[3],但既往的研究工作虽提出免疫因素参与并启动腹腔粘连的过程,但是对术后腹膜损伤激活免疫的触发点研究涉及较少。虽众多学者发现多种信号通路如以调控转化生长因子TGF-β1 为主体的Smad通路[4]、以调控肿瘤坏死因子TNF-α 为中心的NFκB 通路、JAK/STAT 通路[5-6],以影响纤维细胞结缔组织生长因子(CTGF)表达为主体的RhoA/ROCK-MAPK 通路[7]。众多信号途径与术后粘连的病程有关,然而不同信号通路有没有一个共同的触发点尚未见报道,因此课题组对影响腹腔粘连的进展进行实验研究,并对其可能的机制进行探讨。
腹腔粘连与炎症和免疫密不可分,手术和创伤不仅仅是对机体造成炎症损害,炎症细胞的过度激活以及炎症介质的大量释放,一定程度上影响机体自身的免疫系统[3]。既往国外对免疫因素在腹腔粘连中的研究多集中在整体动物模型水平,目的细胞集中在肥大细胞、巨噬细胞和淋巴细胞群等,尚未见有关免疫指标在血及粘连组织中的测定。炎症反应不仅仅存在于腹部术后早期,在术后粘连形成过程中一直存在[8-9]。CD40/CD40L 是机体免疫、炎症反应中的一条重要细胞信号转导途径,在免疫应答的启动和放大中起着重要作用,在免疫平衡的调节中不可或缺[10]。
课题组前期在临床疗效观察基础上,从整体动物水平研究发现,活血通腑方能下调实验性腹腔粘连大鼠术后血浆纤维蛋白原[11-12]、TGF-β mRNA[13]表达水平,防治粘连效果确切。鉴于CD40/CD40L 位于细胞因子调控网络的上游,该信号通路的激活是使炎症反应逐步放大的关键环节。本实验研究活血通腑方对术后腹腔粘连大鼠MCP-1 趋化因子及CD40/CD40L 信号系统转导在术后腹腔粘连的发病过程中的作用,验证活血通腑方是否是通过调控CD40/CD40L 系统从而促进恢复机体炎症反应,从而为活血通腑方在防治术后腹腔粘连的应用提供更充分的理论依据。
1 材料与方法
1.1 试验药物 活血通腑方组成:大黄、桃仁、芒硝、延胡索、莱菔子、红花,购自安徽丰原铜陵中药饮片有限公司,经南京中医药大学炮制实验室陆兔林教授鉴定为质量标准符合要求的道地药材。相关样品液的制备方法参照文献[14],根据实验需要进行放大,共计350 副(包括含药血清实验)中药,取所得浸膏浓缩至相对密度1.12 ~1.15(60 ℃),放置于4 ℃冰箱备用。四磨汤口服液:每瓶含生药4.6 g,湖南汉森制药股份有限公司生产,批号国药准字130632235。
1.2 动物 健康雄性SD 大鼠150 只,体质量220 ~250 g,由江苏大学动物中心提供(清洁级),合格证号SCXK-(苏)2013-0011。实验过程中对动物的处置符合科技部《关于善待实验动物的指导性意见》[15]的规定。大鼠实验前于动物房适应环境5 d,自由采食和饮水,室温18 ~25 ℃,相对湿度65% ~70%,照明昼夜明暗交替。
1.3 试剂 10%水合氯醛麻醉剂(国药集团化学试剂有限公司);CD40,CD40L (美国eBioscience公司)和MCP-1 单克隆抗体 (美国Millipore 公司);ElivisionTMsuper 免疫组化检测试剂盒(福建迈新生物技术有限公司);DEPC 水(GENERAY Biotechnology 公司);PBS 缓冲液(自行配制);其他试剂均为国产分析纯。
1.4 仪器 流式细胞仪为美国Beckman Counter 公司FC500 型;Image-Pro Plus 6.0 专业图像分析系统(美国Media Cybernetics. Inc);EDTA 抗凝管(奥地利格雷那公司);什锦锉刀(上海力易得工具有限公司);Leica ASP300S 全自动真空组织脱水机(德国Leica 公司);Thermo 包埋机(美国Thermo Fisher Scientific 公司,型号Histostar);Thermo 手动切片机(美国Thermo Fisher Scientific 公司,型号Finesse E);Shandon 全自动染色机(美国Thermo Fisher Scientific 公司);OLYMPUS 显微镜BX41(日本Olympus 公司)。
1.5 方法 参考文献[14],将180 只大鼠随机分为假手术组,模型组,活血通腑方低、中、高剂量组,四磨汤组6 组,每组6 只。造模前各组大鼠禁食12 h,不禁水。用10% 水合氯醛腹腔注射(0.3 mL/kg)麻醉,动物麻醉后仰卧位固定,腹部剪毛、消毒后,无菌操作下取前正中切口2 cm进腹;除假手术组外,其余各组回盲部右侧面用什锦锉刀反复磨擦浆膜层至表面针尖状出血点,形成约5 cm × 4 cm 的受损创面后纳入腹腔,假手术组大鼠,用无齿镊钳夹将回盲部肠管拉出腹腔外,充分暴露3 min 后复位,各组逐层关腹,分笼饲养。每只大鼠从造模开始到关腹,时间控制在5 min,术中各项生命体征平稳。造模后6 h,活血通腑方低、中、高剂量组造模大鼠按体表面积换算后,分别给予活血通腑方2、6、18 g/kg 药液灌胃,四磨汤组给予5.40 g/kg 口服液灌胃,灌胃药液温度均控制在38 ℃左右。假手术组和模型组均予等容量生理盐水灌胃,1 次/d,共14 d。
1.5.1 肉眼腹腔粘连和镜下病理评分 分别于术后1、3、5、7、14 d 每组随机各取6 只大鼠,采用颈椎脱臼法处死,剑突下“U”型切口进腹,分别从粘连数目、粘连范围、粘连强度五分级标准观察粘连情况,由第三方分别记录粘连得分;取处死大鼠肠创面处粘连组织,10%福尔马林溶液固定,石腊包埋切片,HE 染色,镜检病理改变,由南京医科大学附属医院病理科医师(未参与实验)进行评分。肉眼腹腔粘连评分标准[16-17]和镜下病理评分标准[18]分别见表1 和表2。

表1 肉眼腹腔粘连分级标准Tab.1 Macroscopic peritoneal adhesion grading standard

表2 镜下病理评分标准Tab.2 Pathological grading standard
1.5.2 流式细胞术检测外周血CD40、CD40L 水平各组大鼠分别在1、3、5、7、14 d 眼球取血,EDTA 抗凝收集,取100 μL 的抗凝血移置EP 管中,红细胞裂解液复温后,各EP 管加入1 mL 红细胞裂解液,室温下裂解10 min,然后PBS 分别清洗;其中CD40L 组EP 管先后加入含有5 μL Rb pAb to CD40L (abcam)和10 μL Dnk pAb to Rb IgG(Alexa Fluor@647)的离心管中震匀,于4 ℃下保存30 min 以孵育抗体。PBS 清洗各组EP 管,以300 ×g 常温离心机离心5 min,弃上清。CD40 组各管中分别加入40 μL Anti-Mouse/Rat CD40 FITC(eBioscience Inc. San Diego,CA),用旋涡混合仪(XW-80A)将EP 管震匀,4 ℃下避光孵育30 min。Eppendorf 离心机300 ×g 离心5 min 后,弃上清。适量PBS 同上进行离心,反复几次,以试管底部不见红色为度,过滤后定容至900 μL 后,移至流式管上机待测。
1.5.3 免疫组化检测粘连组织中CD40、CD40L、MCP-1 蛋白表达水平 断椎处死大鼠,剪取粘连组织(假手术组无粘连形成,均取相同部位盲肠组织)置于4%多聚甲醛固定。各样本经脱水、石蜡包埋后做成厚约4 μm 切片。之后行ENVISION 法染色检测CD40、CD40L、MCP-1 在大鼠肠组织的表达情况。步骤如下:石蜡切片脱蜡至水,3%H2O2室温封闭10 min,抗原修复,滴加50 μL 聚合物增强剂(试剂A),室温下孵育20 min,PBS洗两次。滴加50 μL 酶标抗兔聚合物(试剂B),室温下孵育30 min,再次PBS 冲洗两次。每张切片滴加100 μL 新鲜配制的DAB 溶液,显微镜下观察1 ~3 min,阳性显色为棕色。蒸馏水洗终止染色,苏木素复染,梯度酒精脱水,二甲苯透明,封片。每张切片随机选取不重叠的5 个高倍视野拍照,用Image Pro Plus 6.0 专业图像分析软件,进行半定量分析,测定各组积分光密度值(IOD)。
1.6 统计学分析 采用SPSS 15.0 统计软件行数据分析,实验数据均以mean ±SD 表示,肉眼和镜下评分因呈非正态分布,故采用Kruskal-Wallis 检验,P <0.05 有统计学意义。组间差异性比较采用单因素方差分析,组间两两比较,方差齐性采用LSD 检验,方差不齐用Tamhane’s T2 检验。
2 结果
2.1 一般情况观察 术后各组大鼠未出现死亡,腹部切口愈合良好,无渗出、红肿和切口疝发生。术后24 h,各组大鼠一般情况均差,不活动,少量进食、饮水。术后2 d,一般状态尚可,活动量较前增加,进食和饮水基本恢复正常。术后第3 天起,体质量呈上升趋势,腹部创面缝线逐渐脱落,活动恢复正常,进食和水量正常。各组大鼠体质量随时间逐渐增加,活血通腑方各组和四磨汤组大鼠体质量增长趋势与假手术和模型组相比较缓慢,但各组间相比统计学无明显差异。
2.2 各时间点各组大鼠腹腔粘连分级评分 如图1 所示,在术后第1 天,除假手术组外,其余各组均见粘连形成,尤以模型组明显(1.17 ±0.39)。模型组第3 天和第5 天,粘连范围局限,粘连程度疏松,多呈膜状粘连,各治疗组可不同程度降低肉眼腹腔粘连评分。术后第7 天模型组,粘连范围增大,韧性较前有所增加,部分粘连偶见伴生血管。活血通腑方低、高剂量组和四磨汤组见粘连数目减少,疏松,未见血管生成。术后第14 天,粘连范围和第7 天相比有所扩大,韧性无明显差异,粘连评分为(5.60 ±0.75)。各治疗组和模型组相比较,不同程度改善腹腔粘连程度,其中活血通腑方高剂量组腹腔粘连评分存在显著性差异(P <0.01)。术后第3 天和术后第5 天,术后第7 天和第14 天相比,除模型组和活血通腑方高剂量组以外,其余各组粘连评分无明显统计学意义(P >0.05)。
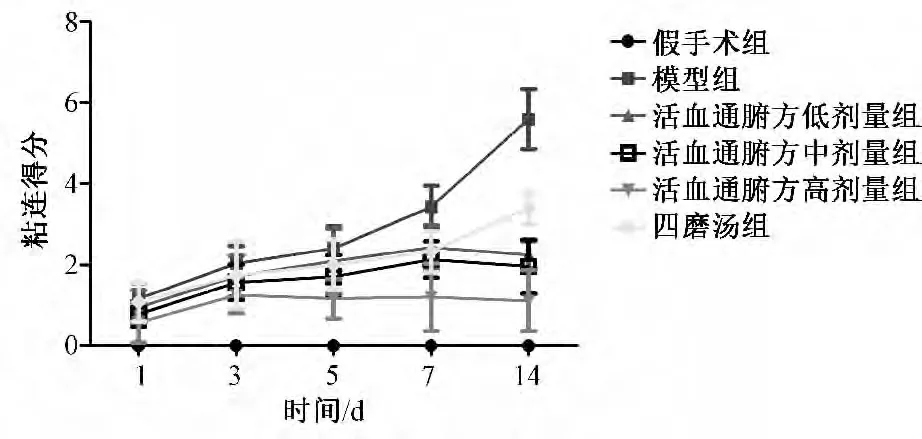
图1 各组各时间点腹腔粘连级别评分Fig.1 Each time point of peritoneal adhesion scores of groups
2.3 各组大鼠病理损伤评分 由图2 可知,术后第1 天,与假手术组和各治疗组,模型组ICR 和IF 评分显著增多。术后第3 天,各组主要表现为炎性细胞不同程度的浸润,组织水肿。术后第5天,镜下表现以炎性反应为主。术后第7 天,各组主要表现为慢性炎症和纤维增生,镜下可见梭形平滑肌样细胞。与模型组相比,活血通腑方组和四磨汤组均能降低镜下评分,有统计学意义 (P <0.05)。活血通腑方低、中、高剂量组与四磨汤组相比,活血通腑方高剂量组具有显著意义(P <0.01)。从表3 可以得出,除假手术组外,术后第1、7、14 天各组间ICR 评分相比无明显差异(P >0.05),而术后第7、14 天同组间相比亦无明显差异。术后第1、3、5、7 天活血通腑高剂量组能不同程度降低镜下炎症评分,术后第14 天不明显(P <0.05)。表明术后第1、3、5、7 天活血通腑高剂量组能减轻粘连部位的炎症反应。从表4 可以得出,第1、5、14 天各组与模型组相比IF 评分无显著性差异,术后第3、7 天各组与模型组相比,IF 评分具有统计学意义(P <0.05),假手术组除外。提示术后第3、7 天活血通腑方各组能降低粘连部位的IF 评分。
表3 各组不同时间点ICR 评分(±s,n=6)Tab.3 Scores in inflammatory cell reaction at time point of groups (±s,n=6)

表3 各组不同时间点ICR 评分(±s,n=6)Tab.3 Scores in inflammatory cell reaction at time point of groups (±s,n=6)
注:与同时间点模型组比较,* P <0.05
组别1 d 3 d 5 d 7 d 14 d假手术组 0.00 ±0.00 0.00 ±0.00 0.00 ±0.00 0.00 ±0.00 0.00 ±0.00模型组 2.80 ±0.13 1.67 ±0.38 1.53 ±0.21 0.67 ±0.47 0.33 ±0.27活血通腑方低剂量组 2.60 ±0.16 1.44 ±0.40 0.97 ±0.33 0.75 ±0.68 0.59 ±0.55活血通腑方中剂量组 2.30 ±0.15 1.24 ±0.61 0.87 ±0.13 0.66 ±0.29 0.36 ±0.30活血通腑方高剂量组 2.2 ±0.13* 0.90 ±0.50* 0.72 ±0.26* 0.58 ±0.31* 0.41 ±0.40四磨汤 2.40 ±0.16 1.39 ±0.92 1.03 ±0.19 0.97 ±0.48 0.6 4 ±0.50
表4 各组不同时间点IF 评分(±s,n=6)Tab.4 Scores in interstitial fibrosis at time point of groups (±s,n=6)
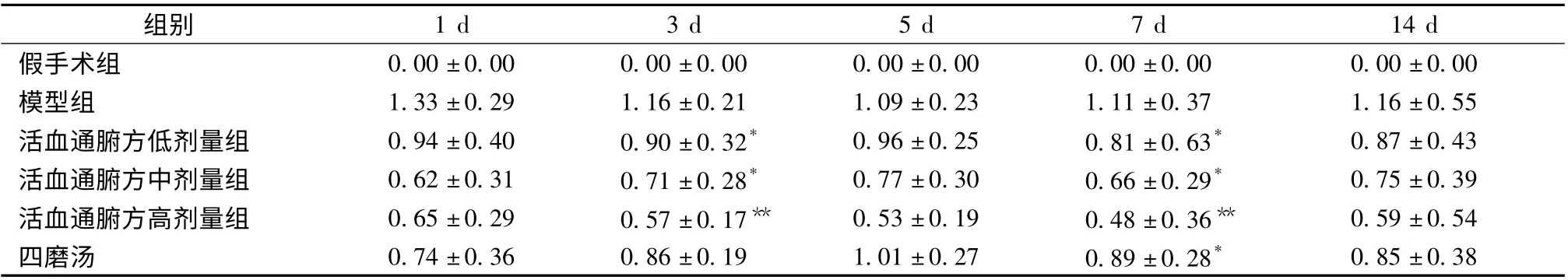
表4 各组不同时间点IF 评分(±s,n=6)Tab.4 Scores in interstitial fibrosis at time point of groups (±s,n=6)
注:与同时间点模型组比较,* P <0.05,**P <0.01
组别1 d 3 d 5 d 7 d 14 d假手术组 0.00 ±0.00 0.00 ±0.00 0.00 ±0.00 0.00 ±0.00 0.00 ±0.00模型组 1.33 ±0.29 1.16 ±0.21 1.09 ±0.23 1.11 ±0.37 1.16 ±0.55活血通腑方低剂量组 0.94 ±0.40 0.90 ±0.32* 0.96 ±0.25 0.81 ±0.63* 0.87 ±0.43活血通腑方中剂量组 0.62 ±0.31 0.71 ±0.28* 0.77 ±0.30 0.66 ±0.29* 0.75 ±0.39活血通腑方高剂量组 0.65 ±0.29 0.57 ±0.17** 0.53 ±0.19 0.48 ±0.36** 0.59 ±0.54四磨汤 0.74 ±0.36 0.86 ±0.19 1.01 ±0.27 0.89 ±0.28*0.85 ±0.38

图2 各组不同时间点典型病理切片Fig.2 Typical microscopic section at time point of groups
2.4 各组不同时间在单核细胞CD40、CD40L 表达水平 经红细胞裂解液后,流式检测外周血细胞分群良好,在单核细胞群上CD40、CD40L 表达差异显著。从表5 和表6 可知,与假手术组相比,模型组分别在术后各时间点单核细胞CD40、CD40L 的表达升高明显(P <0.01)。活血通腑方各组在各个时间点能不同程度降低单核细胞CD40、CD40L的表达水平(P <0.05),尤以活血通腑高剂量组明显(P <0.01)。四磨汤组仅在术后第1 天单核细胞CD40 表达水平与模型组相比有统计学意义(P <0.05),但在不同时间点却能不同程度降低单核细胞CD40L 的表达水平(P <0.05)。
表5 各组不同时间单核细胞CD40 表达比较(±s,n=6)Tab.5 Comparison between the expressions of mononuclear cell CD40 at time points of groups (±s,n=6)

表5 各组不同时间单核细胞CD40 表达比较(±s,n=6)Tab.5 Comparison between the expressions of mononuclear cell CD40 at time points of groups (±s,n=6)
注:与同时间点模型组比较,* P <0.05,**P <0.01
组别1 d 3 d 5 d 7 d 14 d假手术组 20.02 ±5.07 16.78 ±5.12 14.58 ±2.42 13.28 ±1.519.94 ±0.47模型组 45.65 ±5.32 35.86 ±2.13 33.17 ±2.95 32.09 ±4.42 29.25 ±4.55活血通腑方低剂量 37.90 ±8.37* 29.64 ±5.22* 29.10 ±2.68* 25.38 ±6.37* 20.24 ±5.01*活血通腑方中剂量 34.73 ±6.65* 27.30 ±4.71* 24.37 ±3.61* 22.11 ±4.12* 18.34 ±3.32*活血通腑方高剂量 30.51 ±4.57** 24.28 ±5.04** 21.69 ±2.86** 19.89 ±0.31** 15.65 ±2.72**四磨汤 38.03 ±6.70* 35.23 ±4.06 32.38 ±4.63 28.02 ±2.59 25.20 ±1.99
表6 各组单核细胞CD40L 表达比较(±s,n=6)Tab.6 Comparison between the expressions of mononuclear cell CD40L at time point of groups (±s,n=6)
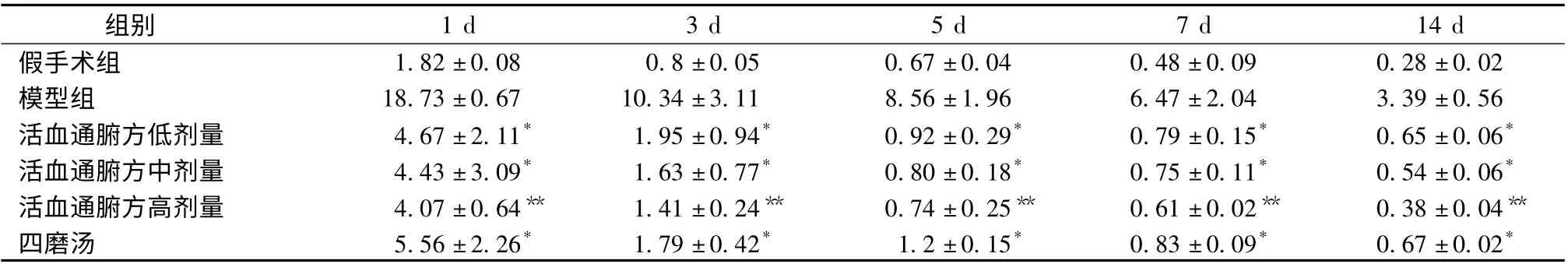
表6 各组单核细胞CD40L 表达比较(±s,n=6)Tab.6 Comparison between the expressions of mononuclear cell CD40L at time point of groups (±s,n=6)
注:与同时间点模型组比较,* P <0.05
组别1 d 3 d 5 d 7 d 14 d假手术组 1.82 ±0.08 0.8 ±0.05 0.67 ±0.04 0.48 ±0.09 0.28±0.02模型组 18.73 ±0.67 10.34 ±3.11 8.56 ±1.96 6.47 ±2.04 3.39 ±0.56活血通腑方低剂量 4.67 ±2.11* 1.95 ±0.94* 0.92 ±0.29* 0.79 ±0.15* 0.65 ±0.06*活血通腑方中剂量 4.43 ±3.09* 1.63 ±0.77* 0.80 ±0.18* 0.75 ±0.11* 0.54 ±0.06*活血通腑方高剂量 4.07 ±0.64** 1.41 ±0.24** 0.74 ±0.25** 0.61 ±0.02** 0.38 ±0.04**四磨汤 5.56 ±2.26* 1.79 ±0.42* 1.2 ±0.15* 0.83 ±0.09* 0.67 ±0.02*
2.5 各组粘连组织中CD40、CD40L、MCP-1 蛋白在不同时间点表达水平 与假手术相比,各时间点PA 模型组CD40、CD40L 水平显著增加;与模型组相比,四磨汤组在不同时间点不同程度降低CD40、CD40L 水平,以术后第1、14 天明显;活血通腑方各组呈剂量依赖性降低CD40、CD40L 水平,尤以活血通腑方高剂量组显著(P <0.01)。同组内不同时间点相比,CD40、CD40L 水平仅在术后第1 天和术后第14 天相比,具有统计学意义(P <0.05),在术后第3、5 和7 天无明显差异(P >0.05)。各组MCP-1 蛋白水平与模型组相比亦随时间的推移逐渐降低,同一时间点不同组相比,以活血通腑方中、高剂量组有明显统计学意义(P <0.01);而同组不同时间点相比术后第1、3、14 天具有统计学意义(P <0.05)。见图3 ~4 和表7 ~9。

图3 各组不同时间粘连组织CD40 蛋白表达情况Fig.3 Expressions of CD40 protein in tissue adhesion at time point of groups

图4 各组不同时间粘连组织CD40L 蛋白表达情况Fig.4 Comparison between the expressions of CD40L protein in tissue adhesion of groups
表7 各组粘连组织CD40 蛋白表达比较(±s,n=6)Tab.7 Comparison between the expressions of CD40 protein in tissue adhesion of groups (±s,n=6)

表7 各组粘连组织CD40 蛋白表达比较(±s,n=6)Tab.7 Comparison between the expressions of CD40 protein in tissue adhesion of groups (±s,n=6)
注:与同时间点模型组比较,* P <0.05,**P <0.01
组别1 d 3 d 5 d 7 d 14 d假手术组 27.51 ±12.30 26.03 ±13.65 25.76 ±11.80 23.52 ±11.81 14.95 ±11.24模型组 126.04 ±16.27 120.41 ±16.69 115.16 ±17.94 115.99 ±14.04 100.22 ±13.12活血通腑方低剂量 90.72 ±15.52* 90.29 ±18.27* 86.85 ±15.51* 85.01 ±13.22* 66.83 ±16.46*活血通腑方中剂量 56.93 ±12.07** 55.30 ±11.71** 52.47 ±13.26** 48.11 ±13.08** 38.53 ±12.93**活血通腑方高剂量 44.11 ±12.43** 42.76 ±11.98** 42.14 ±11.34** 40.14 ±13.87** 26.89 ±10.95**四磨汤 65.71 ±11.40* 64.03 ±13.87* 61.58 ±11.25* 58.41 ±12.29* 46.62 ±12.70*
表8 各组粘连组织CD40L 蛋白表达比较(±s,n=6)Tab.8 Comparison between expressions of CD40L protein in tissue adhesion of groups (±s,n=6)

表8 各组粘连组织CD40L 蛋白表达比较(±s,n=6)Tab.8 Comparison between expressions of CD40L protein in tissue adhesion of groups (±s,n=6)
注:与同时间点模型组比较,* P <0.05,**P <0.01
组别1 d 3 d 5 d 7 d 14 d假手术组 27.38 ±10.50 27.61 ±10.41 26.58 ±11.18 23.76 ±11.11 21.37 ±11.08模型组 126.88 ±10.98 113.30 ±15.45 112.84 ±16.13 108.35 ±16.20 101.19 ±17.85活血通腑方低剂量 96.09 ±14.32* 90.37 ±11.34* 87.42 ±14.82* 85.65 ±10.74* 81.50 ±12.56*活血通腑方中剂量 59.44 ±12.13** 57.29 ±13.68** 54.97 ±11.47** 50.61 ±12.18** 49.85 ±11.42**活血通腑方高剂量 50.48 ±11.60** 46.13 ±11.91** 42.81 ±15.04** 41.78 ±13.80** 40.20 ±12.38**四磨汤 72.27 ±12.60* 71.95 ±11.23* 68.30 ±11.66* 57.04 ±14.94* 56.17 ±10.25*
表9 各组粘连组织MCP-1 蛋白表达比较(±s,n=6)Tab.9 Comparison between expressions of MCP-1 protein in tissue adhesion of groups (±s,n=6)

表9 各组粘连组织MCP-1 蛋白表达比较(±s,n=6)Tab.9 Comparison between expressions of MCP-1 protein in tissue adhesion of groups (±s,n=6)
注:与同时间点模型组比较,* P <0.05,**P <0.01
组别1 d 3 d 5 d 7 d 14 d假手术组 33.10 ±13.96 29.39 ±12.85 28.92 ±11.55 22.62 ±15.13 19.72 ±12.14模型组 123.46 ±16.64 110.50 ±12.85 110.16 ±15.78 109.27 ±17.49 104.83 ±12.78活血通腑方低剂量 93.80 ±14.17* 91.23 ±11.31* 90.37 ±12.71* 86.94 ±14.44* 85.78 ±18.50*活血通腑方中剂量 72.34 ±13.51** 69.54 ±12.98** 62.11 ±13.22** 58.64 ±13.91** 51.66 ±12.28**活血通腑方高剂量 65.54 ±13.86** 48.25 ±14.24** 46.11 ±11.99** 45.72 ±12.52** 39.86 ±13.74**四磨汤 80.15 ±102.44* 74.40 ±13.37* 63.73 ±15.20* 61.61 ±12.04* 60.18 ±13.86*
3 讨论
CD40/CD40L 是一对互补跨膜糖蛋白,两者通过结合而发挥生理学效应,该信号通路是机体免疫、炎症反应中的一条重要细胞信号转导途径,在免疫平衡的调节中不可或缺[19]。CD40 是分子量为48 ~50 kD 表达于细胞表面的白细胞分化抗原,是Ⅰ型跨膜糖蛋白,常表达于B 细胞、活化的单核细胞等免疫细胞[20],亦结构性表达于腹膜间皮细胞[21]。CD40L 是分子量为39 kD 的Ⅱ型跨膜糖蛋白,主要表达于CD4+T 细胞表面,亦表达于单核细胞、肥大细胞和NK 细胞表面[22]。虽然二者分别表达于不同细胞,但CD40L 不同于CD40 的非持续表达,需在CD40 诱导作用后表达。CD40/CD40L 交联所介导的免疫炎症细胞之间和组织间质细胞之间的相互激活、相互作用构成了组织炎症和纤维化的基础[23]。MCP-1 是趋化因子CC 亚家族的成员,近年来研究显示,趋化因子在保护宿主、炎症反应方面发挥重要作用。MCP-1 主要趋化血液中单核细胞、中性粒细胞、淋巴细胞等进入感染发生的部位。该信号通路可以激活淋巴细胞和促炎因子及趋化因子的产生,上述炎症因子及趋化因子产生后又可进一步激活CD40/CD40L系统而导致恶性循环,在细胞粘附、血栓形成、组织纤维化多种病理过程中,是触动“炎症式级联反应”的关键环节[24]。为此,调控启动机体免疫反应的共刺激,可能是防止术后粘连的一个重要途径。
腹腔粘连难以避免的一个原因就是创伤导致腹部损伤后,可导致机体对感染的易感性增加,而易感性增加的机制之一就是伤后出现的免疫功能紊乱。腹腔粘连一旦发生很难控制,难以控制的机制之一同样是由于伤后出现的免疫功能紊乱。免疫功能紊乱之所以会发生,是源于机体防御机制对创伤刺激所产生的应激反应。应激反应的原始目的是为了抵御或者清除刺激,保护机体和维持内环境的稳定。然而当创伤刺激过于强烈时,超越正常防御机制的自控能力,会出现异常应激反应。
免疫跟炎症反应通常是同时发生的,二者可以相互促进。免疫细胞可以分泌炎症介质加剧炎症,炎症过程中可以使更多免疫细胞进入组织中,免疫细胞可以分泌更多的细胞因子进一步放大免疫,本实验中HE 病理切片和大鼠外周血证实此点。模型组中单核细胞和巨噬细胞,纤维蛋白的渗出明显多于假手术组,过度的炎性水肿又使得组织功能受损。而活血通腑方各组能不同程度稀释毒素,清除致病因素,减少免疫细胞活化后释放细胞趋化因子,从而减轻炎症反应。不同炎症反应引发不同的生理学变化及不同的病理学后果[25],本实验通过锉刀法建立大鼠腹腔粘连模型,与假手术组大鼠相比,术后第1、3、5、7、14 天模型组大鼠一般状态差,手术创伤应激导致CD40 和CD40L 升高,尤其是引起模型组大鼠外周血中单核细胞CD40 和CD40L 升高。通过评估镜下病理积分发现,PPA大鼠模型炎性细胞随时间变化分布不同,推测与MCP-1 蛋白有关。免疫组化结果表明各组CD40、CD40L 和MCP-1 蛋白水平随时间推移亦呈下降趋势,模型组在术后第1、3、14 天有统计学意义,与术后腹腔粘连大鼠术后第3、5、14 天肉眼粘连评分结果趋势吻合,上述结果表明术后第1 ~3 天为重要的窗口期,此时给予活血通腑方干预可一定程度避免腹腔粘连的形成。可能的机制如下:手术创伤应激升高CD40、CD40L 等免疫细胞因子,导致免疫功能紊乱,调节炎性细胞因子失衡,最终导致大鼠腹腔粘连发生。基于以上观点,我们可以得出CD40 与CD40L 结合后启动炎性反应,包括诱导一系列与术后腹腔粘连发生有关的趋化因子等表达。
综上,活血通腑方可以通过调节不同细胞因子作用途径来影响免疫的强度,从而减少炎症对组织的不利影响。体内试验进一步佐证,阻断CD40/CD40L 信号通路可显著减轻术后腹腔粘连大鼠外周血单核细胞的浸润程度,且腹腔粘连的评分显著降低,对腹腔粘连的防治具有潜在的临床应用价值。
[1] ten Broek R P,Wilbers J,van Goor H. Electrocautery causes more ischemic peritoneal tissue damage than ultrasonic dissection[J]. Surg Endosc,2011,25(6):1827-1834.
[2] Trochsler M,Maddern G J. Adhesion barriers for abdominal surgery:a sticky problem[J]. Lancet,2014,383(9911):8-10.
[3] Kimura F,Shimizu H,Yoshidome H,et al. Immunosuppression following surgical and traumatic injury[J]. Surg Today,2010,40(9):793-808.
[4] Guo H,Leung J C,Cheung J S,et al. Non-viral Smad7 gene delivery and attenuation of postoperative peritoneal adhesion in an experimental model[J]. Br J Surg,2009,96 (11):1323-1335.
[5] Sammour T,Kahokehr A,Soop M,et al. Peritoneal damage:the inflammatory response and clinical implications of the neuroimmuno-humoral axis[J]. World J Surg,2010,34 (4):704-720.
[6] Hamming J F,Bonsing B A. Adhesiolysis during abdominal surgery:substantial risks[J]. Ned Tijdschr Geneeskd,2013,157(7):A5928.
[7] Jiang C G,Lv L,Liu F R,et al. Connective tissue growth factor is a positive regulator of epithelial-mesenchymal transition and promotes the adhesion with gastric cancer cells in human peritoneal mesothelial cells[J]. Cytokine,2013,61(1):173-180.
[8] Corona R,Verguts J,Schonman R,et al. Postoperative inflammation in the abdominal cavity increases adhesion formation in a laparoscopic mouse model[J]. Fertil Steril,2011,95(4):1224-1228.
[9] Binnebösel M,Klink C D,Serno J,et al. Chronological evaluation of inflammatory mediators during peritoneal adhesion formation using a rat model[J]. Langenbecks Arch Surg,2011,396(3):371-378.
[10] Chatzigeorgiou A,Lyberi M,Chatzilymperis G,et al. CD40/CD40L signaling and its implication in health and disease[J].Biofactors,2009,35(6):474-483.
[11] 曾 莉,俞晶华,翟亚春,等. 活血通腑方对大鼠术后血FIB、FDP 水平的影响[J]. 中国全科医学,2004,7(22):1655-1656.
[12] 曾 莉,陈卫平,凌立君,等. 活血通腑方抗实验性腹腔粘连机理研究[J]. 中国中医急症,2006,15 (6):634-636.
[13] 曾 莉,陈卫平,赵凤鸣,等. 活血通腑方对实验性腹腔粘连TGF-β mRNA 表达的影响[J]. 中医药学刊,2004,22(12):2236-2238.
[14] 颜 帅,杨 斓,曾 莉,等. 活血通腑方优化方防治大鼠术后腹腔粘连的最佳有效剂量[J]. 中国实验方剂学杂志,2014,20(9):166-170.
[15] 中华人民共和国科学技术部. 关于善待实验动物的指导性意见[S]. 2006.
[16] Phillips R K,Dudley H A. The effect of tetracycline lavage and trauma on visceral and parietal peritoneal ultrastructure and adhesion formation[J]. Br J Surg,1984,71(7):537-539.
[17] Bhatia D S,Allen J E. The prevention of experimentally induced postoperative adhesions[J]. Am Surg,1997,63(9):775-777.
[18] Mahdy T,Mohamed G,Elhawary A. Effect of methylene blue on intraabdominal adhesion formation in rats[J]. Int J Surg,2008,6(6):452-455.
[19] Chatzigeorgiou A,Lyberi M,Chatzilymperis G,et al. CD40/CD40L signaling and its implication in health and disease[J].Biofactors,2009,35(6):474-483.
[20] O'Sullivan B,Thomas R. CD40 and dendritic cell function[J]. Crit Rev Immunol,2003,23(1-2):83-107.
[21] Basok A,Shnaider A,Man L,et al. CD40 is expressed on human peritoneal mesothelial cells and upregulates the production of interleukin-15 and RANTES[J]. J Am Soc Nephrol,2001,12(4):695-702.
[22] Santilli F,Basili S,Ferroni P,et al. CD40/CD40L system and vascular disease[J]. Intern Emerg Med,2007,2 (4):256-268.
[23] Kawai M,Masuda A,Kuwana M. A CD40-CD154 interaction in tissue fibrosis[J]. Arthritis Rheum,2008,58 (11):3562-3573.
[24] Elzey B D,Ratliff T L,Sowa J M,et al. Platelet CD40L at the interface of adaptive immunity[J]. Thromb Res,2011,127(3):180-183.
[25] Medzhitov R. Origin and physiological roles of inflammation[J]. Nature,2008,454(7203):428-435.
