离子交换法提取银杏壳中果胶工艺研究
2015-01-12顾焰波汤小芳常晓垒
顾焰波,仇 菲,汤小芳,常晓垒
(南京理工大学泰州科技学院,江苏 泰州 225300)
离子交换法提取银杏壳中果胶工艺研究
顾焰波,仇 菲,汤小芳,常晓垒
(南京理工大学泰州科技学院,江苏 泰州 225300)
采用离子交换法对银杏壳中果胶进行提取。通过单因素试验和正交试验探讨了提取过程中各因素对果胶得率的影响,结果表明适宜工艺条件为:离子交换树脂用量7%,pH 2.0,提取温度85℃,提取时间2h,料液比1∶20(g∶mL)。在此工艺条件下,果胶得率为4.85%。
离子交换法;银杏壳;果胶;提取
果胶是一种亲水性植物,主要结合单元为D-毗喃半乳糖醛酸的部分甲酯化的聚合物。果胶具有抗腹泻、抗癌、治疗糖尿病、减肥的功效,是人体七大营养元素中膳食纤维的主要成分,因具有凝胶作用而被作为添加剂广泛应用于食品工业中[1],所以在食品、医药和化妆品工业中应用非常广泛。
银杏果俗称生白果,含有多种营养元素,具有益肺气、治咳喘、止带虫、缩小便、护血管等食疗作用和医用效果。白果壳作为白果深加工的主要废弃物,既污染环境又浪费资源,若进行提取并加以利用,将可以提高白果加工的经济效益,是一项极有意义的研究。目前,有关离子交换法生产果胶已见诸报道,主要有橙皮[2]、桔皮[3-4]、苹果渣[5-6]、木瓜皮[7]果胶的提取,但从银杏壳中提取尚未见报道。本文采取离子交换法从银杏壳中提取果胶,并较系统地研究工艺条件,以期为更好地开发银杏资源与果胶的研究提供科学依据。
1 材料与方法
1.1 材料与仪器
银杏(外购),无水乙醇,95%乙醇,盐酸,氢氧化钠(均为分析纯)。732型阳离子交换树脂。
pHS-3C酸度计,RE-52旋转蒸发仪,SHB-Ⅲ真空泵,DHG-9202-3SA电热鼓风干燥箱,XFB-200微型高速粉碎机。
1.2 试验方法
1.2.1 银杏壳预处理
将银杏壳洗净,将果壳压碎,在蒸馏水中浸泡30min(除去杂质)。然后在沸水中煮沸3~5min左右(灭酶),沥干,放入烘箱中烘干,在高速粉碎机中粉碎成粉末状。加入100mL 95%乙醇,在60℃的水浴锅中水浴浸提4h,用布氏漏斗过滤,重复浸提2次,使之尽可能除去色素。过滤,最后将滤渣放在烘箱中烘干备用。
1.2.2 732型阳离子交换树脂预处理
将干的732型阳离子交换树脂用蒸馏水在磁力搅拌器中搅拌2h,用4倍体积的2mol·L-1的盐酸溶液在磁力搅拌器中搅拌0.5h,倾去清液,将树脂洗至中性。再用2mol·L-1的氢氧化钠溶液在磁力搅拌器中搅拌0.5h,倾去清液,将树脂洗至中性。最后用2mol·L-1的盐酸溶液在磁力搅拌器中搅拌0.5h,倾去清液,将树脂洗至中性,使之转化为氢型树脂,放在烘箱中(约70℃)烘干备用。
1.2.3 银杏壳果胶提取方法
1)浸提:准确称取1.0000g经预处理的果壳粉末,并称取一定量的732型氢型树脂,放在锥形瓶中,用已经配置好的2mol·L-1的盐酸调节蒸馏水的酸度,调节一定pH值,并以此作为浸提剂,在一定温度的水浴条件下浸提一定时间,过滤,滤渣用蒸馏水洗涤2次,滤液即为果胶浸提液。
2)浓缩:将上步所得到的果胶浸提液在旋转蒸发仪上以4∶1的比例进行浓缩。
3)冷却与乙醇沉淀:将浓缩过的果胶浓缩液放在冰箱中冷却,然后将在冰箱中冷却后的果胶浓缩液注入到相同体积的已经预冷的无水乙醇中,静置5h左右,使果胶沉淀析出。
4)过滤与洗涤:将上个步骤得到的混合物进行抽滤,滤渣用95%乙醇洗涤,再进行抽滤,最后用无水乙醇洗涤滤渣并进行抽滤,得到滤渣。
5)干燥与称重:将滤渣放在烘箱中烘干至恒重。称重,计算得率。

2 结果与分析
2.1 离子交换树脂用量的确定
称取5份银杏壳粉末,每份1.0000g,分别加入不同用量的732型氢型树脂(占银杏壳粉末重,下同),在相同条件下(料液比1g∶20mL,pH 2.0,温度85℃,时间2h),提取果胶,结果见图1。

图1 树脂用量对果胶得率的影响Fig.1 Effects of the amount of resin on pectin yield
由图1可知,在上述条件下,当树脂用量小于7%时,随着树脂用量增加,果胶提取量明显增加,当树脂用量大于7%时,随着树脂用量的增加,果胶提取量变化不明显。这是由于732型氢型树脂上H+能与银杏壳中的Ca2+等多价阳离子发生交换,使Ca2+等多价阳离子交换到树脂上,解除了Ca2+等多价阳离子对果胶的束缚,从而加速了原果胶的溶解,提高了果胶的产量。离子交换树脂法与传统的酸提取法相比较,果胶产量明显提高[8]。当树脂用量较低时,Ca2+等多价阳离子没有完全交换出来,果胶水解不彻底,果胶产量相对较低,当树脂用量为7%时,Ca2+等多价阳离子基本被全部交换出来了,再增加树脂的用量,果胶产量也不会提高。所以,从成本方面考虑,选择7%的树脂用量为宜。
2.2 离子交换法提取果胶的影响因素
按7%的树脂用量,提取银杏壳中果胶,通过单因素实验和正交试验,对料液比、浸提时间、浸提温度、pH值影响因素进行了研究。
2.2.1 单因素试验
2.2.1.1 料液比对果胶得率的影响
称取5份银杏壳粉末,每份1.0000g,在相同条件下(pH 2.0,温度85℃,时间2h),提取果胶,调节不同料液比提取果胶,结果见图2。

图2 料液比对果胶得率的影响Fig.2 Effects of material-liquid ratio on pectin yield
由图2可知,当料液比小于1g∶20mL时,随着料液比的增大,果胶得率明显增加,当料液比为1g∶20mL时,果胶得率达到最大值,再增加料液比,果胶得率呈下降趋势。这是由于料液比过小时,难以保证原料中的果胶全部转移到溶液中,溶液中含有的果胶浓度低,醇析后转化成果胶的量相应降低,且料液比过小,溶液黏度大、过滤困难,造成提取不完全,提取量低;料液比过大时,提取出来的果胶质在溶液中的含量太低,过滤容易,但是沉淀消耗的乙醇量大,沉淀效果不理想。因此,料液比为1g∶20mL时,果胶提取效果较佳。
2.2.1.2 浸提时间对果胶得率的影响称取5份银杏壳粉末,每份1.0000g,在相同条件下(料液比1g∶20mL,pH 2.0,温度85℃),调节不同浸提时间浸提果胶,结果见图3。由图3可知,当浸提时间小于2h时,随着浸提时间的增大,果胶得率明显增加,当浸提时间为2h时,果胶得率达到最大,再增加浸提时间,果胶得率呈下降趋势。这可能是由于浸提时间过短,会导致果胶水解不完全,提取率低;浸提时间过长,会使果胶水解过度,果胶脱脂裂解,且色泽变深,影响果胶质量。所以,浸提时间为2h时,果胶提取效果较佳。
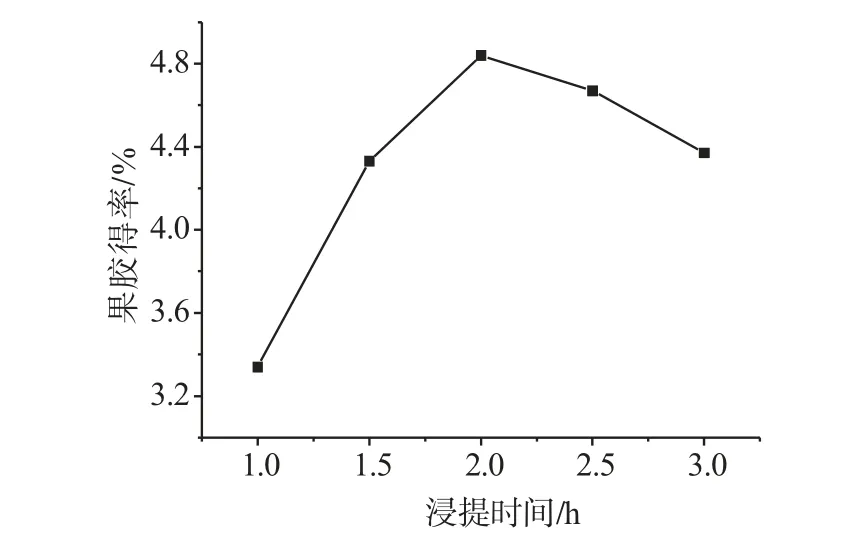
图3 浸提时间比对果胶得率的影响Fig.3 Effects of extraction time on pectin yield
2.2.1.3 浸提温度对果胶得率的影响
称取5份银杏壳粉末,每份1.0000g,在相同条件下(料液比1g∶20mL,pH 2.0,时间2h),调节不同浸提温度浸提果胶,结果见图4。

图4 浸提温度比对果胶得率的影响Fig.4 Effects of extraction temperature on pectin yield
由图4可知,当浸提温度小于85℃时,随着浸提温度的增大,果胶得率明显增加,当浸提温度为85℃时,果胶得率达到最大值,再增加浸提温度,果胶得率变化不明显,但果胶色泽加深,质量下降。这可能是由于温度升高,有利于果胶的水解溶出,果胶提取量相应增加。当温度过高时,可能会引起果胶自身结构的破坏,并降低果胶的胶凝能力,从而使果胶产量呈下降趋势,且温度过高,导致果胶色泽加深,质量下降。所以,浸提温度为85℃时,果胶提取效果较佳。
2.2.1.4 pH值对果胶得率的影响
称取5份银杏壳粉末,每份1.0000g,在相同条件下(料液比1g∶20mL,温度85℃,时间2h),调节不同pH值浸提果胶,结果见图5。
由图5可知,当pH值小于1.5时,随着pH值的增大,果胶得率增大,当pH值增至1.5与2.0时,果胶得率达到较佳值,再增加pH值,果胶得率呈下降趋势。pH值过低,果胶水解过度,易使果胶脱脂裂解,提取率降低,且副反应增多,影响了果胶的质量;pH值过高,原果胶的水解程度弱,生成果胶量低,提取率降低。所以,pH值为1.5与2.0时,果胶提取效果较佳。
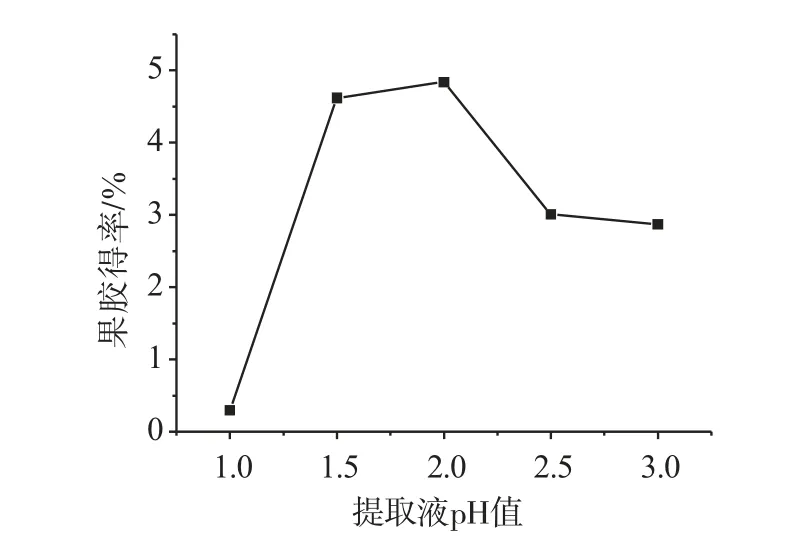
图5 pH值对果胶得率的影响Fig.5 Effects of pH value on pectin yield
2.2.2 正交试验
根据以上单因素实验的初步结果,进行正交试验研究,结果见表1。
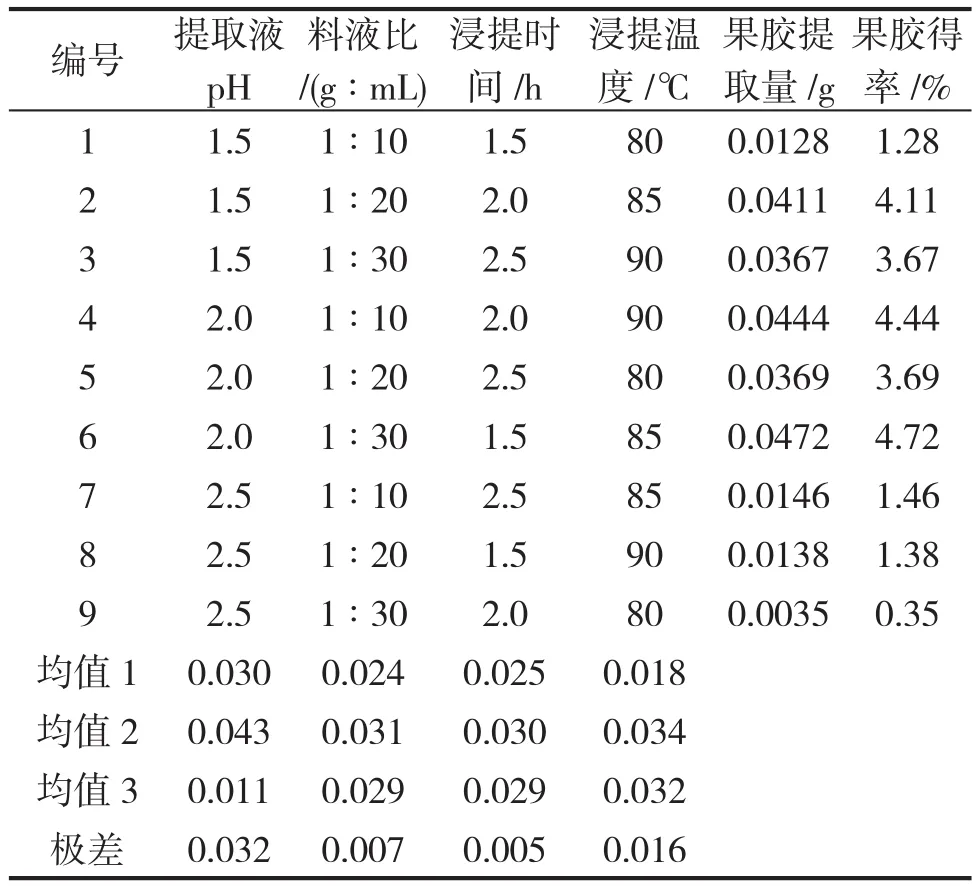
表1 正交试验结果Table1 Results of orthogonal test
由表1可知,R(浸提温度) >R(pH值)>R(料液比) >R(浸提时间),说明4因素对果胶得率的影响顺序为:浸提温度>pH值>料液比>浸提时间,浸提温度对果胶得率影响最大。并确定试验的最优条件为A2B2C2D2,即:料液比1g∶20mL,温度85℃,pH 2.0,时间2.0h,此参数下的果胶得率最好。按此最佳组合做平行实验,测定果胶平均得率得 率为4.85%。
3 结论
通过离子交换法从银杏壳中提取果胶试验表明,交换树脂适宜用量为7%,从单因素试验可知,液料比为1g∶20mL,浸提时间为2h,浸提温度为85℃,pH值为1.5~2.0时,果胶提取效果较好。并在此基础上,用正交试验法对工艺参数进行优化,得到最佳优化条件为:pH 2.0,温度85℃,时间2h,料液比1g∶20mL,此时果胶得率为4.85%。研究结果表明,用离子交换法提取银杏果壳中果胶,其得率明显优于传统的酸提取法。因此,采用本工艺提取果胶,具有较好的应用前景。
[1] 周仲实.膜分离技术在果胶中的应用[J].食品工业科技,2003,24(2):51-55.
[2] 戴玉锦,张敏艳,徐珏.离子交换法提取橙皮果胶的研究[J].江苏农业科学,2005(2): 103-106.
[3] 张燕,毛桂枝,刘蕴哲.离子交换树脂法提取桔皮中果胶[J].食品研究与开发, 2003,8(5): 52-55.
[4] 唐满生,戴永强.微波协同离子交换法提取果胶的研究[J].现代食品科技,2009,25(6): 678-679.
[5] 王方方,陈开勋,范代娣,等.离子交换法制备果胶[J].食品科学,2009,30(4):57-60.
[6] 张卫红,耿薇,王晓锋.D151H阳离子树脂法提取果胶的研究[J].食品工业,2007(6): 20-22.
[7] 顾焰波,刘显明,禚倩,等.离子交换法提取木瓜皮果胶工艺研究[J].食品工业,2013,34(12):19-21.
[8] 田辉,马力.果胶制备方法的研究进展[J].中国调味品,2007(3):17-20.
Extraction of Pectin from Ginkgo Biloba L. Shells by Ion-exchange Method
GU Yan-bo, QIU Fei, TANG Xiao-fang, CHANG Xiao-lei
(Taizhou Institute of Science and Technology, NJUST, Taizhou 225300, China)
The pectin of ginkgo biloba L. shells were extracted by ion-exchange method. The inf uent of single factors and orthogonal tests on the yield of pectin were studied. The results showed that the appropriate technical conditions were as followed: cation exchange resins 7%, pH 2.0, the extraction temperature 85℃, the extraction time 2h,the ratio of material to extraction solution 1g/20mL. Under the process conditions, the extract yield of pectin was 4.85%.
ion- exchange method; ginkgo biloba L. shells; pectin; extraction
TS 255
A
1671-9905(2015)05-0012-04
泰州市科技支撑社会发展计划(指导性)项目;南京理工大学泰州科技学院化工学院“梦兰神彩”大学生创新基金资助项目
顾焰波(1982-),男,江苏如东人,硕士,讲师,主要研究方向:精细化工和化工分离研究。E-mail:ybg8209@163.com
2015-02-04
