红芪多糖对膀胱癌大鼠抗肿瘤作用的实验研究
2015-01-12田河邸彦橙宋静南锡浩
田河, 邸彦橙, 宋静, 南锡浩
(黑龙江省牡丹江医学院红旗医院泌尿外科,牡丹江 157011)
红芪为传统中药中比较常见的药材,其主要产地为甘肃省,质量极佳,黄芪主要功效为益气固表、利尿、脱毒排脓、抗氧化、抗肿瘤等,活性成份较多,但是以红芪多糖为主,其具有抑瘤效应,基本机制都是通过调节机体免疫系统功能而发挥作用[1]。也有加快损伤的免疫器官修复过程,提高免疫细胞的活性,促进抗体、细胞因子的释放等。另外该药物有甘、淡、平,归肾、膀胱经,达到利水渗湿作用。
1 资料与方法
1.1 实验动物及分组
清洁级雌性 Fisher344大鼠50只,雌雄各半,由牡丹江医学院实验动物研究中心提供。实验分为5组,每组10只,即空白对照组、红芪多糖高、中、低剂量组、猪苓多糖组。
1.2 主要试剂
红芪多糖药品、BBN试剂由黑龙江中医药大学购进。IL-2、VEGF、AQP1、AQP3、β-actin测定试剂盒(哈尔滨海霞试剂有限公司)。
1.3 主要仪器
电子天平;电热恒温水浴锅(华夏仪器制造厂);微量移液器(上海易友仪器有限公司);TD5M-WS型台式低速离心机;全自动酶标仪-WD-2102A酶标仪;PCR扩增仪(PTC-100TM MJ Research公司);数码凝胶成像分析系统等。
1.4 造模及给药方法
实验动物随机分为5组,每组10只,即空白对照组、猪苓多糖100mg/kg组、红芪多糖25mg/kg 组、红芪多糖50mg/kg 组、红芪多糖100mg/kg 组,大鼠饮用含有0.05%BBN,持续8周,第9周给予含 5%糖精的饮用水和相应实验组注射干预药物均为至第20周截止。大鼠采血后,把大鼠麻醉于手术台上分离膀胱组织。
1.5 指标测定
ELISA法测血清中VEGF、IL-2含量;RT-PCR法测AQP1和AQP3表达情况。
1.6 数据处理
所得数据采用方差分析两均数间t检验,SPSS18.0 软件分析,各组数据由`x±s表示,P<0.05为具有统计学意义。
2 结果
红芪多糖对膀胱癌大鼠肿瘤抑制效果以中剂量为佳,其可以提高血清中IL-2含量,减少VEGF含量水平,同时下调AQP1 和 AQP3基因表达,具体结果见表1,表2。
3 讨论
膀胱癌是泌尿外科最为常见的肿瘤之一,占全身癌症发病率5﹪,恶性程度较高预后较差。多中心性发生和高发病率是该疾病的主要病程特征,治疗后如果复发则呈逐级升高态势。其病因尚不明确,与多种因素有关并且呈多阶段性的发病。因此,探讨膀胱癌的病因、发生、发展、治疗是我们临床工作者的重要任务,而各种肿瘤的发生发展都和免疫系统功能有关,现在治疗理念基本是研发的合成西药或者干扰素等。本研究侧重于能够提高人体免疫功能的多糖类入手,从免疫学方面深入研究,目的是能够发现机体的免疫功能及状态与肿瘤的发生、发展及预后密切相关性[2]。
红芪多糖具有促血管生成、抗自由基、免疫调节、降血糖、抗肿瘤、抗衰老等活性。有资料记载,抗肿瘤作用主要是由于其可以激活机体的免疫系统,提高机体自身的抗肿瘤能力,释放肿瘤杀伤的生物因子,间接的起到控制肿瘤增长和转移的效果。免疫系统中T细胞活化状态是由IL-2维持的,其参与T细胞的活化和增值,促进NK细胞杀伤活性、活化巨噬细胞等生物学作用[3]。VEGF具有促进血管内皮细胞增殖、分化、也能够增加微血管通透性,同时诱导血管生成,可以被认为是促进肿瘤生长和转移的重要因子之一。AQP1和AQP3 与癌症的发生关系密切,在膀胱癌组织中,两者都较正常膀胱组织表达偏高[4]。
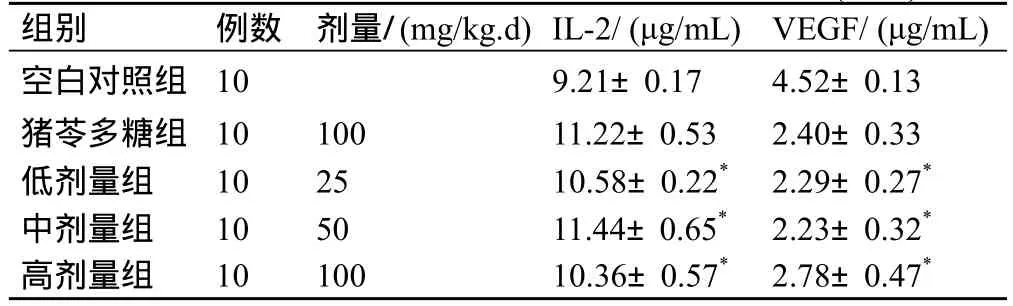
表1 红芪多糖对大鼠外周血清中IL-2、VEGF(`x±s)
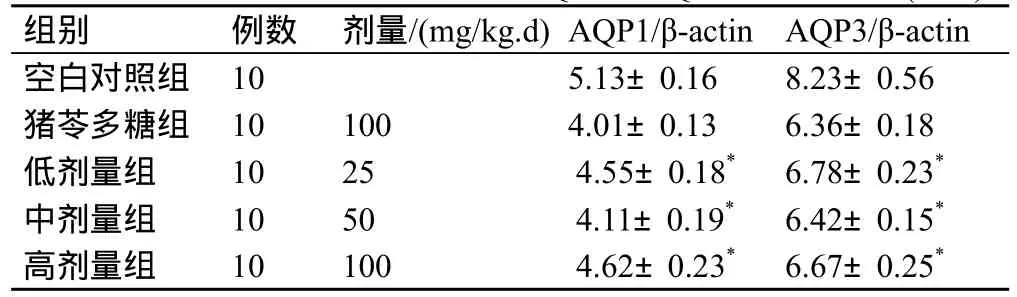
表2 红芪多糖对大鼠膀胱组织中AQP1和AQP3表达的影响(`x±s)
在本实验中猪苓多糖[5]早已经应用于抗肿瘤领域中,通过复制大鼠膀胱癌疾病模型,对照比较不同剂量对肿瘤动物的体内相关因子检测来进一步判断红芪多糖拮抗癌细胞增殖的效果,结果表明各剂量组对肿瘤都有抑制作用,以中剂量组最为明显,有增加血清中IL-2的含量减少VEGF水平,降低瘤组织中AQP1和AQP3表达能力。因此,我们可以得出,该药物对膀胱癌的发生发展有一定的影响,希望通过更多的实验证实其具体机制。
[1] 国家药典委员会. 中华人民共和国药典(一部)[S]. 2010年版. 北京:中国医药科技出版社, 2010:142.
[2] 付尚志. 肿瘤的免疫功能研究现状[J]. 临床军医杂志,2002, 30(5): 95-97.
[3] 袁定芬, 张名莉, 徐佩红. 梅毒患者血清可溶性白介素 2 受体测定及其临床意义[J]. 中国医师杂志, 2002,4(8):855-856.
[4] 魏巍, 张刚, 谷欣权, 等. AQP1、AQP2 及 AQP3 在人腺性膀胱炎组织中的表达 [J]. 吉林大学学报 (医学版), 2007,33(2):318-320.
[5] Moon C, Soria JC, Jang SJ, et al. Involvement of aquaporinsin colorectal carcinogenesis [J]. Oncogene, 2003,22(43): 6699-6703.
