磷酸盐浓度对测定替卡西林钠/克拉维酸钾(15:1)中高分子杂质分离效果的影响
2015-01-12林波文随方云冲向世英
林波,文随方,云冲,*,向世英,*
(1 海南医学院 海南省肿瘤发生和干预重点实验室, 海口 571199;2 海南通用三洋药业有限公司, 海口 570312)
替卡西林钠/克拉维酸钾(15:1)是β-内酰胺类抗生素,控制该类抗生素的高分子杂质的含量,是减少过敏反应的关键[1]。克拉维酸钾是β-内酰胺酶抑制剂,可保护替卡西林钠不受β-内酰胺酶的破坏。中国药典2010年版二部注射用替卡西林钠/克拉维酸钾标准中未检查高分子杂质,目前国内主要采用Sephadex G10凝胶色谱系统测定β-内酰胺类抗生素中高分子杂质[2],但在该系统下,克拉维酸钾的出峰位置与高分子杂质相同,因此不能用它测定这种药品。
文献报道的这种药物的检测方法是利用TSK-GEL G2500PWxl凝胶系统分离,但报道的方法由于选取的磷酸盐浓度不合适,不能把替卡西林钠克拉维酸钾分离,不能得到较好的检测结果[3]。本试验通过考察不同浓度的磷酸盐对测定替卡西林钠克拉维酸钾(15:1)中高分子杂质分离效果的影响,找出较好的磷酸盐缓冲液作为流动相,使替卡西林、克拉维酸及高分子杂质的峰达到很好的分离。并通过方法学验证。
1 试验条件及方法
1.1 仪器与试验药物
戴安高效液相色谱仪(型号:Thermo/Ultimate3000),变色龙7色谱工作软件。
注射用替卡西林钠/克拉维酸钾(15:1) 样品,由海南通用三洋药业有限公司生产,批号为131001、131003及131006;对照品替卡西林(批号130569-200902,含量84.0% )购自中国药品生物制品检定所。
1.2 试验方法
1.2.1 检测波长及溶媒的选择
通过紫外扫描,本品中高分子杂质及主成分均在230 nm处有较大的吸收,故采用230 nm为检测波长。以水为溶媒时,溶剂峰干扰样品的测定,而选择流动相作为溶媒时,对样品测定无干扰。
1.2.2 色谱条件
采用TSK-GEL G2500PWxl(7.8 mm×30cm,粒径7μm)色谱柱,检测波长230 nm柱温30℃。
1.2.3 测定法
取本品适量,精密称定,用流动相溶解并定量稀释制成每1mL中含替卡西林钠1.0mg的溶液,作为供试品溶液(临用新配);另取替卡西林对照品适量,精密称定,加流动相溶解并定量稀释制成每1mL中约含10μg的溶液,作为对照品溶液。精密量取供试品溶液与对照品溶液各20μL,分别注入液相色谱仪,记录色谱图;供试品溶液色谱图中如有杂质峰,按外标法以峰面积计算保留时间小于替卡西林钠的杂质总量。
2 试验结果
2.1 流动相的选择
以不同浓度的磷酸盐缓冲液作为流动相:A.0.02mol/L磷酸氢二钠-0.02mol/L磷酸二氢钠(95:5);B. 0.03mol/L磷酸氢二钠-0.03mol/L磷酸二氢钠(95:5);C. 0.04mol/L磷酸氢二钠-0.04mol/L磷酸二氢钠(95:5);D. 0.05mol/L磷酸氢二钠-0.05mol/L磷酸二氢钠(95:5)。考察高分子杂质峰与主峰的分离情况,结果见图1和表1。
从图1中看,在一定范围内,随着磷酸盐浓度的增大,主峰替卡西林出峰时间越晚。高分子杂质峰与主峰的距离越大,但随着磷酸盐浓度的增大,主峰拖尾越严重,当磷酸盐浓度的增大到D浓度时[0.05mol/L磷酸氢二钠-0.05mol/L磷酸二氢钠(95:5)],由于主峰拖尾严重已不能和克拉维酸很好分离。
从图1看,C浓度[0.04mol/L磷酸氢二钠-0.04mol/L磷酸二氢钠(95:5)]的三个峰分离度较好。从表1数据中也看出C浓度的分离效果较好。因此利用它作为流动相,进行一下步的方法学验证实验。
2.2 方法学验证
2.2.1 专属性试验
分别采用A: 0.1mol/L氢氧化钠溶液,B:0.1mol/L盐酸溶液,C:照度为(4500±500)LX强光,D:60℃高温及下放置10 d,E:30%的双氧水溶液强制破坏试验考察本品高分子杂质与主峰的分离情况。结果供试品经破坏后,高分子杂质均有增加,其中经碱破坏及氧化破坏后高分子杂质增加尤为明显。结果表明,高分子杂质峰与主峰有效分离,本色谱系统专属性良好,分析结果见图2。
2.2.2 仪器精密度试验
取替卡西林对照品适量,流动相溶解并定量稀释制成每1mL中约含10μg的溶液,作对照品溶液。精密量取对照品溶液20μL注入液相色谱仪,连续进样6次,计算主峰面积的RSD为0.40%,结果表明仪器精密度良好。
2.2.3 检测限、定量限测定
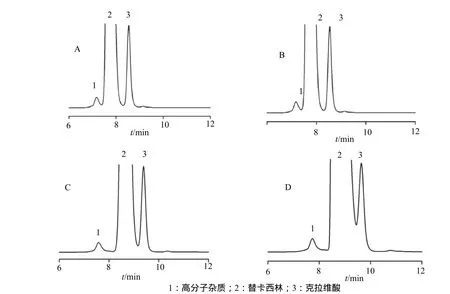
图1 替卡西林钠克拉维酸钾(15:1)中的高分子杂质(在A、B、C、D 4种流动相体系下的分离)
取替卡西林对照品溶液,逐步稀释,至色谱图中主峰的峰高约为基线噪音的3倍(检测限)及基线噪音的10倍(定量限),计算得替卡西林的检测限为50ng(S/N≈3),定量限为300ng(S/N≈10)。
2.2.4 对照品线性试验
称取替卡西林对照品12.82mg,置于100mL量瓶中,加流动相溶解并稀释至刻度,摇匀;分别精密量取1.0mL、3.0mL、4.0mL、5.0mL、6.0mL、7.5mL和10mL,分别置于50mL量瓶中,加水稀释至刻度,摇匀,作为20%、60%、80%、100%、120%、150%和200%的对照品溶液。精密量取上述溶液各20μl注入液相色谱仪,将测得峰面积与进样量作线性回归。试验结果表明:对照品溶液在2.154 μg/mL~21.538 μg/mL浓度范围有良好的线性关系,线性方程与相关系数为:Y=0.4075X+0.0157;r=0.99998。
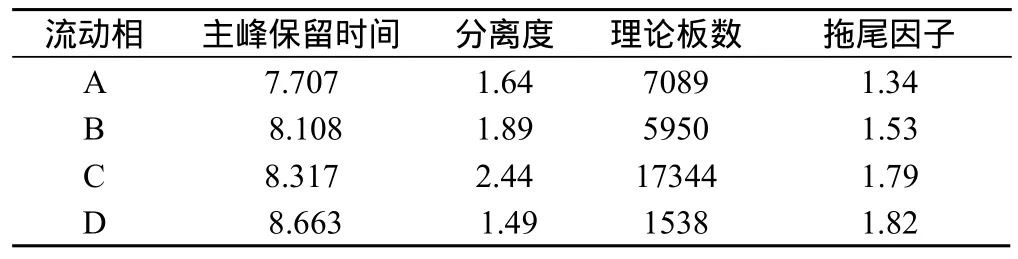
表1 不同磷酸盐浓度流动相对测定结果的影响
2.2.5 供试品溶液浓度与高分子杂质相关性试验
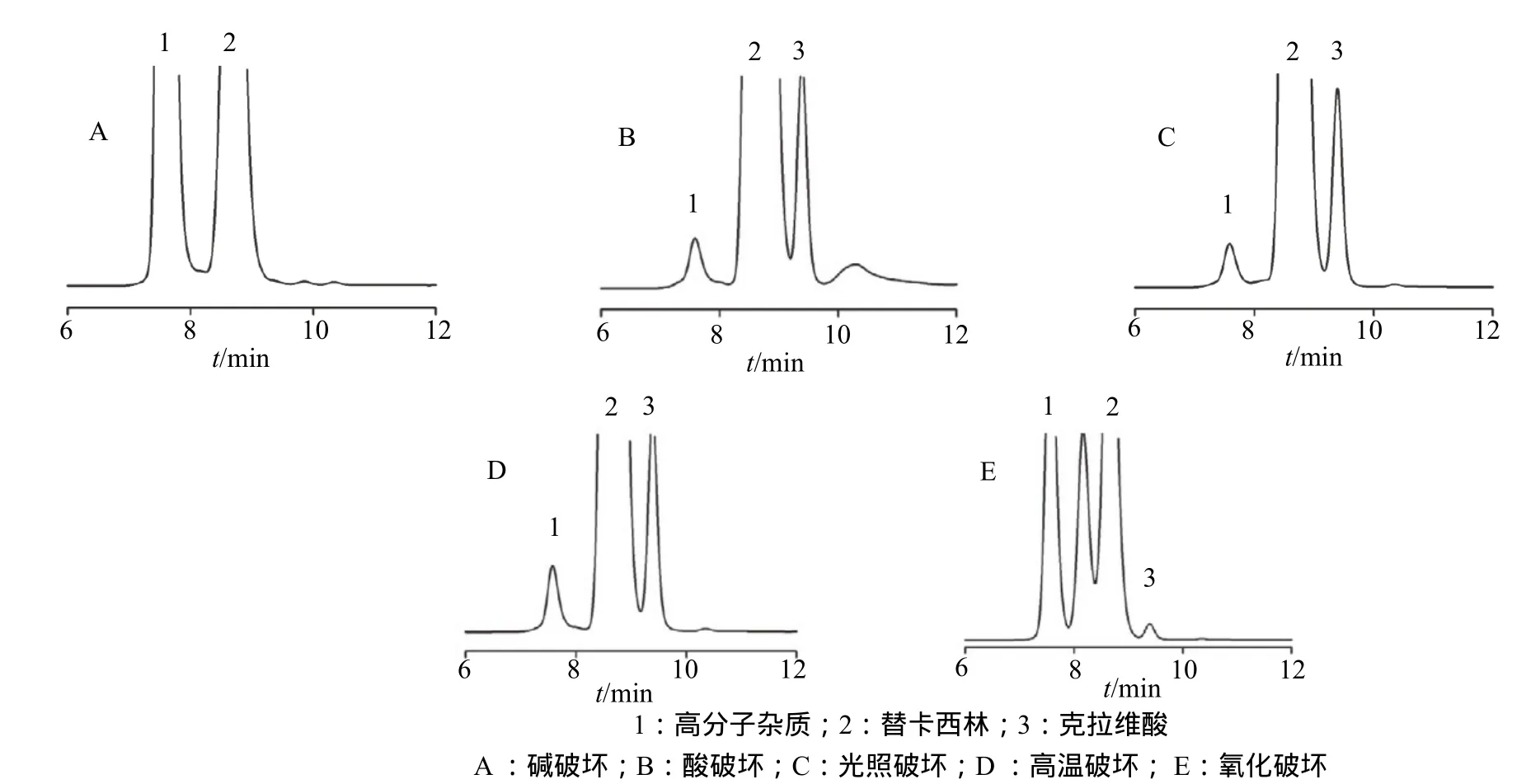
图2 专属性试验HPLC图
分别称取样品(批号:131001)适量,加流动相溶解并定量稀释制成每1mL中约0.5mg、0.8mg、1.0mg、1.2mg、1.5mg和2.0mg替卡西林钠的溶液,相当于高分子杂质测定供试品溶液浓度的50%、80%、100%、120%、150%和200%,精密量取上述溶液各20μL,分别注入液相色谱仪,结果供试品溶液在0.504mg/mL~1.997mg/mL浓度范围,有良好的线性关系,线性方程Y=3.3941X-0.0238;r=0.9995。
2.2.6 重复性试验
称取样品(批号:131001)适量,加流动相溶解并定量稀释制成每1mL中含替卡西林钠1.0mg的溶液,作供试品溶液(临用新配),平行配制六份,分别为:0.716mg、0.718mg、0.730mg、0.728mg、0.728mg、0.734mg精密称取替卡西林对照品适量,加流动相溶解并稀释制成每1mL中约含替卡西林10μg的溶液,作对照品溶液。精密量取上述供试品溶液和对照品溶液取各20μL,分别注入液相色谱仪,记录色谱图;按外标法以峰面积计算保留时间小于替卡西林钠的杂质总量。其平均值(%)为0.726;RSD(%)为0.50。试验结果表明测定方法的重复性良好。
2.2.7 中间精密度试验
取本品(批号:131001),照重复性试验项下的方法,由两个试验人员,在不同日期,使用两台高效液相色谱仪检测,根据记录的色谱图,按外标法以峰面积计算保留时间小于替卡西林钠高分子杂质总量。测定12份样品的高分子杂质(%)分别为0.716、0.718、0.730、0.728、0.728、0.734、0.744、0.746、0.740、0.750、0.731、0.737,其平均值为0.734;试验结果表明:RSD(%)=1.4%,小于5%,中间精密度结果良好,能满足本品高分子杂质测定要求。
2.2.8 样品的检测
取本公司生产的3批注射用替卡西林钠克拉维酸钾(15:1),批号为131001、131003、131006,采用TSK-GEL G2500PWxl凝胶色谱系统测定,结果见表2。
3 讨论
3.1 流速及柱温的选择
为了考察色谱条件的耐用性,故作了以下不同流速及柱温下的试验,结果见表3。
结果表明,替卡西林钠与高分子杂质的分离度均大于1.5,此色谱条件的耐用性结果良好。在保证主峰出峰时间,以及替卡西林钠与高分子杂质分离度的前提下,选择了0.8mL/min作为流速,柱温为30℃。
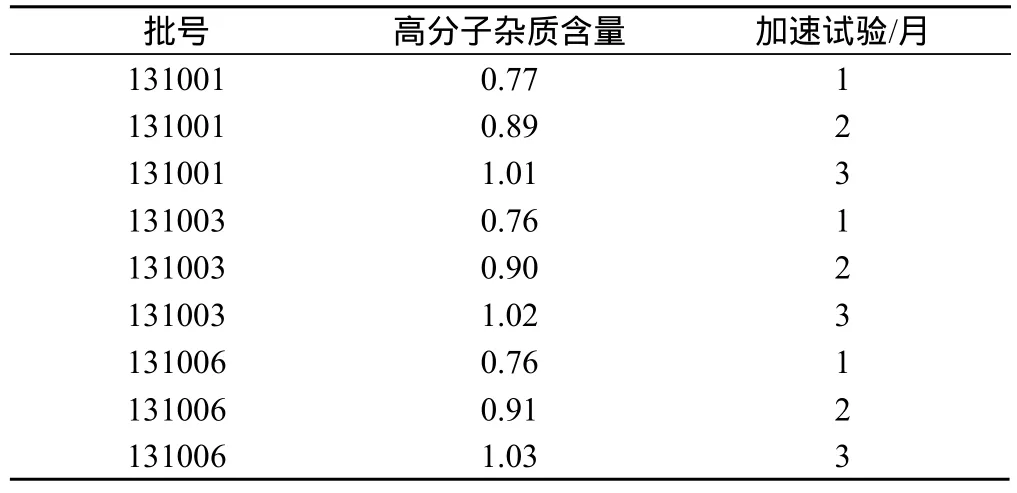
表2 样品测定

表3 不同流速及柱温下替卡西林钠与高分子杂质峰分离度
3.2 与文献报道方法比较
文献报道的这种药物的检测方法选取的磷酸盐浓度为0.15mol/L磷酸氢二钠:0.15mol/L磷酸二氢钠(95:5)为流动相,不太合适,因为在这个浓度下,其替卡西林主峰由于拖尾严重而和克拉维酸峰混在一起,而且其高分子峰也变形为两个峰,不能得到较好的检测结果[3]。而我们的方法可以使高分子、替卡西林和克拉维酸三个峰分离度较好,而且三个峰的峰形也较好。
3.3 结论
采用0.04mol/L磷酸氢二钠-0.04 mol/L磷酸二氢钠(95:5)为流动相,测定替卡西林钠克拉维酸钾(15:1)中的高分子杂质,替卡西林钠与高分子杂质可以达到很好的分离。经方法学验证表明,本法专属性、相关性、重现性良好,操作简单、快速,测定结果准确,可用于替卡西林钠克拉维酸钾(15:1)中的高分子杂质检测。
[1] 胡昌勤. β-内酰胺抗生素聚合物分析技术展望[J]. 中国新药杂志, 2008, 17(24):2098-2112.
[2] 夏鸣, 杭太俊, 李小敏, 等. β-内酰胺抗生素高分子聚合物杂质检查方法的研究综述[J]. 药学进展. 2007, 31(11):501-507.
[3] 钟雅妮,刘俊华, 林小洁, 等. HPLC法测定替卡西林钠克拉维酸钾(15:1)中的高分子杂质[J]. 药物分析杂志, 2011,31(5):871-874.
