豚鼠早期实验性近视眼视网膜色素上皮细胞bFGF表达变化的研究
2015-01-10陈博宇王超英陈维毅刘迎庆
陈博宇,王超英,陈维毅,刘迎庆,郝 岚
·实验论著·
豚鼠早期实验性近视眼视网膜色素上皮细胞bFGF表达变化的研究
陈博宇1,王超英1,陈维毅2,刘迎庆1,郝 岚1
目的:研究豚鼠早期实验性近视眼视网膜色素上皮(retinal pigment epithelial,RPE)细胞前部及后极部碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)的改变,探索近视的发病机制。
豚鼠;视网膜色素上皮细胞;碱性成纤维细胞生长因子;免疫细胞化学;实时荧光定量PCR;Western-blot蛋白印迹法
引用:陈博宇,王超英,陈维毅,等.豚鼠早期实验性近视眼视网膜色素上皮细胞bFGF表达变化的研究.国际眼科杂志2015; 15(11):1857-1861
0 引言
碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)是成纤维细胞生长因子家族的一个重要成员,能促进多种来自中胚层和神经外胚层的细胞生长、增殖和分化,还参与细胞外基质的形成。目前认为视网膜色素上皮(retinal pigment epithelial,RPE)细胞具有合成bFGF的能力,但正常情况下不分泌,可能只在病理环境如细胞损害或在细胞培养的高转化条件下,RPE细胞中的bFGF基因才表达[1-3]。在近视发生过程中,RPE上的bFGF通过受体机制逐级将信息传递到巩膜组织,进而通过影响巩膜细胞的增殖和(或)细胞外基质的合成或降解,使巩膜重新塑形,眼轴过度延长,形成近视。目前人们对豚鼠透镜诱导近视眼RPE细胞中bFGF的表达变化的研究罕有报道,而不同部位RPE细胞分泌因子的差异更无人报道。为此,本研究在成功建立透镜诱导近视眼模型的基础上,定位到前部及后极部RPE细胞,分析不同部位的bFGF在近视发生、发展过程中所起的作用,为进一步在细胞因子水平对病理性近视眼发生机制的研究提供补充和相关的理论基础。
1 材料和方法
1.1 材料
1.1.1 实验动物随机选取两周龄已脱离母乳喂养的小豚鼠30只60眼,分为A组、B组、C组,每组各10只,再随机选取5只10眼正常两周龄豚鼠不作任何干预,作为正常对照眼(Norma-contro,NC组),雌雄不限,由河北医科大学实验动物养殖场提供。制备A组、B组、C组的镜片诱导型近视(lens-induced myopia,LIM)动物模型,诱导眼为实验组(LIM组),对侧眼为自身对照组(SC组)。实验眼是采用离焦点的方法用-10.00D[4]凹透镜诱导成近视眼模型。遮盖时间分别为6d(A组)、15d(B组)、30d (C组)。幼豚鼠于室内标准化喂养,白天用自然光照射,每日光照与黑暗的周期比例为14∶10,室温控制在20℃。
1.1.2 凹透镜片自行设计的PMMA镜片,部分参数如下:镜片直径11.0mm,光学直径9.5mm,基弧为9.0,屈光度均为-10.00D,上海菲士康视光有限公司。
1.1.3 试剂F12培养基、胰蛋白酶(美国Gibico公司);胎牛血清、小牛血清(杭州四季青公司);培养瓶、六孔板(美国Corning公司)。兔抗鼠Vimentin、Desmin、keratin、S-100I抗体及免疫组织化学的剂盒(北京博奥森生物技术有限公司);DAB显色试剂盒(北京中杉金桥生物技术有限公司);碱性成纤维细胞生长因子(bFGF,北京博奥森生物技术有限公司);Trizol(Invitrogen公司, USA);RNase Inhibitor(Promega公司,USA);M-MLV RT酶(Promega公司,USA);DNTP(Promega公司,USA);Taq酶(5U/μL,Sigma公司,USA)。
1.2 方法
1.2.1 RPE细胞的原代培养及鉴定将豚鼠标记编号,验光及测眼轴长度。将三组豚鼠分别喂养6、15、30d后,摘除镜片,按前述方法验光及测眼轴长度。显微镜下沿角膜缘后2mm环形剪开眼球壁,去除角膜、晶状体、玻璃体,以撕囊镊夹住视盘部位视网膜神经上皮,剪开一小口,由此切口轻缓揭去视网膜神经上皮,再沿赤道部环形剪开,分成前部和后极部两部分。采用细胞酶消化法培养豚鼠的RPE细胞。用免疫细胞化学法对培养的细胞进行鉴定。步骤为:将融合的原代细胞用2.5g/L胰酶消化,吹打,离心,去上清液,加F-12培养液,将其制备成1× 106个/mL细胞悬液,吸取2mL,加入有盖玻片的24孔板内,细胞贴壁并开始生长后取出盖玻片,PBS冲洗3遍, 4%多聚甲醛固定15min。将生长有RPE细胞的盖玻片浸入4%多聚甲醛固定15min,PBS冲洗3次,各2min。然后滴加1%Triton X-100(DPBS配),室温孵育20min。PBS清洗3次,各2min。3%H2O2孵育15min,然后PBS清洗标本3次,各2min。封闭液孵育20min。以PBS 1∶50稀释一抗Vimentin,Desmin,Keratin,S-100),4℃于湿盒中孵育过夜,PBS清洗3次,各5min。以PBS代替一抗,作阴性对照。二抗工作液37℃孵育30min,PBS清洗3次,各5min。C液(链亲和霉素-过氧化物酶溶液)于37℃孵育30min,PBS清洗3次,各5min。DAB显色约3min,蒸馏水终止反应。苏木素复染0.5~1min,自来清洗,酒精梯度脱水,中性树脂封片。光学显微镜下观察结果。阴性空白对照:以PBS代替一抗,作阴性对照。由经验丰富的病理科技师采用双盲法独立观察,每张细胞爬片观察高倍镜(LM×400)下3个视野,阳性效应产物为棕黄色颗粒,分布于细胞浆中。
1.2.2 免疫细胞化学方法检测豚鼠前部及后极部RPE细胞中bFGF的表达将有RPE细胞的盖玻片放入湿盒内,每张玻片加50μL Triton室温下通透15min,PBS冲洗3×5min。链亲和霉素-过氧化物酶溶液浸泡6min,以消除内源性过氧化物酶的活性,PBS冲洗3×5min。高压锅加热抗原修复液处理2min,室温冷却20min,PBS冲洗3×5min。以PBS 1:50稀释50μL一抗(兔抗bFGF多克隆抗体,1∶100),37℃孵育60min,PBS冲洗3×5min。滴加生物素标记的50μL二抗,室温40min,PBS冲洗3×5min。DAB显色,取1mL蒸馏水加试剂盒中A、B、C试剂各1滴,混匀后加至玻片上,室温显色,镜下控制反应时间,一般在5~10min之间(胞浆呈棕黄色为阳性),蒸馏水充分洗涤终止显色时间。自来水充分冲洗,苏木素复染10min,梯度脱水,中性树脂封片。光学显微镜下观察结果。阴性空白对照:以PBS代替一抗,作阴性对照。结果判定:由经验丰富的病理科技师采用双盲法独立观察,每张细胞爬片观察高倍镜(LM×400)下3个视野,阳性效应产物为棕黄色颗粒。阴性(-):无表达;(+):着色浅,成淡黄色,高倍镜下明确阳性;(++):着色中等,棕黄色,低倍镜下明确阳性;(+++):大量,棕色,着色深;(++++):密集片状,深棕色,着色强烈。
1.2.3 实时荧光定量PCR检测豚鼠前部及后极部RPE细胞中bFGF m RNA表达
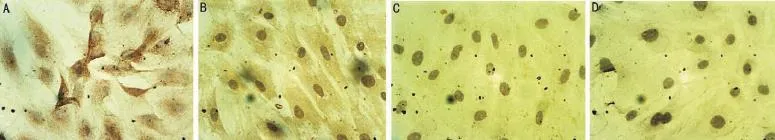
图1 豚鼠视网膜色素上皮细胞的细胞免疫化学法鉴定结果(×400) A:keratin(+);B:S-100(±);C:Vimentin(-);D:Desmin(-)。
1.2.3.1 目的基因引物的合成引物由上海生物工程公司合成。引物序列如下:GAPDH:上游引物:5'-TGAACGGGAAGCTCACTGG-3',下游引物:5'-GCTTCACCACCTTCTTGATGTC-3';BFGF(187bp):上游引物5'-GAGTTGTGTCTATCAAGGGAGTC-3',下游引物5'-TGTCCAGTTCGTTTCAGTGC-3'。
1.2.3.2 提取RNA的完整性检测及提取RNA的定量
标本及组织总RNA留取后,取RNA溶液4μL,经10g/L琼脂糖凝胶电泳检测,明显可见28S、18S条带,且28S为18S条带的两倍,5S条带较弱,且弥散,表明RNA降解较少,完整性良好。用756型紫外分光光度计分别测定OD260与OD280,OD260/OD280比值在1.8~2.0之间,表明提取的RNA蛋白污染很少,因此可用于后续反转录反应。用756型紫外分光光度计测量OD260/OD280比值,可检测RNA的纯度和含量,选用OD260/OD280比值为1.8~2.0的RNA用作反转录。RNA含量采用紫外分光光度计检测法。
1.2.3.3 Syber Green荧光定量PCR检测PCR热循环参数:96℃4min,然后三步反应:94℃30S,58℃30s,72℃30s,进行40个循环,于每个循环的第三步72℃30s收集荧光信号。选择数据分析方式,用实时荧光定量PCR结果分析。本实验采用相对定量法中的CT值比较法检验基因的表达变化。扩增完毕后,进入结果分析界面,以GAPDH为内参照基因,与对照组相比,得到目的基因表达的相对定量值(RQ值),我们将RQ值用于统计分析。
1.2.4 Western-blot印迹法定量检测豚鼠前部及后极部RPE细胞中bFGF蛋白表达
1.2.4.1 蛋白质抽提及定量收集各组细胞,用冷PBS洗涤3次后,将细胞重悬于细胞裂解液中,冰浴6min,使细胞充分裂解。离心,收集上清,分装冻存。配置BCA工作液(WR);分别吸25μL标准品、待测样品至微孔板对应孔中,每孔加入200μL的BCA工作液(WR),震板6s以彻底混合均匀,盖好微孔板,37℃孵育6min,冷却至室温;测量各孔590nm的吸光度值;测得的每个标准孔和待测样品孔的吸光度值分别减去空白孔平均吸光度值;以校正过的BSA标准蛋白测量值对其浓度(μg/mL)做图绘制标准曲线。使用标准曲线定量待测样品蛋白浓度。
1.2.4.2 转PVDF膜SDS聚丙烯酰胺凝胶电泳完毕后对凝胶进行半干转膜(转膜缓冲液为48mmol/L Tris, 39mmol/L甘氨酸,1.3mmol/L SDS,20%甲醇,pH=9.2)。半干式转膜槽阴极在上,阳极在下。缓冲液为连续缓冲液,蛋白质移动方向由上而下。转移电流50~250mA,转移时间20~60min。封闭:转膜完毕,取出PVDF膜,置于含50g/L脱脂奶粉的TTBS(10mmol/L Tris-HCl,pH=8.0, 60mmol/L NaCl,0.05%Tween-20)封闭液中,于室温封闭2h。一抗(兔抗bFGF多克隆抗体,1∶100)结合:将封闭后的PVDF膜置入TTBS适当稀释的一抗溶液中,4℃缓慢摇动过夜。洗膜:取出PVDF膜放入盛有适量TTBS的平皿中,室温洗膜,每次10min,共3次。二抗结合:将PVDF膜置入适量以TTBS 1∶10000稀释的辣根过氧化物酶标记的二抗溶液中,于室温反应2h。化学发光法检测:用TTBS室温洗膜3次,每次10min,然后用TBS(10mmol/L Tris-HCl,pH=8.0,60mmol/L NaCl)洗膜1次,约5min。抗体结合区带用化学发光法检测。信号强度用Bio 1D图像分析软件进行相对定量分析。
统计学分析:采用SPSS 13.0统计软件对数据进行统计分析。计量资料以均数±标准差(±s)表示,凡对照组与实验组间差异分别行配对样本t检验,组间差异行完全随机单因素方差分析。以P<0.05为差异有统计学意义。
2 结果
2.1 细胞鉴定结果细胞免疫化学法鉴定显示:RPE细胞Keratin染色阳性,胞浆内可见大量棕色阳性反应产物,S-100染色弱阳性,胞浆内多呈棕黄色,Vimentin染色阴性, Desmin染色阴性,证实所培养的细胞为RPE细胞(图1)。
2.2 豚鼠RPE细胞中bFGF的阳性表达bFGF的表达定位于细胞浆和细胞核。各诱导时间段前部及后极部RPE细胞均有bFGF的表达,LIM组前部及后极部与SC组相应前部及后极部比较,LIM组中bFGF的阳性表达率低于SC组,差异有统计学意义(P<0.05);而且,随着诱导时间的推移,LIM组的阳性表达率逐渐降低,差异有统计学意义(P<0.05),SC组的阳性表达率不变,差异无统计学意义(P>0.05);但LIM组和SC组各组自身前部及后极部比较,差异无统计学意义(P>0.05,图2,表1)。
2.3 豚鼠前部及后极部RPE细胞中bFGF m RNA表达
各诱导时间段前部及后极部RPE细胞均有bFGF mRNA的表达,LIM组前部及后极部与SC组相应前部及后极部比较,LIM组中bFGF mRNA的表达量低于SC组,差异有统计学意义(P<0.05);而且,随着诱导时间的推移,LIM组的表达量逐渐降低,差异有统计学意义(P<0.05),SC组的表达量不变,差异LIM组和SC组各组自身前部及后极部比较,差异无统计学意义(P>0.05,图3,表2)。
2.4 豚鼠前部及后极部RPE细胞中bFGF蛋白表达A、B、C三组实验眼和对照眼前部及后极部RPE细胞均有bFGF的表达,LIM组前部及后极部与SC组相应前部及后极部比较,LIM组中bFGF蛋白的表达量低于SC组,差异有统计学意义(P<0.05)。而且,随着诱导时间的推移, LIM组的表达量逐渐降低,差异有统计学意义(P<0.05), SC组的表达量不变,差异无统计学意义(P>0.05);但LIM组和SC组自身前部及后极部比较,差异无统计学意义(P>0.05,图4,表3)。

图2 豚鼠RPE细胞中bFGF的细胞免疫化学法阳性表达(×400) A:实验组前部(30d);B:实验组后极部(30d);C:实验组前部(15d);D:实验组后极部(15d);E:实验组前部(6d);F:实验组后极部(6d);G:对照组前部;H:对照组后极部。

表1 豚鼠RPE细胞中bFGF的细胞免疫化学法阳性表达

图3 豚鼠前部及后极部RPE细胞中bFGFm RNA表达的对比 1:实验组前部;2:实验组后极部;3:对照组前部;4:对照组后极部。

图4 豚鼠前部及后极部RPE细胞中bFGF蛋白表达 1:对照组前部;2:实验组前部(6d);3:实验组前部(15d);4:实验组前部(30d);5:对照组后极部;6:实验组后极部(6d);7:实验组后极部(15d);8:实验组后极部(30d)。
3 讨论
碱性成纤维细胞生长因子(bFGF)在体内广泛分布,它能够参与细胞外基质的形成,诱导基质金属蛋白酶的表达,减少胶原的形成。以往研究表明,形觉剥夺性近视眼(form deprivation myopia,FDM)巩膜后极部bFGF的表达明显降低,而在视网膜色素上皮脉络膜的表达与非FDM组类似[4]。bFGF对近视的眼轴延长提供了一个停止信号,对FDM眼行玻璃体或球结膜下注射bFGF均能抑制FDM的形成,而且与bFGF呈剂量相关性[5]。bFGF的免疫活性水平在FDM眼视网膜外层中升高。故推测形觉剥夺这种异常的视觉环境使视网膜细胞表达bFGF基因,产生bFGF后作用于剥夺眼而产生上述变化[6]。由此表明, bFGF也许代表作用RPE的视网膜信息以及其可能通过某些中介因子调控巩膜MMP-2 mRNA表达,影响FDM形成。
表2 RPE细胞中不同时期bFGFm RNA表达的对比±s
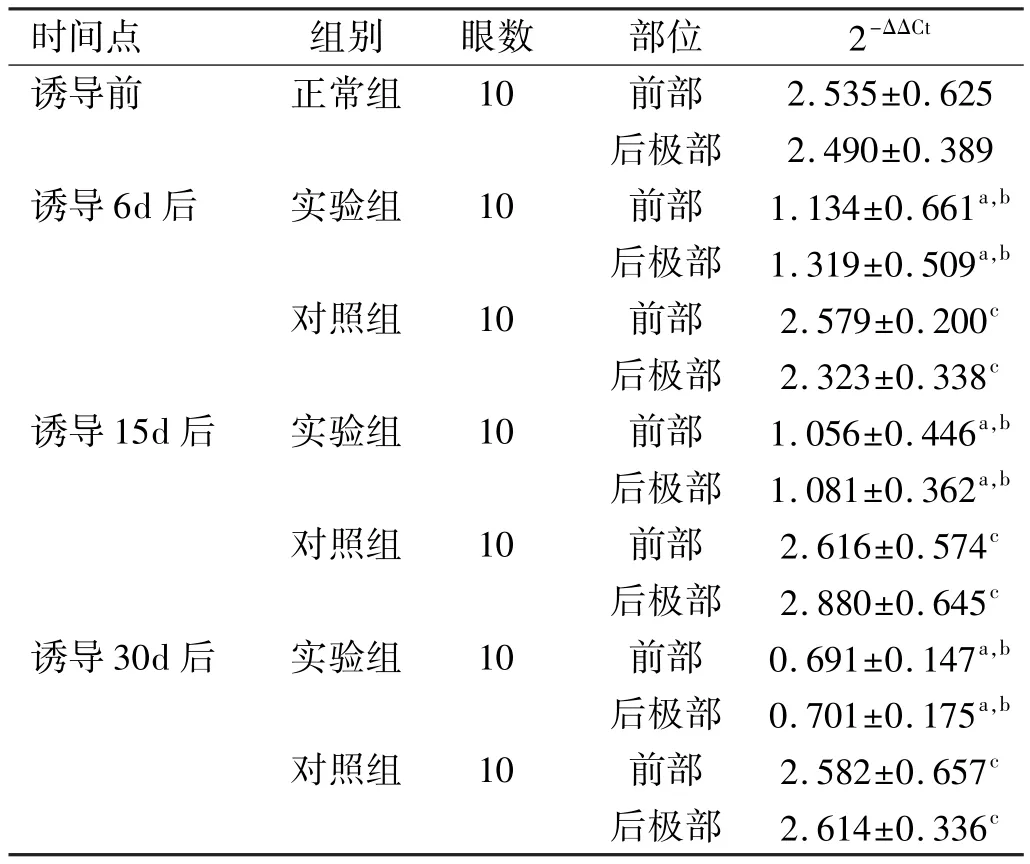
表2 RPE细胞中不同时期bFGFm RNA表达的对比±s
注:aP<0.05 vs对照组;bP<0.05 vs诱导前;cP>0.05 vs诱导前。
时间点组别眼数部位2-ΔΔCt诱导前正常组10前部2.535±0.625后极部2.490±0.389诱导6d后实验组10前部1.134±0.661a,b后极部1.319±0.509a,b对照组10前部2.579±0.200c后极部2.323±0.338c诱导15d后实验组10前部1.056±0.446a,b后极部1.081±0.362a,b对照组10前部2.616±0.574c后极部2.880±0.645c诱导30d后实验组10前部0.691±0.147a,b后极部0.701±0.175a,b对照组10前部2.582±0.657c后极部2.614±0.336c
表3 RPE细胞中不同时期bFGF蛋白表达的对比±s
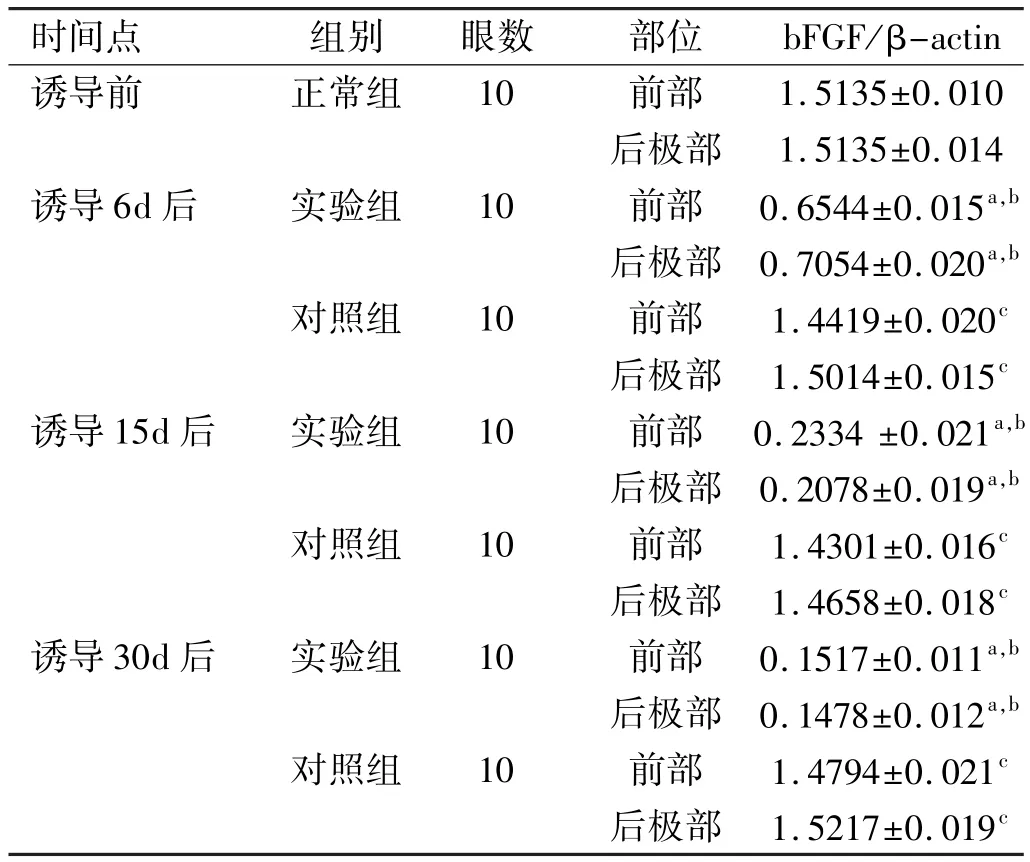
表3 RPE细胞中不同时期bFGF蛋白表达的对比±s
注:aP<0.05 vs对照组;bP<0.05 vs诱导前;cP>0.05 vs诱导前。
时间点组别眼数部位bFGF/β-actin诱导前正常组10前部1.5135±0.010后极部1.5135±0.014诱导6d后实验组10前部0.6544±0.015a,b后极部0.7054±0.020a,b对照组10前部1.4419±0.020c后极部1.5014±0.015c诱导15d后实验组10前部0.2334±0.021a,b后极部0.2078±0.019a,b对照组10前部1.4301±0.016c后极部1.4658±0.018c诱导30d后实验组10前部0.1517±0.011a,b后极部0.1478±0.012a,b对照组10前部1.4794±0.021c后极部1.5217±0.019c
Seko等[4]用酶联免疫吸附法发现在FDM巩膜后极部bFGF的表达明显降低,而在视网膜-色素上皮-脉络膜的表达与非FDM组类似。Rohrer等[5]研究认为bFGF对近视的眼轴延长提供了一个停止信号。他对FDM眼行玻璃体或球结膜下注射bFGF均能抑制FDM的形成,而且与bFGF成剂量相关性。毛俊峰等[7]发现:玻璃体腔注射bFGF能有效抑制鸡FDM形成,同时下调后极部巩膜MMP-2 mRNA表达。认为外源性bFGF要想畅通无阻地通过视网膜、脉络膜直接作用于巩膜,调控MMP-2 mRNA表达是不可能的。魏海英等[6]研究发现:在鸡的形觉剥夺性近视模型中,bFGF在实验眼、对照眼均有表达,但实验眼染色浓于对照眼,视网膜外层染色浓于内层,表明FDM中有bFGF的参与。bFGF的免疫活性水平在FDM眼视网膜外层中升高。故推测形觉剥夺这种异常的视觉环境使视网膜细胞表达bFGF基因,产生bFGF后作用于剥夺眼而产生上述变化。以上实验中bFGF对FDM的影响表明: bFGF也许代表作用于RPE的视网膜信息;bFGF可能通过某些中介因子调控巩膜MMP-2 mRNA表达,影响FDM形成。
在本实验中,通过观察不同诱导时间、不同诱导部位的RPE细胞中的bFGF动态表达,发现实验组与对照眼相比,bFGF的表达轻度下降,有显著差异。但是,无论在实验组还是在对照组,前部RPE的bFGF表达与后极部RPE的bFGF表达无显著差异。这表明:在透镜诱导豚鼠近视眼形成过程中,RPE细胞中bFGF活性在整体RPE细胞中普遍下降,而不是以后极部为主;说明bFGF与近视眼后极部后巩膜葡萄肿的病理性变化无直接联系。而Gentle则发现巩膜中的bFGF受体FGFR-1的mRNA水平上调,说明bFGF也许通过与其他因子或传导信号相结合对近视眼后极部变化的形成发挥着间接作用。
本研究由于时间有限,只对RPE细胞中bFGF及bFGF mRNA的表达进行了半定量及定量研究。RPE细胞中bFGF有阳性表达,参与豚鼠实验性近视眼的形成,但是哪些信号使bFGF表达发生改变,而bFGF又是通过怎样的途径到达巩膜,引起巩膜改变的信号又是什么,还有待于进一步研究。另外由于时间紧迫,未对“RPE-脉络膜级联系统”[8]中的脉络膜黑色素细胞进行研究,还有待下一步实验进行完善。
1 Ishigooka H,Aotaki-keen AE,Hje Ineland LM.Subcellular localization of bFGF in human retinal pigment epitheliumin vitro.Exp Eye Res1992; 55(2):203-214
2 Sternfeld MD,Robertson JE,Shipley GD,et al.Cultured human retinal pigment epithelial cells express basic fibroblast growth factor and its receptor.Curr Eye Res 1989;8(10):1029-1037
3 Zhang NL,Samadan EE,Frank RN.Mitogenesis and retinal pigment epithelial cell antigen expression in the rat after Rrypton laser photo coagulation.Invest Ophthalmol Vis Sci 1993;34(8):2412-2424
4 Seko Y,Shimokawa H,Tokoro T.Expression of bFGF and TGF-β2 in experimental myopia in chickens.Invest Ophthalmol Vis Sci1995;36(6): 1183-1187
5 Rohrer B,Iuvone PM,Stell WK.Stimulation of dopaminergic amacrine cells by stroboscopic illumination or fibroblast growth factor(bFGF,FGF-2) injections:possible roles in prevention of form-deprivation myopia in the chick.Brain Res 1995;686(2):169-181
6魏海英,崔浩.鸡形觉剥夺性近视眼形态学及bFGF免疫组织化学研究.眼科研究2007;25(1):22-24
7毛俊峰,刘双珍.bFGF对鸡形觉剥夺性近视眼的抑制作用.国际眼科杂志2005;5(4):652-654
8胡诞宁,McCormick SA.视网膜色素上皮-脉络膜在近视发病中的作用.眼视光学杂志2000;2(4):197-200
Altered bFGF expression in retinalpigment epithelial cells from guinea pigmodel with early stage of experimentallyinducedmyopia
Bo-Yu Chen1,Chao-Ying Wang1,W ei-Yi Chen2, Ying-Qing Liu1,Lan Hao1
1Department of Ophthalmology,Bethune International Peace Hospital,Shijiazhuang 050082,Hebei Province,China;2Institute of Biomechanics Research,Taiyuan University of Technology, Taiyuan 030001,Shanxi Province,China
Foundation item:Natural Scinece Foundation of Hebei Province (No.H2012505009)
Bo-Yu Chen.Department of Ophthalmology, Bethune International Peace Hospital,Shijiazhuang 050082,Hebei Province,China.chenby2190@126.com
·AIM:To determine the expression of basic fib rob last grow th factor(bFGF)in retinal pigment epithelial(RPE) cells from anterior and posterior part of guinea pig eyes with lens-induced myopia(LIM).·METHODS:Thirty two-w eek-aged guinea pigs were randomly divided into three groups,group A,group B and group C.Another five guinea pigs(10 eyes)w ere chosen as control group without any treatment.Concave lenses were worn by the 30 guinea pigs on either side of their eyes.After 6,15 and 30d,the lenses were removed and optometry and axial length were used to make sure the myopia had form ed.The retinal pigment epithelial cells of each group were cultured and passaged in vitro using enzymatic digestion method.The cultured cells at 3~6 generation was detect by immunocytolchemistory, Real-Time PCR and Western blotting to detect the expression of bFGF.·RESULTS:The expression of bFGF was located in the cytoplasm and nucleus.The results of immunocytolchemistory,Real-Time PCR and Western blotting showed that the expression of bFGF were detected at anterior and posterior part of eyes from experiment group and control group,the expression in experiment group at both part was significantly lower than those in control group(P<0.05).The positive percentage of expression of bFGF in experiment group decreased with the induced time(P<0.05).The expression of bFGF from anterior part of both experiment group and control group was as the same as that from posterior part of them selves(P>0.05).·CONCLUSION:The expression of bFGF from anterior and posterior part of experiment group was lower than those of control group.
guinea pig;retinal pigment epithelial cells;basic fibroblast growth factor; immunocytochemistry;Rea l-Time PCR Analysis; Western blotting
河北省自然科学基金资助项目(No.H2012505009)
作者单位:1(050082)中国河北省石家庄市,白求恩国际和平医院眼科;2(030001)中国山西省太原市,太原理工大学生物力学研究所
陈博宇,女,博士,副主任医师,研究方向:近视、白内障、眼底病。
陈博宇.chenby2190@126.com
2015-05-13
2015-10-23
:Chen BY,Wang CY,Chen WY,et al.Altered bFGF expression in retinal pigment epithelial cells from guinea pig model with early stage of experimentally-induced myopia.Guoji Yanke Zazhi(Int Eye Sci)2015;15(11):1857-1861
10.3980/j.issn.1672-5123.2015.11.05
Received:2015-05-13 Accepted:2015-10-23
方法:两周龄豚鼠30只随机分为A组、B组、C组,每组10只,再随机选取5只10眼正常两周龄豚鼠不作任何干预,作为正常对照眼。选取任意眼戴一-10.00D凹透镜,分别饲养6、15、30d后除去镜片,验光及测眼轴长度确定近视形成后,采用细胞酶消化法培养豚鼠的前部及后极部RPE细胞,取3~6代RPE细胞进行免疫细胞化学、实时荧光定量PCR、Western-blot蛋白印迹法检查前部及后极部RPE细胞中bFGF表达变化。
结果:bFGF的表达定位于细胞浆和细胞核。免疫细胞化学、实时荧光定量PCR、Western-blot蛋白印迹法结果均表明:A、B、C三组实验眼和对照眼前部及后极部RPE细胞均有bFGF的表达,实验组前部及后极部与对照组相应前部及后极部比较,实验组中bFGF的阳性率低于对照组,差异有统计学意义(P<0.05);而且,随着诱导时间的推移,实验组的阳性率逐渐降低,差异有统计学意义(P<0.05),对照组的阳性率不变,差异无统计学意义(P>0.05);但实验组和对照组各组自身前部及后极部比较,差异无统计学意义(P>0.05)。
结论:实验组前部及后极部与对照组相应前部及后极部比较,bFGF的表达显著低于对照组。
猜你喜欢
杂志排行
国际眼科杂志的其它文章
- LASEK for the correction of hyperopia with mitomycin C using SCHWIND AMARIS excimer laser:one-year follow-up
- Hospitalised ocular injuries in Osogbo,Nigeria
- Com parison of sub-Tenon's anaesthesia in phacoemulsification w ith 3 and 5 m L lidocaine
- Comparison of combined phacoemulsification-nonpenetrating deep sclerectomy and phacoemulsificationtrabeculectom y
- 小鼠眼眶成纤维细胞TLR4基因静默对甲状腺眼病的效应研究
- 小鼠视网膜电图随生长发育的变化特点
