籽瓜皮多酚的提取及其抑菌作用研究
2015-01-11刘忠义刘文平
刘忠义,彭 丽,包 浩,谭 操,刘文平
湘潭大学化工学院食品与生物工程系,湘潭 411105
籽瓜(Citrullus lanatus ssp.Vulgaris convar.megalaspermus Lin et Chao)系葫芦科西瓜属植物,为普通西瓜的栽培变种,原产于非洲,现在我国甘肃等地大量种植,具有较高的营养、保健和经济价值[1-3]。传统上,籽瓜常用于取籽,其皮和瓤被大量丢弃,在一定程度上造成了资源的浪费。从自然资源中获取天然活性成分,已成为当前的研究要点。研究显示,籽瓜多酚具有一定的抗氧化和抗肿瘤活性,然而籽瓜多酚的其他活性鲜见报道。多酚广泛分布于植物、水果蔬菜中[4],具有较高的保健和经济价值,在医药、食品、日用品等行业[5]都有很高的利用价值。本文以籽瓜皮为原料,通过超声波辅助提取多酚,并通过高效液相色谱(HPLC)鉴定籽瓜皮多酚提取物的主要成分,通过微生物培养法探讨其抑菌作用,旨在为籽瓜皮、囊的深加工利用提供理论依据。
1 材料与仪器
1.1 材料
籽瓜摘自湘潭籽瓜实验种植基地,选取成熟无破损的籽瓜,清洗干净,去除绿衣和瓜瓤,将瓜
皮打浆粉碎,于-80 ℃超低温冰箱中保存,使用前置于4 ℃的冰箱中融解备用。大肠杆菌由湘潭大学微生物实验室保藏提供。
1.2 药品与试剂
BHT、乙醇、Na2CO3、FeSO4等均为分析纯;没食子酸标准品(色谱纯,批号:MUST-11122813),成都曼思特生物科技有限公司;福林酚试剂,合肥博美生物科技责任有限公司;氨苄西林,市售。
1.3 仪器与设备
Forma-86ULT 型超低温冰箱(美国Thermo 公司),GL21M 高速冷冻离心机(长沙英泰仪器有限公司),尤尼RE-2000A 型旋转蒸发仪(上海雅荣生化设备仪器有限公司),WFZ UV-2802SH 型紫外可见分光光度计(上海柯仪器有限公司),QTR3120 型超声波清洗机(天津市瑞普电子仪器公司),XW-80A微型旋涡混合器(上海硕光电子科技有限公司),BHC-1300ⅡA2 生物安全柜[阿尔泰实验室设备(北京)有限公司]。
2 实验方法
2.1 多酚的测定
多酚的测定采用Folin-Ciocalteu 比色法,以没食子酸作为标准物,参照文献[6]所介绍的方法,适当改动。分别准确量取0.1 mg/mL 没食子酸标准溶液0、0.2、0.4、0.6、0.8、1.0、1.2 mL 于10 mL 比色管中,各加6 mL 水,混合均匀,加入0.5 mL 福林酚试剂,摇匀。3 min 之后,加入200 g/mL 碳酸钠溶液1.0 mL,超纯水定容。30 ℃水浴条件下反应30 min,于740 nm 波长下测定吸光度,所有样品平行操作三次,建立标准曲线。
2.2 超声波辅助提取条件确定
按不同的料液比,准确称取一定量的籽瓜皮浆于烧瓶中,加入不同体积分数的乙醇,将烧瓶放入超声波机中,在不同的温度下提取不同的时间。每次提取后,收集提取液,抽滤,浓缩,按照2.1 所述方法测定其多酚含量。多酚得率按下式计算:
W=m/M
其中,W:多酚提取率,mg/g;M:样品质量,g;m:籽瓜皮多酚含量,mg。
在单因素实验的基础上,设计L9(34)正交实验,考察提取时间、乙醇浓度、提取温度、料液比对样品中多酚提取率的影响,优化出超声波辅助提取多酚的最佳工艺参数。L9(34)正交实验因素与水平设计见表1。

表1 L9(34)正交因素与水平Table 1 Factors and levels of the orthogonal test
2.3 籽瓜皮多酚主要成分测定
称取10 mg 没食子酸标准品,溶于100 mL 容量瓶中,得0.1 mg/mL 没食子酸标准液,以此标准液配制不同浓度的没食子酸系列标准液,经液相色谱得到没食子酸液相色谱图。籽瓜皮多酚提取物,经离子沉淀法纯化及与提取液等体积的乙酸乙酯萃取三次之后,浓缩至1 mL。经0.45 μm 微孔滤膜过滤后进色谱柱,根据保留时间定性,外标法定量,进行籽瓜皮多酚主要成分分析。色谱柱Inertsil ODS-SP C18柱(150 mm×4.6 mm,5 μm);柱温:30 ℃;流速:1.0 mL/min;进样量:20 μL;检测器:spd-m20a 光电二极管阵列检测器;检测波长:280 nm。流动相:乙腈(A),质量分数0.4%甲酸溶液(B);梯度洗脱程序:0~5 min,25%A;5.01~10.00 min,80%A;10.01~15.00 min,10%A,15.01~25.00 min,25%A。
2.4 籽瓜皮多酚的抑菌实验
籽瓜多酚的大肠杆菌抑菌实验参照文献[7]完成。采用牛肉膏蛋白胨固体培养基。吸取0.1 mL预先培养并制好的菌悬液,加入到约15 mL 未凝固已灭菌的培养基中,震荡混合均匀,倒入插有牛津杯的培养皿,培养基凝固后,于牛津杯中加入0.2 mL 0.4 mg/mL 的经过乙酸乙酯萃取的籽瓜皮多酚提取液,然后入恒温箱37 ℃培养48 h。2 mg/mL 氨苄西林做阳性对照,0.9%生理盐水做阴性对照。
2.5 籽瓜皮多酚最低抑菌浓度测定
采用牛肉膏蛋白胨液体培养基。在无菌条件下,取无菌试管10 支(15×100 mm),每管加入液体培养基2 mL,在第1 管加入0.4 mg/mL 籽瓜皮多酚提取液2 mL,连续倍比稀释至第8 管,并从第8 管中吸取2 mL 弃去,第9 管为细菌生长对照,第10 管为药物对照。在每管内加入制备好的菌悬液0.1 mL。接种完毕后,置于37 ℃恒温培养箱培养24 h。肉眼观察,不发生混浊变化的最高提取物稀释倍数即为该提取物的最低抑菌浓度。
2.6 数据处理
所有试验均采用三次平行试验的平均值,图用Origin(Pro)7.5 绘制,数据间差异用SPSS13.0 进行方差分析和多重比较,结果以平均值±标准偏差表示。
3 结果与分析
3.1 多酚标准曲线
按1.3.1 所述方法,进行测定,利用Origin7.5分析得标准曲线回归方程为:A=0.01794+91.18452C,R=0.99946。式中:A 为吸光度,C 为浓度,mg/mL。
3.2 不同提取条件对多酚提取率的影响
选用70 mL/100 mL 的乙醇,料液比1∶5,在40℃温度下超声波辅助提取,探讨不同提取时间对提取率的影响。实验结果见图1A。由图1A 看出:随着提取时间的增加,多酚提取率增加;然而,提取时间达到40 min 之后,随着提取时间增加多酚的提取率反而降低。这和橄榄[8]、西兰花[9]和板栗总苞[10]等多酚提取时所得结果一致。由于酚羟基易被氧化,超过一定提取时间,其某些活性被破坏[11],故提取时间对多酚提取率的影响存在阈值。
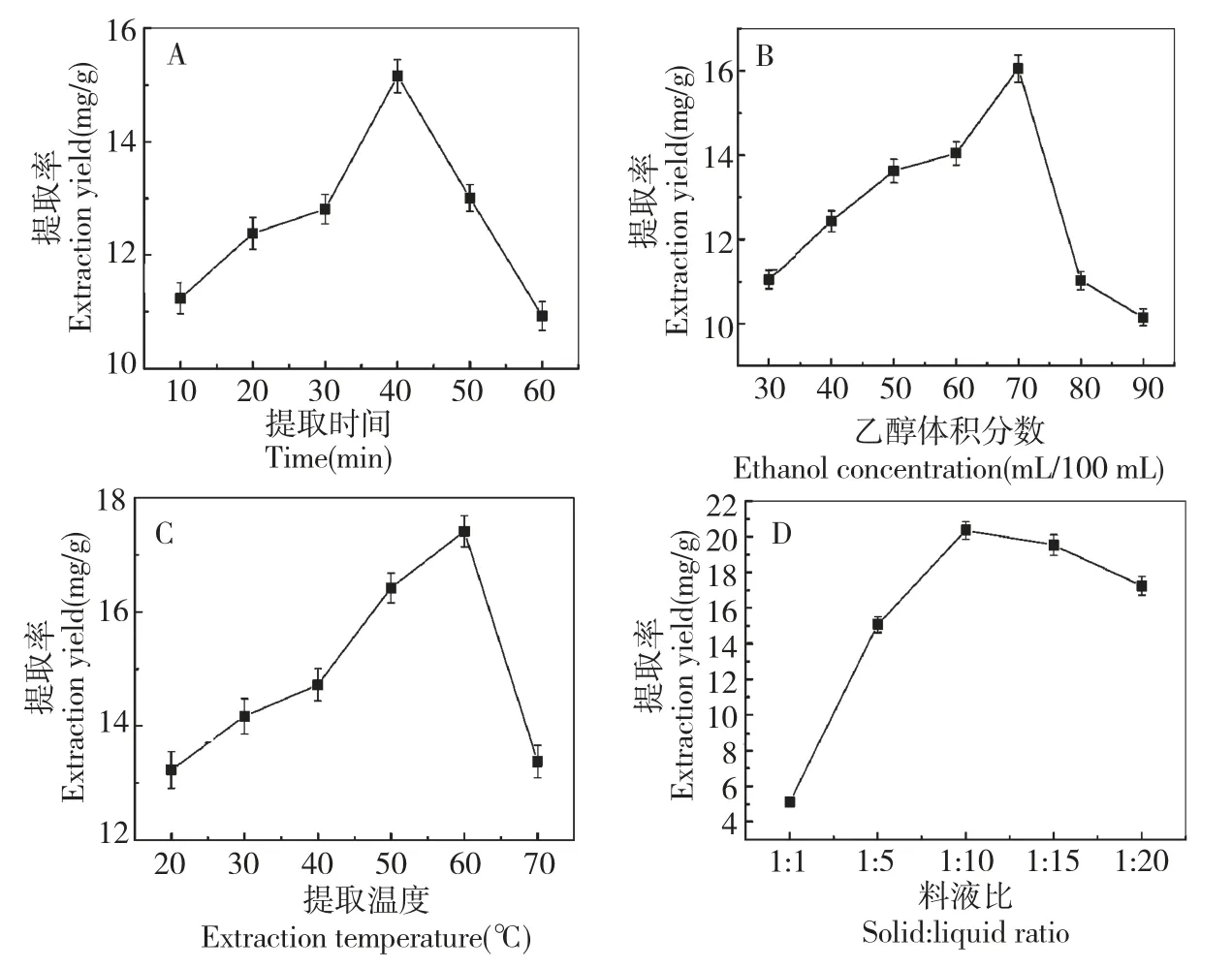
图1 提取时间(A)、乙醇浓度(B)、提取温度(C)和料液比(D)对多酚提取率的影响Fig.1 Effect of extraction time(A),ethanol concentration(B),extraction temperature(C)and ratio of solid to liquid(D)on yield of polyphenols
选用料液比1∶5,温度40 ℃,提取时间40 min,超声波辅助提取,研究不同乙醇浓度对提率的影响。由图1B 看出:随着乙醇浓度的增大,多酚提取率增加;当乙醇浓度超过70 mL/100 mL 之后,多酚的提取率随乙醇体积浓度增加反而降低。此结果与桑叶多酚的提取实验结果基本一致[12],与橄榄[8]、西兰花[9]和板栗总苞[10]等多酚提取时所呈现的趋势相同,但最佳乙醇浓度有一定差别。这表明醇浓度对多酚的提取率存在影响,且很可能是由于70 mL/100 mL 的乙醇与籽瓜多酚的极性相近,因而籽瓜多酚在70 mL/100 mL 的乙醇中溶解度较高[13]。
选用料液比1∶5,乙醇浓度70 mL/100 mL,提取时间40 min,超声波辅助提取,探讨不同提取温度对提率的影响。实验结果见图1C。由图1C 看出:随着提取温度数的增大,多酚提取率增加;当提取温度超过60 ℃之后,多酚的提取率随温度增加而降低。究其原因可能是由于多酚不稳定,温度高时多酚物质分解[14]。由图1C 还可知,提取温度对多酚提取率的影响存在阈值,甘薯渣中多酚[14]、西兰花多酚[9]、板栗总苞多酚[10]提取时最佳温度分别为80、50、65 ℃。温度对多酚的提取存在一定影响,但对不同的原料,其多酚种类和含量及其存在状态存在差别,故温度的影响不同,导致最佳提取温度差别较大。
选用乙醇浓度70 mL/100 mL,温度60 ℃,提取时间40 min,超声波辅助提取,探索不同料液比对提取率的影响。实验结果见图1D。由图1D 看出:随着料液比的增大,多酚提取率增加;当料液比超过1∶10 之后,多酚的提取率随料液比增加反而降低。一方面由于水的用量过少,有效成分不能很好的溶出,而另一方面水的用量过多,杂质成分含量增多,使多酚相对含量减少[12]。由图可知,料液比对多酚提取率的影响存在阈值,这一结果与西兰花多酚[9]、板栗总苞多酚[10]、生姜多酚[14]提取时所得结果相同。但对于不同的原料,最佳的料液比不同,这可能与原料的结构、组成以及含水量有关。
3.3 多酚提取条件的优化
正交实验结果见表2。由表2 直观观察,2 号实验即提取时间为35 min,乙醇浓度为70 mL/100 mL,提取温度为60 ℃,料液比为1∶10 时,多酚的提取率最高。而根据K 值分析得出最优因素水平组合为A1B2C2D1,即提取时间为35 min,乙醇浓度为70 mL/100 mL,提取温度为60 ℃,料液比为1∶12。通过极差分析,可以看出料液比对多酚提取率的影响最大、时间次之,温度的影响较小,乙醇浓度影响最小。最优因素水平组合未直接出现在正交表中,故需对最优条件进行实验验证。
取正交表中2 号实验的工艺条件和最佳组合工艺条件进行实验,每组实验平行3 次,取平均值。2号实验的提取率为33.21±0.89 mg/g,最佳组合的提取率为38.37±1.02 mg/g。结果表明,优化的因素水平组合A1B2C2D1的提取效果优于2 号实验的因素水平组合。
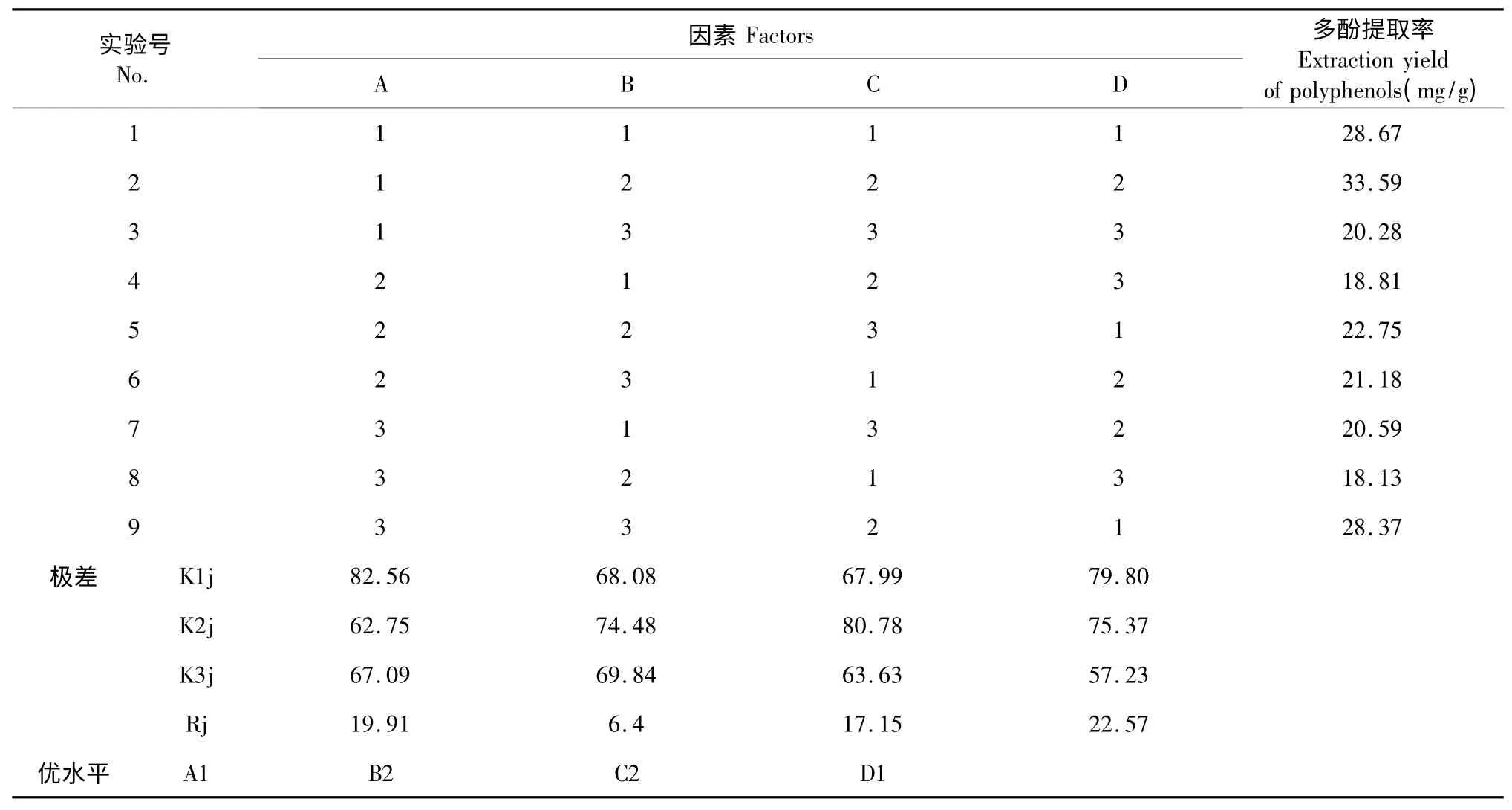
表2 正交实验结果Table 2 Results of the orthogonal test
3.4 籽瓜皮多酚主要成分
经测定,HPLC 能够较好地检测没食子酸(见图2A),其标准曲线为y=-72522.8+56624.2x,R=0.99674,P<0.0001,线性关系良好,能够用于定量分析。且该方法回收率为95.21%,标准偏差为0.55%,说明该方法准确可靠。图2B 表明,虽然样品峰有明显拖尾及尾部凸出,仍然可以确定籽瓜皮多酚的主要成分是没食子酸。没食子酸是植物多酚的重要组成成分之一[6,15],具有优越的抗氧化功能及诸多功能性质。
3.5 籽瓜皮多酚的抑菌效果
籽瓜皮多酚的抑菌实验结果见图3。结果表明,在接种大肠杆菌菌悬液的培养皿的滴加籽瓜皮多酚提取液的牛津杯周围形成明显的抑菌圈(图3A),而阴性对照滴加生理盐水的牛津杯周围没有抑菌圈产生(图3C),这表明籽瓜皮多酚提取物具备抑制大肠杆菌生长的作用。经测定,0.4 mg/mL 籽瓜皮多酚提取液形成的抑菌圈大小约为12.6±0.3 mm,低于2 mg/mL 氨苄西林溶液产生的36.5±0.4 mm 的抑菌圈(图3B)。这说明籽瓜皮多酚提取液具有明显的抑菌效果。由于籽瓜皮多酚提取物的主要成分为没食子酸,故很容易理解籽瓜皮多酚的抑菌作用。
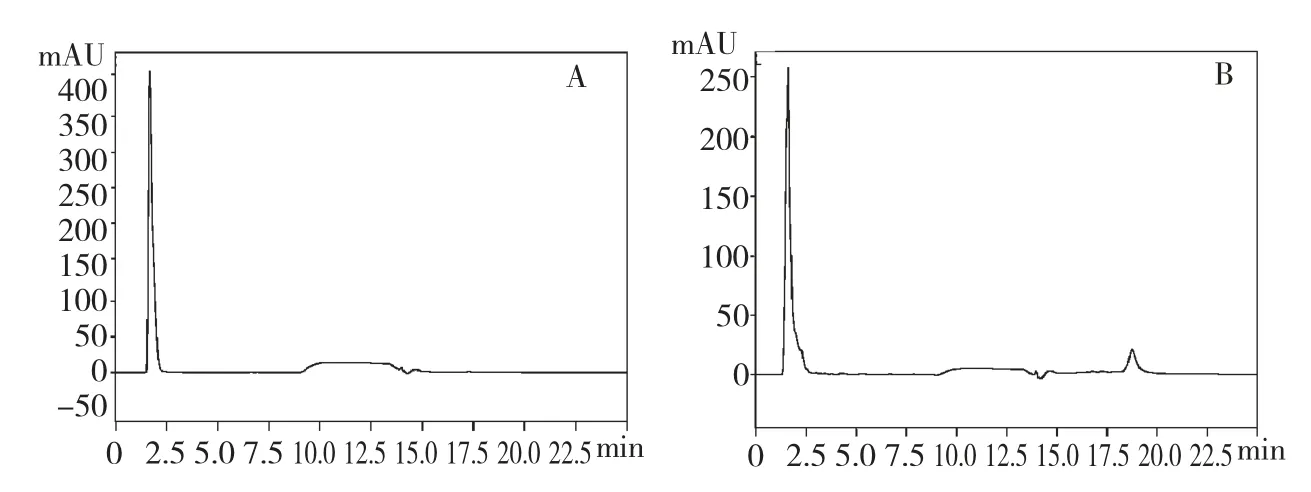
图2 没食子酸标准品(A)及籽瓜皮多酚提取物(B)的液相色谱图Fig.2 HPLC chromatograms of gallic acid standard(A)and polyphenol extract of seed watermelon peel(B)
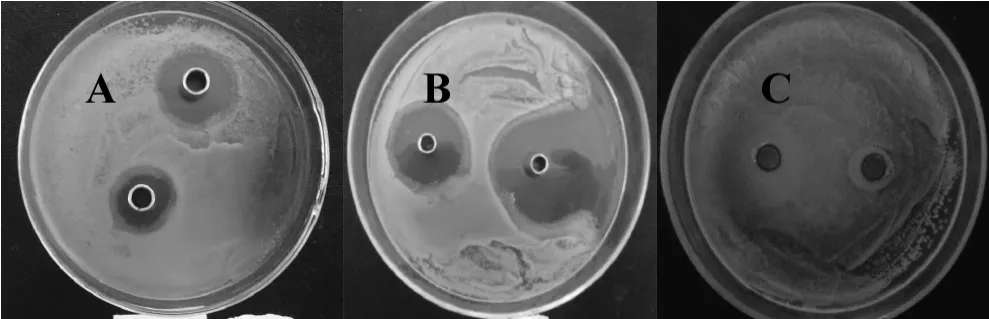
图3 籽瓜多酚(A)、氨苄西林(B)及生理盐水(C)的抑菌效果Fig.3 Anti-bacterial effect of polyphenol extracts of seed watermelon peel(A),ampicillin(B)and normal saline(C)
3.6 籽瓜皮多酚的最低抑菌浓度
籽瓜皮多酚的最低抑菌浓度实验结果见表3。由表3 可知,当籽瓜皮多酚浓度大于0.1 mg/mL,由于受到籽瓜皮多酚的抑制,大肠杆菌不能良好生长,故试管中培养基不出现浑浊现象,当籽瓜皮多酚浓度稀释至0.05 mg/mL 时,大肠杆菌表现出微弱的生长态势,故试管中培养基略微出现浑浊现象,当籽瓜皮多酚浓度继续稀释至0.0125 mg/mL 及以下时,大肠杆菌受到的抑菌程度很微弱,试管中培养基明显出现浑浊现象。由实验结果初步推断籽瓜皮多酚的最低抑菌浓度为0.05 mg/mL。

表3 籽瓜皮多酚提取液的最低抑菌浓度(n=3)Table 3 Minimal inhibitory concentration of polyphenol extract of seed watermelon peel(n=3)
4 讨论与结论
超声波由于诱导空化作用而有助于低温下提取植物中的有效成分,故超声波辅助提取在食品相关领域中得到比较广泛的应用[16]。超声波辅助提取籽瓜皮多酚有比较好的效果,经过试验得到籽瓜皮多酚的最佳提取条件为提取时间为40 min,乙醇浓度为70 mL/100 mL,提取温度为60 ℃,料液比为1∶12。
籽瓜皮多酚提取液的主要成分为没食子酸,这对进一步研究并理解籽瓜多酚提取液的抗氧化、抗菌等功能性质及其构效关系具有重要的意义。单宁类物质包括单宁(即没食子酸)、缩合单宁及复合单宁是很多植物中多酚类物质的主要成分[6,15]。没食子酸具有多个酚羟基,这是其具有优异抗氧化功能的结构基础。
籽瓜皮多酚对大肠杆菌具有明显抑制作用,其最低抑菌浓度经初步测定为0.05 mg/mL。大肠杆菌是食品中必须检测的微生物指标,是食品卫生的重要指标之一。大肠杆菌经常被用做抑菌研究实验对象[7]。目前,国内外对天然植物源性防腐剂研究异常活跃,本研究显示籽瓜皮多酚有望发展成为一种天然防腐剂。
1 Shao MM(邵苗苗),Li N(李娜),Zhao B(赵兵),et al.Research on health value of seed watermelon.Ningxia Agrecul Forest Sci Technol(宁夏农林科技),2012,53:86-87.
2 Liang Q(梁琪).Composition analysis of the seed melon pulp and peel from different regions in Gansu province.J Gansu Agric Univ(甘肃农业大学学报),1999,34:79-83.
3 Wang CP(王翠平).The antioxidant and antitumor activity of seed watermelon.Anhui Agric Sci(安徽农业科学),2011,39:17833-17836.
4 Song LJ(宋立江),Di Y(狄莹),Shi B(石碧).The significance and development trend in research of plant polyphenols.Prog Chem(化学进展),2000,12:161-170.
5 Wang D(王栋),Kang J(康健).Function,extraction and applications of tea polyphenols.J Xinjiang Univ,Nut Sci Ed(新疆大学学报,自科版),2007,24:217-221.
6 Min FQ(闽凡芹),Zhang ZH(张宗和),Qin Q(秦清),et al.Optimization of vaccum civitation extraction of tannic acid from Chinese gallnut using response surface method.Nat Prod Res Dev(天然产物研究与开发),2013,25:1240-1244.
7 Liu AJ(刘安军),Li HY(李海燕),Wang YX(王云霞),et al.Antimicrobial on E.coli activities of polysaccharide from Walnut kernel pellicle.Modern Food Sci Tech(现代食品科技),2010,27:29-31.
8 He ZY(何志勇).The isolation,purification and structure research of olive phenolic compounds.Wuxi:Jiangnan University(江南大学),PhD.2007.
9 Meng LY(孟丽媛),Wang FW(王凤舞).Extraction technology and antioxidant activity of broccoli polyphenols.J Chin Inst Food Sci Tech(中国食品学报),2013,13(5):62-67.
10 Shi EH(石恩慧),Li H(李红),Gu MC(谷明灿),et al.The process conditions optimization of the ultrasonic extraction of chestnut involucre polyphenols using response surface method.J Chin Inst Food Sci Tech(中国食品学报),2013,13(5):69-76.
11 Song L(宋蕾).Extraction optimization and biological activity research of polyphenols and volatile oil from thistle kadsura.Shanghai:Fudan University(复旦大学),PhD.2007:28-39.
12 Ding SH(丁双华),Ye LB(叶立斌),Chen W(陈卫),et al.Optimization extraction of mulberry leaf polyphenol using response surface method.J Chin Inst Food Sci Tech(中国食品学报),2012,12:52-58.
13 Huang D,Ou B,Prior RL.The chemistry behind antioxidant capacity assays.J Agric Food Chem,2005,53:1841-1856.
14 Tang SR(唐仕荣),Li C(李超),Song H(宋慧),et al.Optimization extraction and antioxidant property of ginger polyphenols.Sci Tech Food Ind(食品工业科技),2010,4:256-259.
15 Zhou L(周磊),Xu M(许敏),Yang CR(杨崇仁),et al.The advance of chemical components and bioactivity of fagaceous plants.Nat Prod Res Dev(天然产物研究与开发),2012,24:260-273.
16 Vilkhu K,Mawson R,Simons L,et al.Application and oppor-tunities for ultrasonic assisted extraction process in food industry.Innov Food Sci Emerg Tech,2008,9:161-169.
