α⁃葡萄糖苷酶与米格列醇相互作用及其进化关系
2015-01-09齐燕姣陆会宁金能智赵娅敏
齐燕姣,陆会宁,金能智,赵娅敏
(1.西北民族大学榆中校区化工学院,兰州730124;2.西北民族大学榆中校区生命科学与工程学院,兰州730124;3.甘肃省计算中心,兰州730000)
doi:10.3969/j.issn.1672-5565.2015.03.01
α⁃葡萄糖苷酶与米格列醇相互作用及其进化关系
齐燕姣1∗,陆会宁2,金能智3,赵娅敏1
(1.西北民族大学榆中校区化工学院,兰州730124;
2.西北民族大学榆中校区生命科学与工程学院,兰州730124;
3.甘肃省计算中心,兰州730000)
用生物信息学的方法分析不同物种的α⁃葡糖糖苷酶的亲缘关系,分析降血糖药物米格列醇与甜菜(Beta vulgaris)的α⁃葡糖糖苷酶相互作用位点在其他亲缘关系较近的物种中相应的氨基酸变化特点,结果表明米格列醇位于一个凹向酶分子内部的狭窄的结合口袋中,其间的相互作用主要以静电相互作用、氢键和范德华力为主。由于米格列醇的强水溶性和多羟基的特点,与酸性的天冬氨酸之间形成多个Ο⁃Η氢键,对甜菜(Beta vulgaris)的α⁃葡萄糖苷酶具有较好的抑制作用。通过TM⁃HMM预测甜菜(Beta vulgaris)的α⁃葡萄糖苷酶的序列,结果未发现跨膜区。通过多序列比对发现,在米格列醇与甜菜(Beta vulgaris)的α⁃葡萄糖苷酶相互作用位点处的氨基酸中,在与其亲缘关系较近的5个物种茶(Camellia sinensis),黄瓜(Cucumis sativus),木本棉(Gossypium arboretum),甘庶属割手密(Spontaneum)和蒺藜状苜蓿(Medicago truncatula)中有81.82%的氨基酸都是保守的,且主要是极性的氨基酸,如色氨酸和天冬氨酸。这为进一步研究降血糖药物在其他物种中的表现及相互作用提供了重要的科学依据。
α⁃葡萄糖苷酶;相互作用;序列比对;系统发育关系
α⁃葡萄糖苷酶(α⁃glucosidase)属于低聚糖水解酶类,包括麦芽糖酶,异麦芽糖酶、蔗糖酶和海藻糖酶等,对糖的分解代谢具有非常重要的作用。α⁃葡糖糖苷酶在自然界中分布广泛,性质各异,几乎存在于所有的生物体内,在人类的糖原降解和动物、植物、微生物的糖类代谢方面具有非常重要的生物功能[1-8]。α⁃葡糖糖苷酶与许多因代谢紊乱失调而引发的疾病有密切的关系,如糖尿病、癌症、病毒感染等。近年来的研究表明,α⁃葡萄糖苷酶参与糖蛋白中N-糖链的加工,因而在病毒感染以及肿瘤的浸润和转化中具有重要的地位[9-10]。α⁃葡萄糖苷酶抑制剂通过竞争性地抑制小肠刷状缘上皮细胞的α⁃葡萄糖苷酶,使淀粉分解成葡萄糖的速度减慢,从而延缓肠道内葡萄糖的吸收,降低餐后血糖的升高幅度。因此,寻找合适的抑制剂用于控制和调节α⁃葡萄糖苷酶的活性,对疾病的防治具有重要的临床意义。
米格列醇是第一类有效的α⁃葡萄糖苷酶抑制剂,它能显著降低餐后血清胰岛素水平[11],是由德国Bayer公司于20世纪80年代初研制开发并于1997年上市的一种新型α⁃葡萄糖苷酶抑制剂类药物[12]。米格列醇(Miglitol)的化学名称为1-(2-羟乙基)-2-(羟甲基)-3,4,5-哌啶三醇,其化学结构如图1所示,极性氢原子用数字进行标注。米格列醇对胰淀粉酶和α⁃葡萄糖苷酶具有高亲和力,能够抑制二糖、多糖和复合糖的水解,延缓葡萄糖和其它单糖的吸收,降糖效果比阿卡波糖和伏格列波糖更为有效[13-15]。尽管到目前已经有很多关于葡萄糖苷酶及其抑制剂之间的相互作用的研究[16-18],导致药物对α⁃葡萄糖苷酶抑制的作用研究受到限制。因此本文通过用生物信息学的方法分析不同物种的α⁃葡萄糖苷酶的氨基酸序列特点和进化关系,分析米格列醇与甜菜(Beta vulgaris)的α⁃葡萄糖苷酶相互作用的位点及其在其他物种中相应的氨基酸的异同点,通过分析α⁃葡萄糖苷酶的疏水性及其与米格列醇结合位点处的氨基酸特征,为进一步了解其他物种的α⁃葡萄糖苷酶的结构特点和分析米格列醇在其他物种中的抑制作用等提供理论依据。
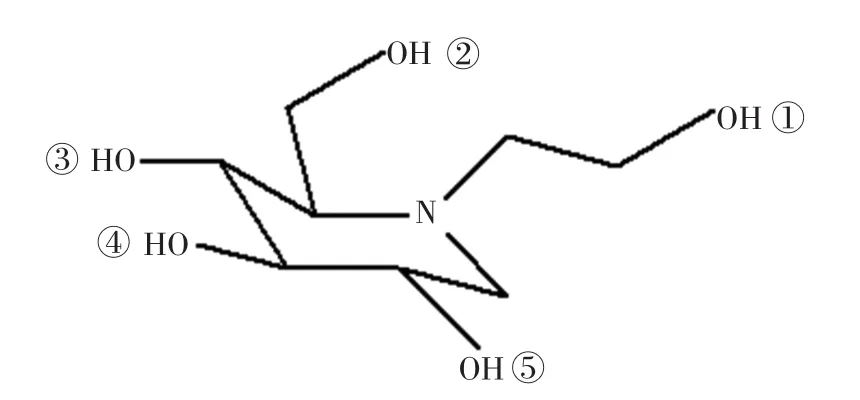
图1 米格列醇的二维平面化学结构Fig.1 The 2-D chem ical structure of them iglitol
1 材料和方法
1.1 蛋白质序列的准备
α⁃葡萄糖苷酶蛋白质的序列是从NCBI网站的蛋白质序列数据库(http://www.ncbi.nlm.nih.gov/protein)中下载得到的,α⁃葡萄糖苷酶复合物的晶体结构从 PDB数据库(http://www.rcsb.org/pdb/home/home.do)中下载(PDB ID:3WEL)。
1.2 蛋白质序列的特征分析
多序列的比对是通过ClustalX软件进行的[19];蛋白质的氨基酸序列长度和组成及等电点的分析是通过Lasergene软件进行的[20];序列的相似性分析是通过MegAlign软件中Lipman⁃Pearson方法进行的[21];采用DNAMAN(version 4.0,Lynnon Biosoft,Quebec,Canada)和ExPAsy的ProtScale程序分析蛋白质的疏水性[22]。用ExPASy提供的在线跨膜区预测软件TMHMM[23]和TMPRED[24]进行跨膜区分析。基于Jones⁃Taylor⁃Thornton(JTT)模型,采取缺失序列删除的方式,用MEGA的Neighbor⁃Joining (NJ)方法构建进化树[25],Bootstrap Replications设置为1 000。
1.3 分子结构优化和对接
在Pubchem上下载小分子米格列醇的结构,然后通过Chem3D软件的MM2法做构型优化[26],精确度为0.001。通过Gaussian软件的密度泛函理论B3LYP的方法和6⁃31G(D)的基组做进一步的几何优化[27]。分子的半柔性对接是用AutoDock4.2进行的,采用Lamarckian遗传算法(LGA),能量评估次数使用最大次数2.5×107,突变率设置为0.02,交叉率为0.80,最大迭代次数是300。以药物小分子为中心的格子尺寸定义为6 nm×6 nm×6 nm,间隔为0.037 5 nm,坐标为 x=0.210;y=-2.258;z=-22.464。最终得到的50个对接的构象中能量最小的作为稳定构象作进一步的分析。
2 结果与分析
2.1 蛋白质序列名称及组成
不同物种的α⁃葡糖糖苷酶序列名称及其不同类型氨基酸组成等性质如表1所示。其中大部分物种的 α⁃葡糖糖苷酶的氨基酸序列长度在 500~2 000 aa,但是氨基酸组成成分的比例比较接近,其中疏水性的氨基酸和极性的氨基酸都占有较大的比例,等电点都在5~9。
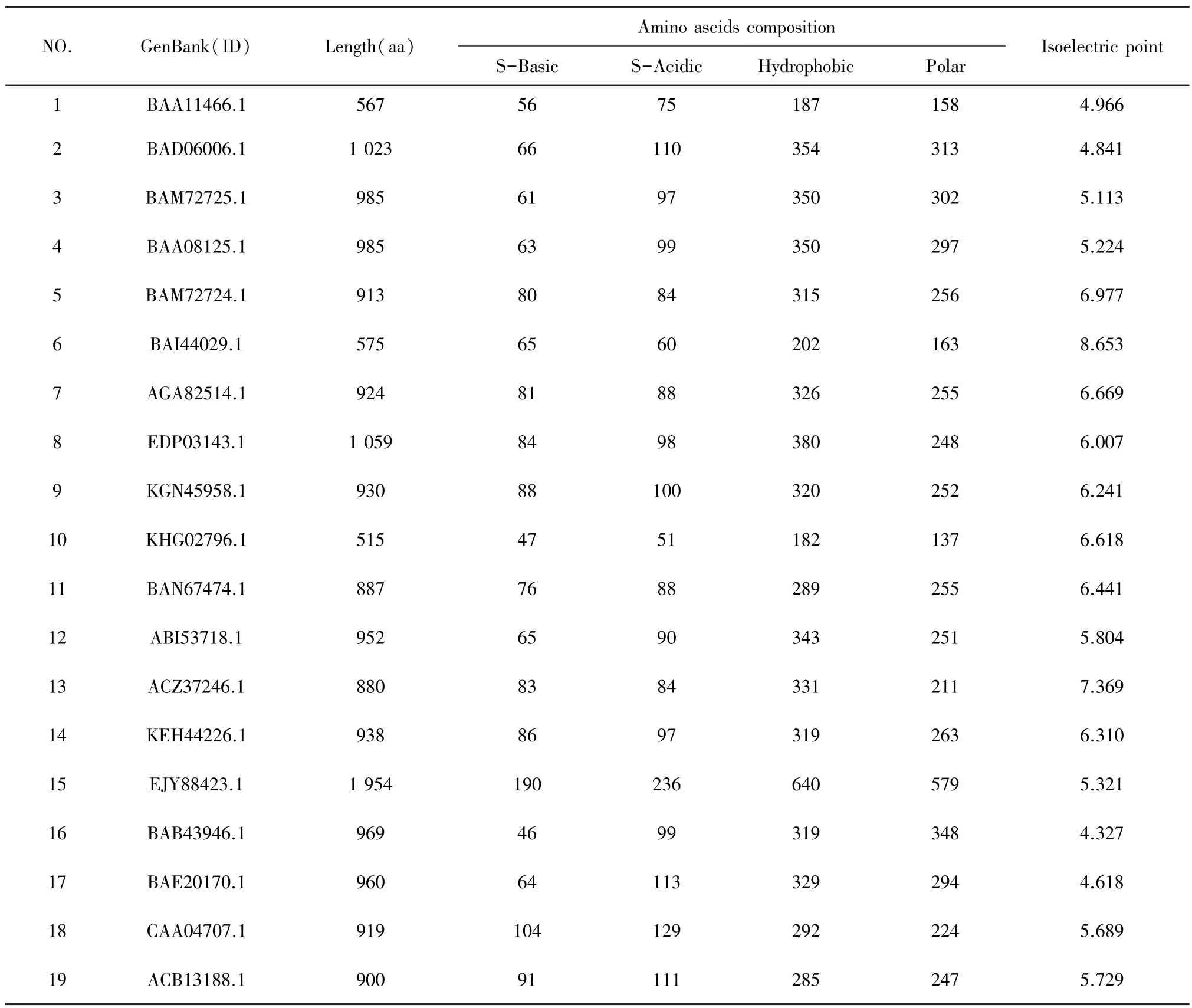
表1 不同来源α⁃葡糖糖苷酶的序列名称及氨基酸组成Table 1 Name and composition ofα⁃glucosidase am ino acid sequences from different sources
2.2 与药物作用的关键位点对比分析
α⁃葡萄糖苷酶对糖类物质的消化起着关键的作用[28],其抑制剂米格列醇因具有良好的降糖效果而被广泛应用。我们通过将米格列醇分子进行结构优化之后,再分析它与甜菜(Beta vulgaris)的α⁃葡萄糖苷酶的相互作用,从得到的构象中选择结合能最低(-6.93 kJ/mol)的构象,进一步分析其间的相互作用结合位点(见图2)。米格列醇与甜菜α⁃葡萄糖苷酶相互作用的活性位点与酵母菌α⁃葡萄糖苷酶的作用位点[29]比较相似,米格列醇都位于凹向酶分子内部的隧道形状的狭窄空腔内,米格列醇分子紧贴着结合口袋壁,深入其中,表现了很好的几何互补性。
从图3中可以看出,米格列醇基本上位于α⁃葡萄糖苷酶的一个周围大多是无规卷曲的结合口袋中,米格列醇与酶分子结合位点处的氨基酸大多是酸性和极性的氨基酸,如TRP329、ASP357、ILE358、ILE396、 TRP432、 TRP467、 ASP469、 MET470、ARG552、TRP565、ASP568和PHE601,其间的相互作用主要以静电相互作用、氢键和范德华力为主。其中天冬氨酸Asp357的OD1与米格列醇的氢原子H3和 H4之间形成两个 Ο⁃Η氢键,键长分别是0.180 1 nm和0.211 3 nm。天冬氨酸Asp568的氧原子OD1和OD2分别与米格列醇的氢原子H1和H2之间形成两个Ο⁃Η氢键,键长分别是0.211 8 nm和0.192 1 nm,图中以绿色的虚线表示。这一点与酵母菌α⁃葡萄糖苷酶的作用特点比较相似,都能够与米格列醇分子之间形成4个氢键,特别是与天冬氨酸Asp之间,如N原子连接侧链的羟基H和Asp214的氧原子之间、六元环上的羟基H和Glu276的氧原子之间及侧链上的羟基 O和 H分别与 Arg439和Asp349形成的氢键。正是由于米格列醇的强水溶性和多羟基的特点[30-34],才可以与α⁃葡萄糖苷酶的亲水性氨基酸形成较强的相互作用,与天冬氨酸的羧基氧原子之间形成多个氢键,因而对α⁃葡萄糖苷酶具有较强的抑制作用。研究表明,米格列醇具有更广泛的抑制作用,其原因可能是米格列醇与葡萄糖结构更为相似,更易接近酶的活性中心[35-38]。例如,尽管甜菜与酵母菌的 α⁃葡萄糖苷酶(SWISS PROT蛋白质数据库,序列号:P 53 341)的一级序列的相似性很低(通过Lipman⁃Pearson Parameters方法得到的仅有22.0%),但是它们与米格列醇的作用方式却极其相似。
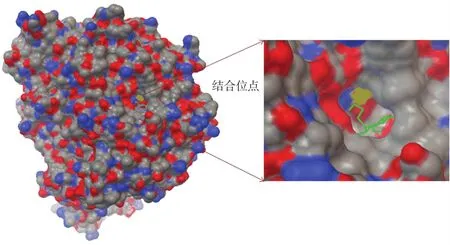
图2 米格列醇与α⁃葡萄糖苷酶相互作用结合位点Fig.2 The binding site of the interaction between miglitol andα⁃glucosidase
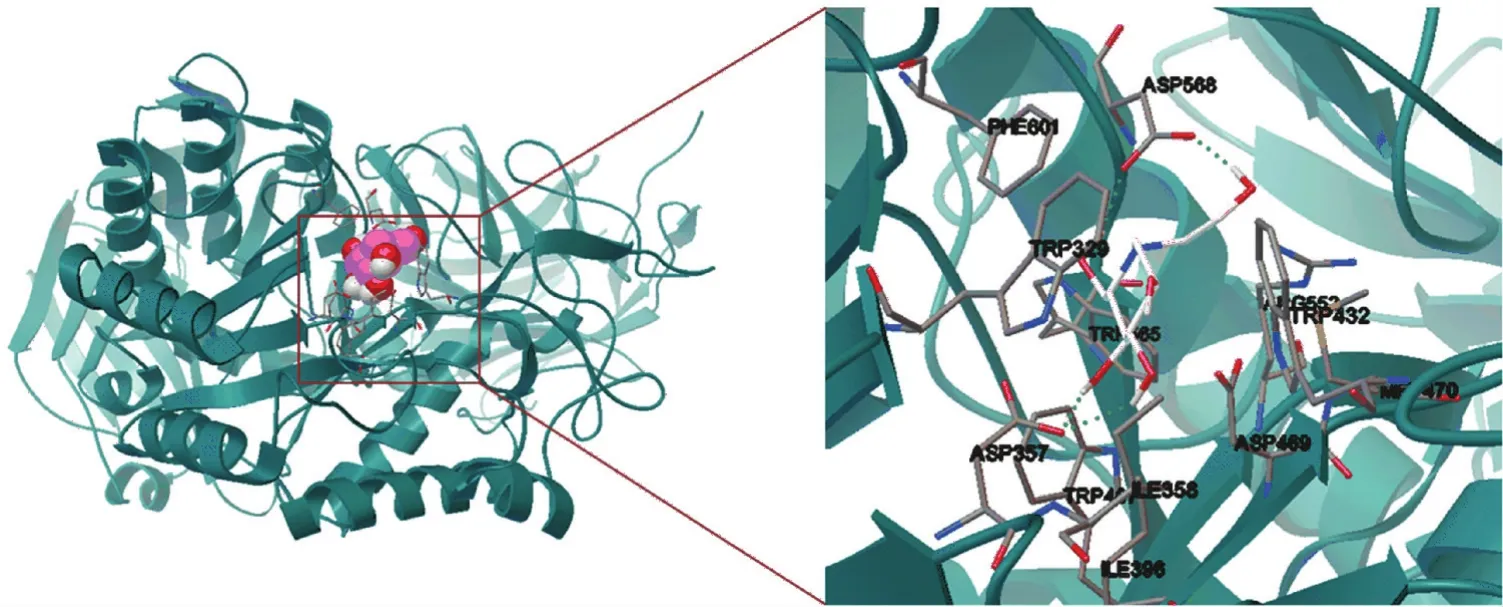
图3 米格列醇与α⁃葡萄糖苷酶之间的相互作用Fig.3 Interaction between miglitol andα⁃glucosidase
2.3 α⁃葡萄糖苷酶的序列特点
蛋白质的结构决定蛋白质的生物功能,疏水性是20种氨基酸均固有的特性,是决定蛋白质最终三维空间构象的重要因素之一,它在蛋白质结构的形成过程中起到了关键性作用[39-41]。用 ExPASy的Protscale程序计算甜菜(Beta vulgaris)的α⁃葡萄糖苷酶的疏水性图谱(见图4)。纵坐标0值以上为疏水区,0值以下为亲水区。纵坐标代表疏水性的分值,分值越高,疏水性越强,横坐标代表氨基酸的位置。从图中可以看出,亲水性的氨基酸比例大于疏水性的氨基酸。其中疏水性值最高值是3.55,最低值是-3.37。而在米格列醇与甜菜(Beta vulgaris)的α⁃葡萄糖苷酶相互作用的位点处的氨基酸中,大多都是亲水性的氨基酸。此外,通过TMHMM预测甜菜(Beta vulgaris)的α⁃葡萄糖苷酶的序列,结果未发现跨膜区(见图5)。
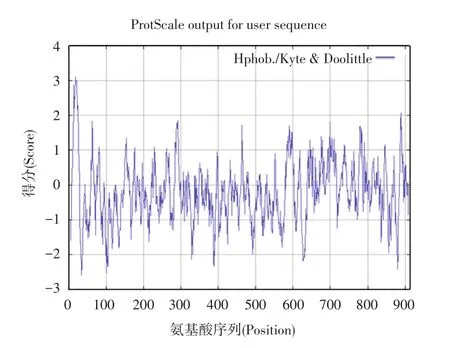
图4 Beta vulgaris的α⁃葡萄糖苷酶氨基酸序列的疏水性分析Fig.4 Hydrophobicity analysis forα⁃glucosidase sequence of the Beta vulgaris
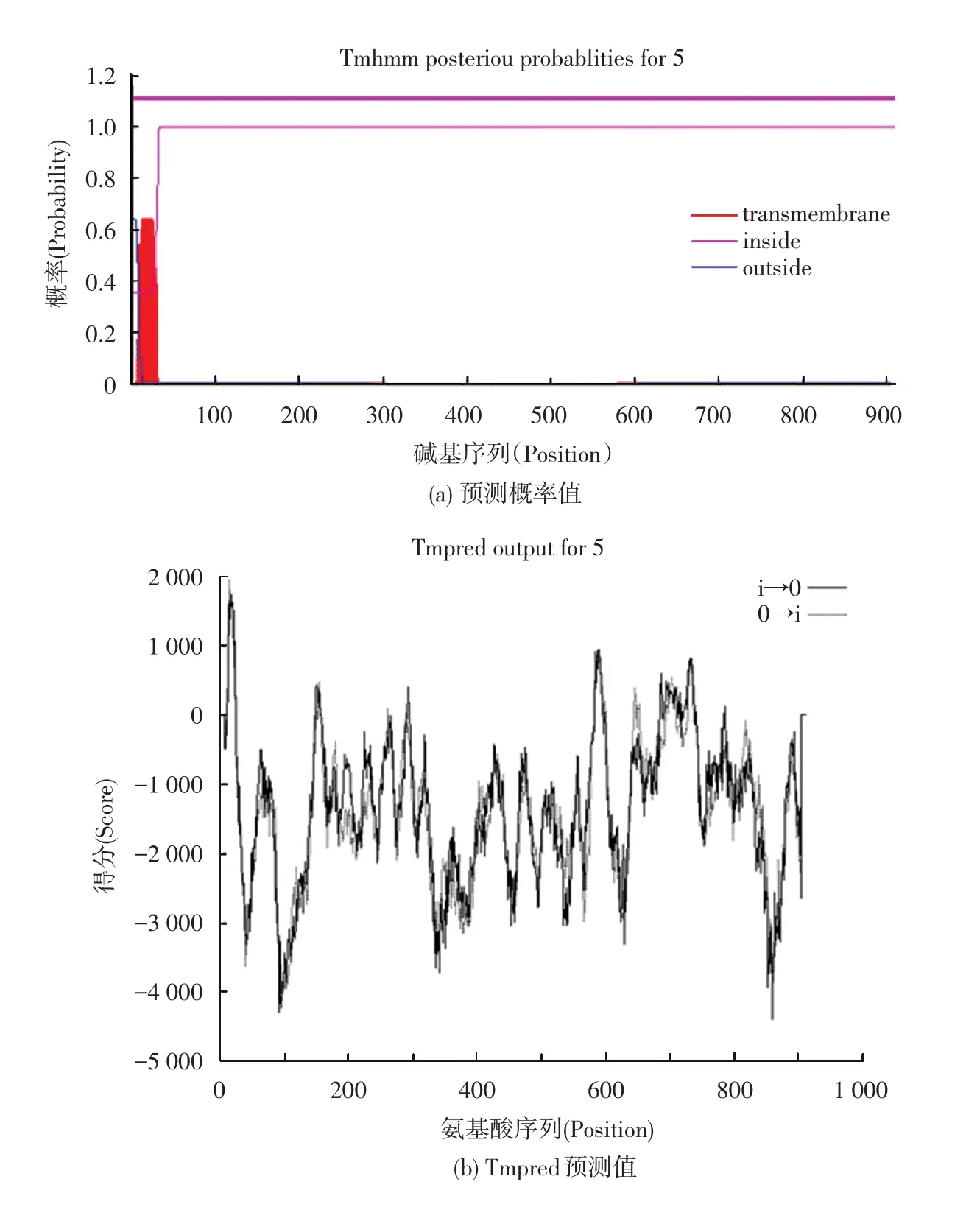
图5 Beta vulgaris的α⁃葡萄糖苷酶氨基酸序列的跨膜区分析Fig.5 Transmembrane region analysis forα⁃glucosidase sequence of the Beta vulgaris
2.4 α⁃葡萄糖苷酶的系统发育关系
不同物种来源的α⁃葡萄糖苷酶的序列组成和特点都不相同。通过对甜菜(Beta vulgaris)的α⁃葡萄糖苷酶与其他物种的序列进行比较,发现甜菜(Beta vulgaris)与意蜂(Apismellifera)、泡盛曲霉(Aspergil⁃lus Awamori)、黑曲霉(Aspergillus niger)、米曲霉(As⁃pergillus oryzae)、人(Homo sapiens)、熊蜂(Bombus di⁃versus diversus)、茶 (Camellia sinensis)、衣 藻(Chlamydomonas reinhardtii)、黄瓜(Cucumis sativus)、木本棉(Gossypium arboretum)、皱纹盘鲍(Haliotis dis⁃cus hannai)、甘蔗属割手密(Spontaneum)、蒺藜状苜蓿(Medicago truncatula)、单细胞生物(Oxytricha tri⁃ fallax)、粟酒裂殖酵母(Schizosaccharomyces pombe)、西方许旺酵母(Schwanniomyces occidentalis)、马铃薯(Solanum tuberosum)、嗜热真菌(Thermomyces lanugi⁃nosus)的序列相似性分别是36.4%、37.1%、39.1%、39.2%、18.2%、62.5%、36.7%、45.6%、61.9%、40.2%、39.8%、53.2%、47.0%、27.9%、35.2%、32.2%、32.3%和24.7%。从α⁃葡糖糖苷酶氨基酸序列的系统发育树图6中可以看出,甜菜(Beta vulgaris)与亲缘关系较近的茶(Camellia sinensis)、黄瓜(Cucumis sativus)、木本棉(Gossypium arboretum)、甘蔗属割手密(Spontane⁃um)、蒺藜状苜蓿(Medicago truncatula)的相似性都高于45.0%。
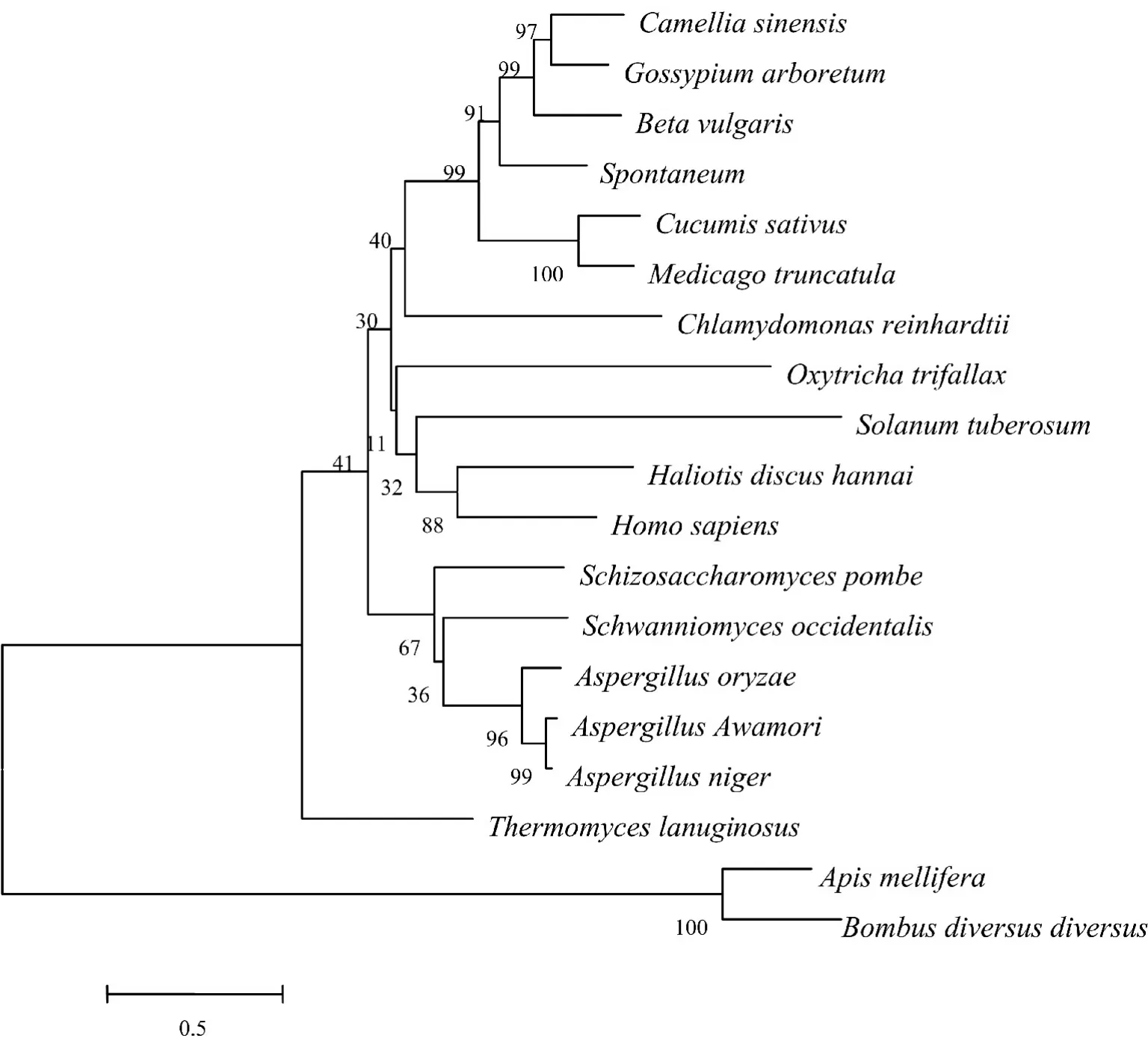
图6 α⁃葡萄糖苷酶氨基酸序列的系统发育树Fig.6 Phylogenetic tree ofα⁃glucosidase amino acid sequences
然而,通过多序列比对发现,在米格列醇与Beta vulgaris的α⁃葡萄糖苷酶相互作用位点处的11个氨基酸中,有81.82%的氨基酸在这五个物种中都是高度保守的(序列对比数据见图7)。只有18.18%的氨基酸是不同的,例如,与甜菜(Beta vulgaris)上的Trp329的色氨酸对应的只有茶(Camellia sinensis)和甘蔗属割手密(Spontaneum)是酪氨酸Tyr,其他三个物种中也都是色氨酸;与甜菜(Beta vulgaris)上的Ile358的疏水性的异亮氨酸对应的只有黄瓜(Cucu⁃mis sativus)和蒺藜状苜蓿(Medicago truncatula)是天冬氨酸Asp,氨基酸的极性也不相同。也就是说,这些不同来源的α⁃葡萄糖苷酶与米格列醇相互作用的大部分氨基酸都是保守的,且主要是极性的氨基酸,如色氨酸和天冬氨酸。即使是在非保守的氨基酸中,大部分的氨基酸也具有相同的极性。
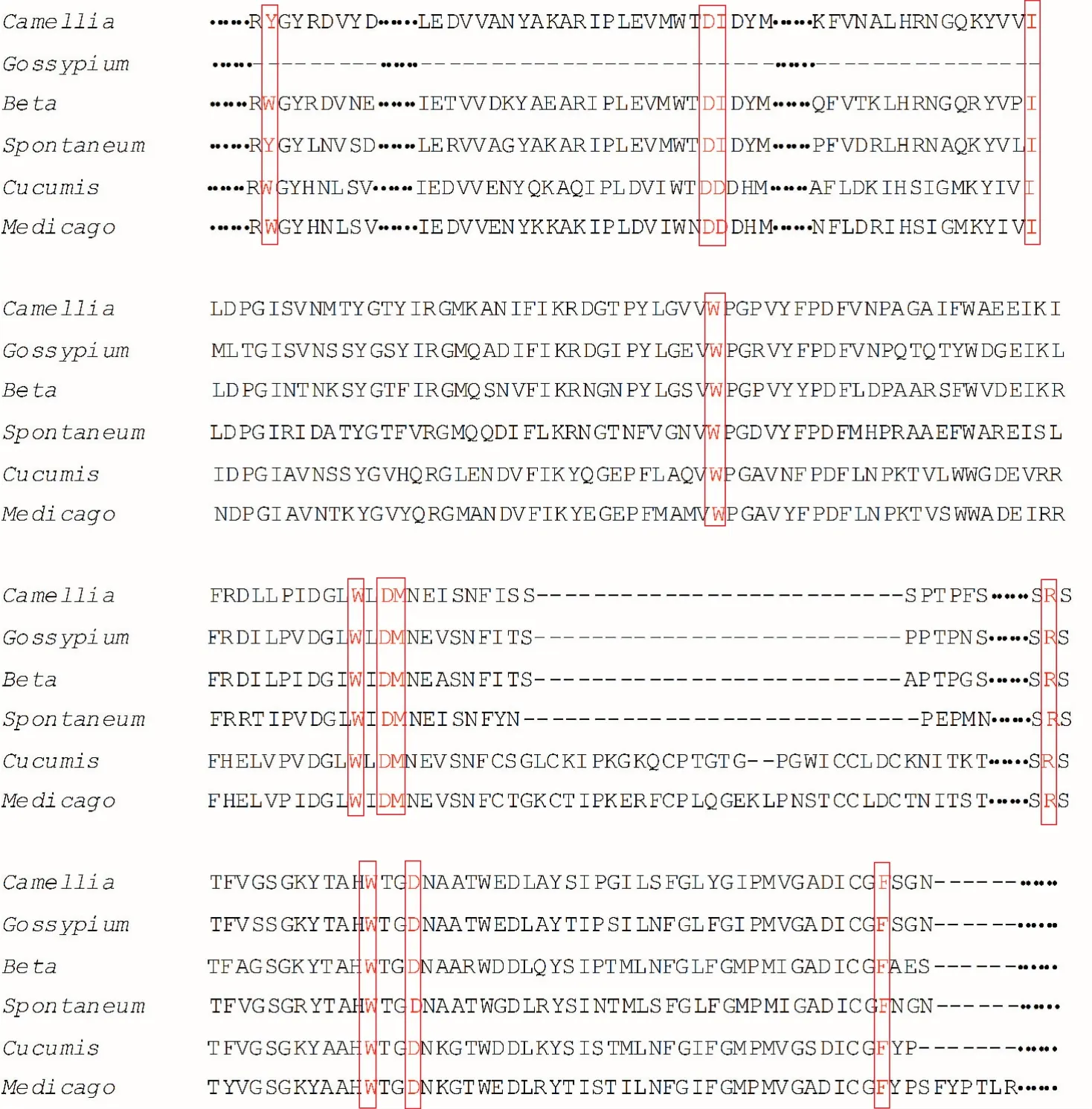
图7 α⁃葡萄糖苷酶氨基酸序列的多序列比对Fig.7 Mutiple⁃alignment ofα⁃glucosidase am ino acid sequences
3 结 论
研究表明体内的α⁃葡萄糖苷酶在调节血糖的过程中起着非常重要的作用,可以作为抗糖尿病药物的作用靶点[42]。目前通过抑制酶活性的方法进行疾病的治疗已经成为药物研究领域的一个热点。然而,由于各种限制因素,目前对于α⁃葡萄糖苷酶的抑制作用的研究仅仅限于少数几种物种,对其他物种来源的α⁃葡萄糖苷酶的结构和抑制作用的研究有助于深入研究药物的降血糖作用机制和进一步的药物设计、合成等。本实验基于生物信息学和分子对接方法分析目前市场上常用的降血糖药物米格列醇与甜菜(Beta vulgaris)的α⁃葡萄糖苷酶的相互作用及其位点,发现米格列醇基本上位于α⁃葡萄糖苷酶的一个隧道形状的狭窄空腔内,具有很好的几何互补性。米格列醇与酶分子结合位点处的氨基酸大多是酸性和中性极性的氨基酸,且是无规卷曲的结构。其间的相互作用主要以静电相互作用、氢键和范德华力为主,其中与酸性的天冬氨酸之间可以形成多个Ο⁃Η氢键,氢键的形成有利于提高复合物的稳定性,从而进一步证实了米格列醇较强的抑制作用。
疏水性分析表明,甜菜(Beta vulgaris)的α⁃葡萄糖苷酶是属于亲水性的氨基酸,可以与水溶性的、多羟基药物产生较强的作用[43-47]。最后,通过系统发育关系分析表明,米格列醇与甜菜(Beta vulgaris)的α⁃葡萄糖苷酶的相互作用的相关氨基酸在亲缘关系较近的物种间是非常保守的,特别是在能够与米格列醇形成氢键的氨基酸,这也可以说明米格列醇对其他物种的α⁃葡萄糖苷酶具有相似的抑制作用和位点。米格列醇的确是一种很好的α⁃葡萄糖苷酶的抑制剂,它通过位于一个凹向酶分子内部的狭窄的结合口袋中而与目标蛋白酶具有很好的契合。通过TMHMM预测甜菜(Beta vulgaris)的α⁃葡萄糖苷酶的序列,结果未发现跨膜区,此蛋白酶主要分布在膜外。通过多序列比对发现,在米格列醇与甜菜(Beta vulgaris)的α⁃葡萄糖苷酶相互作用位点处的氨基酸中,在与其亲缘关系较近的物种中大部分都是保守的,主要是极性的氨基酸,如色氨酸和天冬氨酸。
[1] UGALDE R A,STANELONIR J,LELOIR L F.Micro⁃somal glucosidases of rat liver.Partial purification and in⁃hibition by disaccharides[J].Eur JBiochem,1980,113 (1):97-103.
[2] SAUNIER B,KILKER RD JR,TKACZ JS,et al.Inhi⁃bition of N⁃linked complex oligosaccharide formation by 1⁃deoxynojirimycin,an inhibitor of processing glucosidases [J].JBiol Chem,1982,257(23):14155-14161.
[3] MARTINIUK F,ELLENBOGEN A,HIRSCHHORN R.I⁃dentity of neutral alpha⁃glucosidase AB and the glycopro⁃tein processing enzyme glucosidase II.Biochemical and genetic studies[J].JBiol Chem,1985,260(2):1238-1242.
[4] STROUSG J,VAN KERKHOF P,BROK R,et al.Glu⁃cosidase II,a protein of the endoplasmic reticulum with high mannose oligosaccharide chains and a rapid turnover [J].JBiol Chem,1987,262(8):3620-3625.
[5] KAUSHAL G P,PASTUSZAK I,HATANAKA K,et al. Purification to homogeneity and properties of glucosidase II from mung bean seedlings and suspension⁃cultured soy⁃bean cells[J].JBiol Chem,1990,265(27):16271-16279.
[6] ALONSO JM,SANTA⁃CECILIA A,CALVO P.Effect of bromoconduritol on glucosidase II from rat liver.A new kineticmodel for the binding and hydrolysis of the sub⁃strate[J].Eur JBiochem,1993,215(1):37-42.
[7] TREML K,MEIMAROGLOU D,HENTGES A,et al. The alpha⁃and beta⁃subunits are required for expression of catalytic activity in the hetero⁃dimeric glucosidase II com⁃plex from human liver[J].Glycobiology,2000,10(5):493-502.
[8] OHTA T,KITAMURA K,MAIZEL A L,et al.Altera⁃tions in CD45 glycosylation pattern accompanying differ⁃ent cell proliferation states[J].Biochem Biophys Res Commun,1994,200(3):1283-1289.
[9] BERTOZZIC R,KIESSLING L L.Chemical glycobiology [J].Science,2001,291(5512):2357-2364.
[10]BENKOVIC S J,HAMMES⁃SCHIFFER S.A perspective on enzyme catalysis[J].Science,2003,301(5637):1196-1202.
[11]SCOTT L J,SPENCER C M.Miglitol:a review of its therapeutic potential in type 2 diabetes mellitus[J]. Drugs,2000,59(3):521-549.
[12]陈代杰.微生物药物学[M].北京:化学工业出版社,2008,25-45. CHEN Daijie.Microbial Pharmacology[M].Beijing:Chemical Industry Press,2008,25-45.
[13]杜伟奇,施秀芳,邱明艳,等.治疗糖尿病药物的研究进展[J].中国医院药学杂志,2005,25(1):67-69. DUWeiqi,SHI Xiufang,QIU Mingyan,et al.Progress for the treatment of diabetes drug[J].Chin Hosp Pharm J,2005,25(1):67-69.
[14]何素婷,许激扬,陈代杰.具有α⁃葡糖苷酶抑制作用的抗糖尿病药物[J].工业微生物,2003,33(1):43-49. HE Suting,XU Jiyang,CHEN Daijie.Anti⁃diabetic withα⁃glucosidase inhibitory effect drugs[J].Strait Pharma⁃ceutical J,2003,33(1):43-49.
[15]顾觉奋,陈紫娟.α⁃葡糖苷酶抑制剂的研究及应用[J].药学进展,2009,33(2):62-67. GU Juefen,CHEN Zijuan.The stuties and applications ofα⁃glucosidase inhibitors[J].Progress in Pharmaceutical Sciences,2009,33(2):62-67.
[16]张耀东,高裙裙,郁彩虹.染料木素与β-葡萄糖苷酶相互作用的研究[J].药学学报,2011,46(6):677-682. ZHANG Yaodong,GAO Qunqun,YU Caihong.The in⁃teraction between genistein andβ⁃glucosidase[J].Acta pharmaceutica Scinica,2011,46(6):677-682.
[17]刘泉,刘率男,孙素娟,等.α⁃葡萄糖苷酶抑制剂维力波糖改善糖尿病大鼠糖脂代谢紊乱及肾脏病[J].药学学报,2014,8(8):1227-1232. LIU Quan,LIU Shuainan,SUN Sujuan,et al.Valibose,an alpha⁃glucosidase inhibitor,ameliorates the metabolic disorder of glucose and lipids and the nephropathy in streptozotocin⁃induced diabetic rats[J].Acta pharmaceu⁃tica Scinica,2014,8(8):1227-1232.
[18]郁彩虹,张耀东,高裙裙,等.分子对接和荧光光谱法研究槲皮素与β-葡萄糖苷酶的相互作用[J].光谱学与光谱分析,2011,31(8):2151-2155. YU Caihong,ZHANG Yaodong,GAO Qunqun,et al. Study on the interaction of quercetin withβ⁃glucosidase by fluorescence spectroscopy and molecular docking[J]. Spectroscopy and Spectral Analysis,2011,31(8):2151-2155.
[19]THOMPSON JD,GIBSON T J,HIGGINSD G.Multiple sequence alignment using ClustalW and ClustalX[J]. Curr Protoc Bioinformatics,2002,Chapter 2:Unit 2.3.
[20]BURLAND T G.DNASTAR's Lasergene sequence analy⁃sis software[J].Methods Mol Biol,2000,132:71-91.
[21]CLEWLEY JP,ARNOLD C.MEGALIGN.The multiple alignmentmodule of LASERGENE[J].Methods Mol Bi⁃ol,1997,70:119-129.
[22]ARTIMO P,JONNALAGEDDA M,ARNOLD K,et al. ExPASy:SIB bioinformatics resource portal[J].Nucleic Acids Res,2012,W597-603.
[23]KROGH A,LARSSON B,VON HEIJNE G,et al.Pre⁃dicting transmembrane protein topology with a hidden Markov model:application to complete genomes[J].J Mol Biol,2001,305(3):567-580.
[24]HOFMANN K,STOFFEL W.TMbase⁃A database of membrane spanning proteins segments[J].Biol.Chem. Hoppe⁃Seyler,1993,374:166.
[25]KUMAR S,DUDLEY J,NEIM,et al.MEGA:A biolo⁃gist⁃centric software for evolutionary analysis of DNA and protein sequences[J].Briefings in Bioinformatics,2008,9:299-306.
[26]BUNTROCK R E.ChemOffice Ultra 7.0[J].JChem Inf Comput Sci,2002,42(6):1505-1506.
[27]LEE C,YANGW,PARR R G.Development of the Col⁃le⁃Salvetti correlation⁃energy formula into a functional of the electron density[J].Phys Rev B Condens Matter,1988,37(2):785-789.
[28]王家驰.倍欣在糖尿病治疗中的应用及评价[J].中国实用内科志,1999,19(8):503-504. WANG Jiachi.The application and evaluation of Basen in the treatment of diabetes[J].Chin J Prac Interal Medcine,1999,19(8):503-504.
[29]徐雯,曹艳华,乔德水,等.α⁃葡萄糖苷酶三维结构的同源模建及其对接研究[J].药物生物技术,2009,16 (3):255-259. XUWen,CAO Yanhua,QIAO Deshui,et al.Homology modeling ofα⁃glycosidase and its molecular docking with inhibitors[J].Pharmaceutical Biotechnology,2009,16 (3):255-259.
[30]KISHIMOTO M,NODA M.Additive effects ofmiglitol and anagliptin on insulin⁃treated type 2 diabetesmellitus:a case study[J].Clin Drug Investig,2015,35(2):141-147.
[31]KISHIMOTO M,NODA M.Effect of the addition of sita⁃gliptin andmiglitolon insulin⁃treated type 2 diabetes[J]. Diabetes Ther,2012,3(1):11.
[32]SHIMABUKURO M,HIGA M,YAMAKAWA K,et al. Miglitol,α⁃glycosidase inhibitor,reduces visceral fat ac⁃cumulation and cardiovascular risk factors in subjectswith themetabolic syndrome:a randomized comparable study [J].Int JCardiol,2013,167(5):2108-2113.
[33]HSIEH SH,SHIH K C,CHOU CW,et al.Evaluation of the efficacy and tolerability of miglitol in Chinese pa⁃tientswith type 2 diabetesmellitus inadequately controlled by diet and sulfonylureas[J].Acta Diabetol,2011,48 (1):71-77.
[34]KURIYAMA C,KAMIYAMA O,IKEDA K,et al.In vitro inhibition of glycogen⁃degrading enzymes and glyco⁃sidases by six⁃membered sugar mimics and their evalua⁃tion in cell cultures[J].Bioorg Med Chem,2008,16 (15):7330-7336.
[35]郭凤霞,曾阳,路朋,等.人工合成的三种α⁃葡糖糖苷酶抑制剂用于糖尿病治疗的药效学研究 [J].青海医药杂志,2009,39(10):75-78. GUO Fengxia,ZENG Yang,LU Peng,etal.Pharmacody⁃namic Study of synthetic threeα⁃glucosidase inhibitors for the treatment of diabetes[J].Qinghai Medical Journal,2009,39(10):75-78.
[36]AOKIC,SUZUKIK,YANAGIK,etal.Miglitol,an an⁃ti⁃diabetic drug,inhibits oxidative stress⁃induced apopto⁃sis and mitochondrial ROS over⁃production in endothelial cells by enhancement of AMP⁃activated protein kinase [J].JPharmacol Sci,2012,120(2):121-128.
[37]REN L,CAO X,GENG P,et al.Study of the inhibition of two human maltase⁃glucoamylases catalytic domains by differentα⁃glucosidase inhibitors[J].Carbohydr Res,2011,346(17):2688-2692.
[38]OE H,NAKAMURA K,KIHARA H,etal.Comparison of effects of sitagliptin and voglibose on left ventricular dias⁃tolic dysfunction in patientswith type 2 diabetes:results of the 3D trial[J].Cardiovasc Diabetol,2015,14:83.
[39]CHEN T,CHAN H S.Native contact density and non⁃native hydrophobic effects in the folding of bacterial im⁃munity proteins[J].PLoSComput Biol,2015,11(5):e1004260.
[40]CLARKE V C,LOUGHLIN PC,GAVRIN A,etal.Pro⁃teomic analysis of the soybean symbiosome identifies new symbiotic proteins[J].Mol Cell Proteomics,2015,14 (5):1301-1322.
[41]SAEED S,JOWITT T A,WARWICKER J,et al.Break⁃ing and restoring the hydrophobic core of a centromere⁃binding protein[J].J Biol Chem,2015,290(14):9273-9283.
[42]ZHU Z Y,ZHANG J Y,CHEN L J,et al.Comparative evaluation of polysaccharides isolated from Astragalus,oyster mushroom,and yacon as inhibitors ofα⁃glucosi⁃dase[J].Chin JNat Med,2014,12(4):290-293.
[43]DU ZY,LIU RR,SHAOW Y,etal.Alpha⁃glucosidase inhibition of natural curcuminoids and curcumin analogs [J].Eur JMed Chem,2006,41(2):213-218.
[44]DANG P H,NGUYEN H X,NGUYEN N T,et al.α⁃Glucosidase inhibitors from the stems of Embelia ribes [J].Phytother Res,2014,28(11):1632-1636.
[45]EL⁃MEKKAWY S,MESELHY M R,NKOBOLEN,etal. Three new α⁃glucosidase inhibitors from guggul,the oleogum resin of Commiphora wightii[J].Nat Prod Res,2013,27(2):146-154.
[46]JHONG CH,RIYAPHAN J,LIN SH,et al.Screening alpha⁃glucosidase and alpha⁃amylase inhibitors from natu⁃ral compounds bymolecular docking in silico[J].Biofac⁃tors,2015,doi:10.1002/biof.1219.
[47]HATI S,MADURKAR SM,BATHULA C,et al.De⁃sign,synthesis and biological evaluation of small mole⁃cules as potent glucosidase inhibitors[J].Eur J Med Chem,2015,100:188-196.
Interaction and evolutional analysis ofα⁃glucosidases and Miglitol
QIYanjiao1∗,LU Huining2,JIN Nengzhi3,ZHAO Yamin1
(1.Department ofChemical Engineering,Northwest University for Nationalities,Lanzhou 730124,China;
2.Department of Life Science and Biological Engineering,Northwest University for Nationalities,Lanzhou 730124,China;
3.Gansu Province Computing Center,Lanzhou 730000,China)
The phylogenetic relationship of α⁃glucosidase between different species was analyzed by using the method of bioinformatics.By analyzing the interaction site between the hypoglycemic drug Miglitol andα⁃glucosidase of Beta vulgaris,and the characteristics of corresponding amino acid in other close genetic species,we found that Miglitolwas located in a narrow binding pocket which recesses inside to the enzyme molecule.The interactions between them aremainly electrostatic interactions,hydrogen bonds and van derWaals forces.There are multiple O⁃H hydrogen bonds between drug and the enzyme molecules,which makes Miglitol a better inhibition because of the characteristics of strongwater⁃solubility and polyhydroxy of the Miglitol.Through TMHMM prediction of the Beta vulgarisα⁃glucosidase sequence,it was found that there is no transmembrane region.The multiple sequence alignment suggested that 81.82%of the amino acids located in the interactive sites between Miglitol and Beta vulgarisα⁃glucosidasewere conservative among the closest genetic species Camellia sinensis,Cucumis sativus,Gossypium arboretum,Spontaneum and Medicago truncatula.Among the conserved amino acids,the polar ones,such as Asp and Trp,were the most.This bioinformatics⁃based analysis can provide important scientific basis for further behavioral research of the hypoglycemic drugs in other species.
α⁃glucosidase;Interaction;Sequence alignment;Phylogenetic relationships
TP925+.4
A
1672-5565(2015)03-141-09
2015-06-10;
2015-07-11.
国家民委科研项目(14XBZ021);中央高校基本科研业务费专项资金项目(NO.31920130035);中央高校基本科研业务费专项资金项目(zyz2011064)。
∗
齐燕姣,女,副教授,研究方向:生物信息学;E⁃mail:qiajiao@163.com.
