同源重组整合 vgb基因提升枯草芽孢杆菌亚麻脱胶能力
2015-01-09张懿若垚陈婷崇文张兴东华大学生态纺织教育部重点实验室上海20620东华大学纺织面料技术教育部重点实验室上海20620东华大学纺织学院上海20620
张懿 翔,丁 若垚,2,3,陈婷,郁 崇文,2,3,张兴 群*(.东华大学生态纺织教育部重点实验室,上海20620;2.东华大学纺织面料技术教育部重点实验室,上海 20620;3.东华大学纺织学院,上海 20620)
同源重组整合 vgb基因提升枯草芽孢杆菌亚麻脱胶能力
张懿 翔1,丁 若垚1,2,3,陈婷1,郁 崇文1,2,3,张兴 群1*
(1.东华大学生态纺织教育部重点实验室,上海201620;
2.东华大学纺织面料技术教育部重点实验室,上海 201620;
3.东华大学纺织学院,上海 201620)
【目的】将透明颤菌血红蛋白 (VHb)基因 (vgb)在枯草芽孢杆菌中进行整合表达,以改善枯草芽孢杆菌的呼吸强度,通过高密度培养提高果胶酶的表达量,最终明显改善脱胶效果。【方法】构建含有 vgb基因、amyE基因以及启动子 P43的 pSK-vgb(+)质粒,通过同源重组的方法,将 vgb基因整合到枯草芽孢杆菌 A5的染色体上,得到稳定表达透明颤菌血红蛋白的枯草芽孢杆菌 A5-vgb(+)。分别采用 PCR和 CO差光谱分析法检测 vgb基因的整合状态与血红蛋白的稳定表达,并通过发酵摇瓶试验研究 VHb对菌株果胶酶产量的影响。将构建好的 A5-vgb(+)菌株进行脱胶试验,通过 XRD结晶度与电镜扫描分析鉴定脱胶效果。【结果】PCR与 CO差光谱检测表明,vgb基因成功整合在 A5菌株中,且正确表达的 VHb具有生物学活性,在150 rpm,37℃,pH=8.0,16小时发酵的条件下,vgb基因的表达促使A5-vgb(+)菌株的果胶酶产量较不含 vgb基因的菌株提升了29.5%。XRD与电镜扫描结果表明,构建的 A5-vgb(+)菌株的脱胶效果相较于不含 vgb的菌株,在结晶度上提高了 0.55%,表面更光滑。【结论】将 vgb基因整合至枯草芽孢杆菌 A5菌株中,可提高 A5菌株的脱胶效果。
生物脱胶;果胶酶;枯草芽孢杆菌;vgb基因;同源重组
在众多的纺织纤维中,麻类纤维是极具发展潜力的绿色环保纤维。然而,作为麻类纤维原料的原麻中含有大量的胶质,如果胶、半纤维素、木质素和蜡脂质等,不能直接用于纺纱工艺,必须经脱胶处理才能进行后续加工。麻脱胶是一个复杂的提取麻纤维的过程[1]。从环境保护角度考虑,生物脱胶被认为是能够取代耗能大、效率低、污染严重的传统脱胶工艺的极有发展前途的一种方法[2]。用基因工程菌产生的碱性果胶酶处理代替碱对麻织物进行煮练加工和整理工艺,以去除初生胞壁中的果胶物质,在比较缓和的 pH值和温度条件下使织物手感柔软,强度高,而且还能避免因微生物处理造成的纤维素的降解[3-5]。
近年来,人们对透明颤菌VHb基因 (vgb)已进行了大量研究,发现该基因的表达能够改善宿主细胞的呼吸强度、降低细胞临界氧浓度、促进细胞高密度培养,可促进宿主细胞的生长,提高目的代谢产物的产量以及蛋白的合成,延长细胞的寿命[6-10]。
从中国湖南腐烂苎麻上筛选得到的 Bacillus subtilis A5是一种能产生具有脱胶活性的碱性果胶酶的微生物。作为革兰氏阳性菌,且具有外分泌性强、细胞壁不含内毒素和发酵性能良好等特点。为了提高其产果胶酶能力,本研究通过同源重组方法将vgb基因整合到Bacillus subtilis A5染色体上,得到能够正确表达血红蛋白的菌株 Bacillus subtilis A5-vgb(+),并研究其亚麻脱胶效果,为利用基因工程菌产生的碱性果胶酶亚麻脱胶工艺提供理论和科学依据。
1 材料与方法
1.1 材料
1.1.1 酶和试剂
限制性内切酶、DNA聚合酶、DNA连接酶、磷酸化修饰酶均购自Takara公司。
1.1.2 质粒与菌株
大肠杆菌 (DH5α)、带有 vgb基因的质粒 pMD 18-vgb、枯草芽孢杆菌A5,均由本实验室保存和构建,带有氯霉素筛选基因的质粒 pHSG-398购自 Takara公司。
1.1.3 引物设计与合成
根据 GenBank中枯草芽孢杆菌 amyE基因、启动子p43以及 vgb基因的序列,参考文献[9],利用引物设计软件 Primer Premier 5.0分别设计引物 amyE-up1、amyE-up2、amyE-down1、amyE-down2、p1、p2、vgb1、vgb2。根据pHSG-398质粒图谱分别设计引物 cm1、cm2: amyE-up1:5’-ATTGCTCGAGATGTTTGCAAAACGATTCAAA-3’amyE-up2:5’-GGATAAGCTTTGTGTGTTTCCATGTGTCCAGT-3’
amyE-down1:5’-ATTGTCTAGAGCTGTGCTTTATCCTGATGATA-3’
amyE-down2:5’-ATTACCGCGGTCAATGGGGAAGAGAACCGCT-3’
p1:5’-ATTAGAATTCTGTCGACGTGCATGCAGGC-3’
p2:5’-GTAGGATCCGCTTCTGTTATTAATTCTTG-3’
vgb1:5’-CGCGGATCCGGAAGACCCTCATGTTAGA-3’
vgb2:5’-ATTATCTAGATTATTCAACCGCTTGAGCGTA-3’
cm1:5’-AATGAAGCTTTGAGACGTTGATCGGCAC-3’
cm2:5’-ACTGGAATTCAGGGCACCAATAACTGCC-3’
在上述引物5’端分别加入酶切位点:amyE-up1(XhoI),amyE-up2(HindIII),amyE-down1(XbaI),amyE-down2(SacI),p1(EcoRI),P2(BamHI),vgb 1(BamHI),vgb 2 (XbaI),cm1(HindIII),cm2(EcoRI)(下划线碱基即为酶切位点)。引物由生工生物 (上海)有限公司合成。
1.2 方法
1.2.1 细菌培养
细菌采用液体 LB培养基 (蛋白胨10g/L、酵母提取物5 g/L和氯化钠 5 g/L)于37℃培养。发酵摇瓶试验使用30mL LBG培养基 (液体 LB培养基 +葡萄糖10 g/L)的250mL三角瓶,在37℃,180 rpm条件下培养。
1.2.2 大肠杆菌和枯草芽孢杆菌感受态的制备与转化
大肠杆菌和枯草芽孢杆菌感受态的制备与转化参考文献[11]进行。
1.2.3 含有 vgb基因的 pSK质粒 (pSK-vgb(+))的构建
分别以amyE-up1、amyE-up2,amyE-down1、amyE-down2为引物从 A5菌株中 PCR扩增出 amyE上下游片段作为同源重组臂。片段经过纯化后,分别使用限制性内切酶 XhoI、HindIII(上游片段amyE-up),XbaI、SacI(下游片段amyE-down)进行双酶切,插入pSK质粒中形成pSK-amyE。以cm1、cm2为引物从pHSG-398中扩增出氯霉素抗性基因 (cm),PCR产物经纯化、双酶切之后插入 pSK-amyE的HindIII、EcoRI两个位点之间形成pSK-vgb(-)。
P43与vgb的片段以 p1、p2和 vgb1、vgb2为引物,分别从A5菌株以及 pMD-vgb质粒中得到。P43两边的位点为EcoRI、BamHI,vgb两边的位点为BamHI、XbaI,将 vgb置于p43启动子下游位置。纯化双酶切后插入pSK-vgb(-),得到pSK-vgb(+)。

图1 pSK-vgb(+)的质粒图Fig.1 Plasmid pSK-vgb(+)
1.2.4 整合有 vgb基因的 A5菌株 (A5-vgb(+)菌株)的构建
如图2所示,将所得到的pSK-vgb(-)与pSK-vgb(+)质粒进行 XhoI的单酶切,并使用碱性磷酸酶去磷酸化,纯化后的片段通过电转法转化 (2.0kv,4.5ms-5ms)。37℃,200 rpm振荡培养,复苏3小时后,培养在含有 10ug/mL的氯霉素 LB固体培养基上涂布,过夜培养,在此平板上生长的菌落即为稳定整合血红蛋白基因的 A5-vgb(+)枯草芽孢杆菌菌株,不含血红蛋白基因的菌株则为A5-vgb(-)枯草芽孢杆菌菌株。

图2 A5-vgb(+)的整合Fig.2 Integration of vgb gene
1.2.5 血红蛋白的测定
一氧化碳差光谱法测定血红蛋白的方法参见文献[12-13]。将离心后的细胞重悬于磷酸盐缓冲液 (100mmol/L,pH=7.5)中,采用加入过量的 Na2S2O4进行还原处理和将菌泥置于 -20℃的冰箱中进行冻融处理两种方法进行破菌处理,进行一氧化碳差光谱分析。
1.2.6 果胶酶活性测定
本实验采用 DNS法测定酶活[14]。接种等量枯草芽孢杆菌A5-vgb(+)与 A5-vbg(-)的过夜培养物于摇瓶中。在37℃,pH=8.0,接种量1:200,转速150 rpm的条件下在亚麻发酵培养基 (K2HPO41g,MgSO40.5g,亚麻粉 5g,(NH4)2SO45g,KCl 0.5g,FeSO40.01g,水1000mL)中进行培养。分别在发酵培养2、4、8、12、16、20、24和30 h取样,测定果胶酶的活性。
1.2.7 亚麻脱胶实验
分别将菌株A5-vgb(-)与A5-vgb(+)在LB液体培养基中活化,37℃,pH8.0,150 rpm震荡培养12小时后,按照1:200的比例接种至亚麻发酵培养基中。在37℃,150rpm,再培养16小时。
使用细菌发酵液来对亚麻粗纱脱胶。脱胶条件为37℃,浴比 1:10,转速 200rpm脱胶 9小时,然后用沸水 (97-99℃)对残菌进行灭活,防止生物污染,灭活时间为20min。
1.2.8 扫描电镜 (SEM)分析
扫描电子显微镜用于分析粉状样品的形态、表面特征。实验中采用日本 JEOL公司生产的JSM-5600LV型扫描电子显微镜进行观察。在进行形态和表面观察前样品粉末先分散于乙醇中,用超声波振荡器振荡后滴于载波片上,然后于真空下镀金。分析过程中仪器加速电压设为20kV。
1.2.9 X-射线衍射 (XRD)分析
实验中使用日本RIGAKU,D/Max-2550PC型 X-射线衍射仪 (XRD)对样品进行微观结构分析。管电压为40 kV,管电流为200 mA,2θ角测量范围:0.5~145°;2θ角测量准确性:≤0.01°。
2 结果与讨论
2.1 pSK-vgb(+)质粒及 A5-vgb(+)菌株的构建
通过基因克隆的方法我们将 vgb基因构建到 pSK质粒中,为了鉴定我们得到菌落为阳性克隆,我们采用了两种方法进行鉴定。抽取筛选平板上得到的阳性菌株中的质粒,分别进行PCR鉴定与酶切鉴定。其中以vgb 1,vgb 2为引物进行 PCR,质粒 PCR显示能得到 400bp左右的片段;以BamHI、XbaI进行双酶切,也得到400bp左右的片段 (图3),这一片段大小与 vgb基因大小一致。后经测序证实 vgb基因已成功克隆到 pSK载体上。
将获得的pSK-vgb(+)质粒酶切后,转入枯草杆菌 A5菌株中,通过同源重组方式将 vgb基因整合在枯草杆菌 A5菌株的染色体,已达到稳定表达血红蛋白的目的。为了鉴定 vgb基因是否整合在 A5菌株的染色体上,我们以筛选平板上得到的菌株为模板,以 vgb 1,vgb 2为引物进行菌落PCR,得到与vgb基因 (400bp左右)大小一致的片段 (图4),从而证明vgb基因成功随同源重组臂整合到A5的染色体中。

图3 pSK-vgb(+)质粒的酶切鉴定M:DL2000 DNA Marker;1:pSK-vgb(+)BamHI/XbaI双酶切产物;2:以 v1/v2为引物,pSK-vgb(+)为模板的 PCR产物Fig.3 Enzyme of plasmid pSK-vgb(+)M:DL2000 DNA Marker;1:pSK-vgb(+)digested with BamHI/XbaI;2:product of primers v1/v2 using pSK-vgb(+)as template

图4 A5-vgb(+)的 PCR分析验证M:1kb DNA Marker;1、2:以A5-vgb(+)为模板,v1/v2为引物pcr产物;3:vgb阳性对照4:vgb阴性对照Fig.4 PCR analysis of Bacillus subtilis A5-vgb(+)M:1kb DNA Marker;1、2:Product of primers v1/v2 using A5-vgb(+)as template;3:vgb positive control;4:vgb negative control
2.2 CO差光谱分析
CO与 VHb结合后在波长约420nm处会产生明显的吸收峰,从而形成典型的 VHb蛋白特征曲线,故用此法来检测所表达的VHb是否具有活性。CO差光谱试验结果如图 5所示,A5-vgb(+)表达的 VHb蛋白在420nm处有明显吸收峰,与之前的报道相符[15]。而对照组 A5-vgb(-)中并没有出现特征峰。这说明vgb基因成功整合到A5菌株中,并且表达出的 VHb蛋白具有生物学活性。
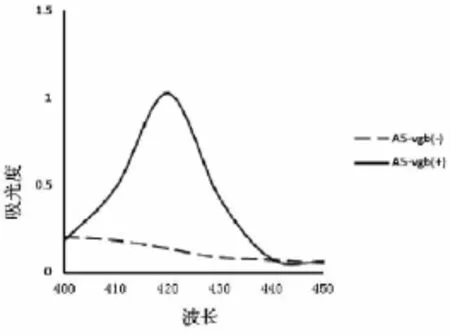
图5 VHb的 CO差光谱分析Fig.5 CO-difference spectra of VHb
2.3 果胶酶活性对比
由图6可知,在转速为150 rpm条件下,枯草芽孢杆菌 A5-vbg(+)较A5-vbg(-)的果胶酶活性有所提高。不含有 vgb基因的菌株 A5-vbg(-)在0-8h的时间段内酶活增加比较平稳,然后进入对数期,而枯草芽孢杆菌A5-vbg(+)在6h之后更早的进入对数生长期。在16h处菌株 A5-vbg(-)进入平稳生长期,而含有 vgb基因的菌株能继续快速生长,果胶酶活性对比提升了29.5%。

图6 菌株 A5-vgb(+)与菌株 A5-vgb(-)的果胶酶酶活性曲线Fig.6 Activity curves of Pectinase of Bacillus subtilis A5-vgb(+)and A5-vgb(-)
2.4 经整合血氧蛋白基因的枯草杆菌 A5菌株脱胶能力检测
我们通过两种方式对整合血氧蛋白基因的枯草杆菌 A5菌株脱胶能力进行了鉴定。
2.4.1 扫描电镜 (SEM)检测脱胶效果
亚麻纤维周围被胶质所包覆而无法呈现单纤维状态 (图 7A)。因此,需要进行脱胶处理。亚麻原麻经过过生物脱胶处理后,包覆在纤维周围的胶质被完全去除,纤维表面变得光洁,纤维的横节和竖纹都能够清晰的观察到。与未整合 vgb的枯草杆菌 A5相比,经A5-vgb(+)菌株脱胶后的亚麻样品轮廓更加清晰,表面也比较光滑,证明插入 vgb基因之后的菌株脱胶效果有所提高。图中裂缝与小坑可能是由于在脱胶过程中部分表面效果过强,纤维素在脱胶过程中受到了损伤,进而导致精干麻物理机械性能的下降。

图7 扫描电镜 (SEM)检测脱胶效果图A:原麻样品电镜照片 (×3000),B:使用 A5-vgb(-)脱胶样品电镜照片 (×3000),C:使用 A5-vgb(+)脱胶样品电镜照片 (×3000)Fig.7 Fibers scanned on electronmicroscopy(SEM)A:Non-degummed samples(×3000),B:A5-vgb(-)Degummed samples(×3000),C:A5-vgb(+)Degummed samples(×3000)
2.4.2 X-衍射测试 (XRD)
X-衍射测试是麻类脱胶效果的常用检测手段,在脱胶过程中原麻胶质的增加或减少会引起结晶度的变化,而这一变化通过X-衍射来观察 (图8)。我们比较了亚麻原麻和野生型 A5菌株,整合了血氧蛋白的 A5-vgb(+)菌株的亚麻脱胶样品的晶体结构变化。X-衍射研究显示不同样品的结晶度依次上升。原麻样品为 60.81%、A5-vgb(-)脱胶样品为 66.38%、A5-vgb(+)脱胶样品为66.93%。这是因为通过生物脱胶工艺去除了原麻中的果胶、半纤维素和水溶物等胶质,使得原麻中的无定形区减小,结晶度提高。这表明利用插入 vgb的 A5菌株的脱胶比对照组,在效果上有一定提高。而且,2θ角最高峰依次为,原麻样品 d=23.020、A5-vgb(-)脱胶样品d=22.900、A5-vgb(+)脱胶样品 d=22.820,发生了左移,这说明随着脱胶的进行,原麻的晶体结构也发生了细微改变。
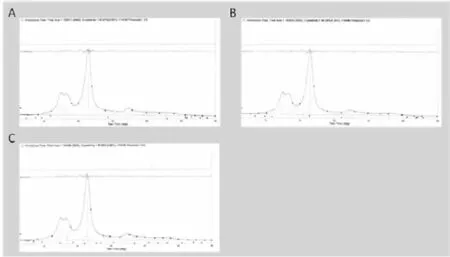
图8 不同处理后,亚麻脱胶样品的 X-衍射测试 (XRD)图A:原麻,B:A5-vgb(-)脱胶样品,C:A5-vgb(+)脱胶样品Fig.8 X-ray diffraction(XRD)of degummed flax of different treatmentsA:Non-degummed samples,B:A5-vgb(-)degummed samples,C:A5-vgb(+)degummed samples
3 结论与讨论
利用工程菌进行亚麻脱胶的方法,近年来在国内外都有一定的运用。酶法亚麻脱胶与传统的温水浸渍脱胶相比,酶法亚麻脱胶可控性强,脱胶条件温和,对纤维损伤小,可以从根本上解决传统工艺存在的环境和能源等问题,在质量与环保方面具有传统工艺无法比拟的优点。
本研究采用碱性果胶酶,利用整合vgb基因的方法,使Bacillus subtilis A5菌株具有表达VHb蛋白的能力,获得工程菌A5-vgb(+),一定程度上解决菌株生长发酵过程中的溶氧、供氧不足的限制问题,能够在高密度、低氧的条件下使工程菌的果胶酶产量提升,在对照菌进入平稳期的时候仍能继续一段时间的对数生长,相较于对照菌酶活提高了29.5%。通过扫描电镜测试(SEM)、X-衍射测试(XRD)分析观察发现,相较于不含有vgb基因的菌株,工程菌A5-vgb(+)的脱胶样品能更多去除纤维周围的胶质,使其表面更加光滑,在结晶度上提升了0.55%。从而证实此方法能够一定程度上提升 Bacillus subtilis A5菌株的脱胶能力。对于工程菌的最佳发酵条件仍需优化才能进一步发挥其优势,为亚麻脱胶的深入研究开阔了思路。
[1]董政娥,管映亭.一种野生麻纤维脱胶初探 [J].印染助剂,2003,20(3):23-25.
[2]张宁,童步章.酶在纺织工业中应用有利于环保 [J].国外纺织技术,2003,(5):40-42.
[3]薛长湖,张永勤.果胶及果胶酶研究进展 [J].食品与生物技术学报,2005,24(6):94-99.
[4]Cao J,Zheng L,Chen S.Screening of pectinase producer from alkalophilic bacteria and study on its potential application in degumming of ramie[J].Enz.Microbiol.Technol,1992,14:1013-1016.
[5]樊增禄.权衡果胶酶BioprepTM处理对棉织物性能的影响 [J].印染助剂,2002,19(5):11-13.
[6]Ruijuan Ma,Xiangzhi Lin,et al.Vitreoscilla hemoglobin gene(vgb)improves lutein production in Chlorella vulg aris[J]. Chinese Journal of Oceanology and Limnology,2014(2):390-396.
[7]Shaohua Wang,Fei Liu,et al.Enhancement of natamycin production on Streptomyces gilvosporeus by chromosomal integration of the Vitreoscilla hemoglobin gene(vgb)[J].World Journal of Microbiology and Biotechnology,2014,(4):1369-1376.
[8]Liu Q,et al.Microbial production of l-glutamate and l-glutamine by recombinant Corynebacterium glutamicum harboring Vit-reoscilla hemoglobin gene vgb[J].Applied Microbiology and Biotechnology,2008,(6):1297-1304.
[9]Yishan Su,Xia Li,et al.Improved poly-γ-glutamic acid production by chromosomal integration of the Vitreoscilla hemoglobin gene(vgb)in Bacillus subtilis[J].Bioresource Technology,2010,(12):4733-4736.
[10]Zhang W,et al.Chromosome integration of the V itreoscilla hemoglobin gene(vgb)mediated by temperature-sensitive plasmid enhances γ-PGA production in B acillus amyloliquefaciens[J].FEMS Microbiol Lett,2013,(2):127-134.
[11]RGREEN M,SAMBROOK J.Molecular Cloning:A Laboratory Manual[M].
[12]王大威,胡鸢雷.颤菌血红蛋白基因在提高枯草芽孢杆菌产脂肽功能中的研究 [J].生物技术通报,2007,(5):116-127.
[13]李兵,周艳芬.CO差光谱法分析重组大肠埃希菌及产黄青霉中 VHb的活性表达 [J].中国抗生素杂志,2005,30 (5):267-303.
[14]Fan,J,Q,Yamamoto,K,Matsumoto,Y,et,al.Action of endo-a-N-acetylgalacto saminidasc from Alcaligcncs sp.on amino acid-O-glycans:Comparison with the enzyme from Diplococcuspneumoniae[J].Biochemical and biophysical research communications,1990,169(2):751-757.
[15]Liu C Y,Webst D A.Spectral Characteristics and Interconversions of the Reduced,Oxidized,and Oxygenated Forms of Purified Cytochrome o[J].J.Biol.Chem,1974,(249):4261-4266.
Improvement of Flax Degumming by Chromosomal Integration of Vitreoscilla Hemoglobin Gene(vgb)in Bacillus subtilis
ZHANG Yi-xiang1,DING Ruo-yao1,2,3,CHEN Ting1,YU Chong-wen1,2,3,ZHANG Xing-qun1*
(1.Key Laboratory of Science&Technology of Eco-Textile,Ministry of Education,Shanghai 201620,China;
2.Key Laboratory of Textile Science&Technology,Ministry of Education,Shanghai 201620,China;
3.College of Textiles,Donghua University,Shanghai 201620,China)
The gene Vitroscilla Hemoglobin was integrated and expressed in Bacillus subtilis to enhance the effect of degumming by improving pectinase production.Promoter p43 and gene amyE,pSK-vgb(+)were integrated into expression vector.Through the method of homologous recombination,gene vgb was integrated into Bacillus subtilis A5,and then got a vgb integrated expression strain named Bacillus subtilis A5-vgb(+).The result was identified by PCR analysis and CO-spectral analysis. A5-vgb(+)strain was applied in flax degumming,shake flask experiment was used to study the function of protein VHb in production of Pectinase.X-ray diffraction(XRD)and canning electron microscope(SEM)were uesd to analysis the effect of degumming.PCR analysis and CO-spectral analysis showed that the gene vgb was succeed in being integrated into Bacillus subtilis A5 and protein VHb had bioactivity.The results of shake flask experiment showed that the expression of gene vgb could improve Pectinase production,and the activity of Pectinase was 29.5%higher than that of the control under 150 rpm,37℃,pH=8.0,16 hours.The data of XRD and SEM showed that being compared with the strain without gene vgb,the degumming effect of A5-vgb(+)strain improved 0.55%in crystallinity,and had a smoother surface.To some extent,the VHb could enhance the degumming effect of Bacillus subtilis A5.
bio-degumming;Pectinase;Bacillus subtilis;gene vgb;homologous recombination;
Q789
A
1671-3532(2015)02-0087-08
2014-09-26
中国博士后科学基金面上资助 (2014M561386);国家麻类产业技术体系建设专项资金资助项目 (CARS-19);中央高校基本科研业务专项资金 (14D110524);大学生 “小平科技创新团队”(麻类纤维生物脱胶技术产业化集成研发团队)
张懿翔 (1987-),男,硕士研究生,研究方向:纺织生物技术。E-mail:512413278@qq.com。
*通讯作者:张兴群 (1963-),男,副教授,研究方向:纺织生物技术。E-mail:xqz@dhu.edu.cn。
