苎麻 Genomic-SSR与 EST-SSR分子标记遗传差异性分析
2015-01-09刘晨晨栾明宝陈建华王晓飞许英孙志民中国农业科学院麻类研究所长沙410205
刘晨晨,栾明宝,陈建华,王晓飞,许英,孙志民(中国农业科学院麻类研究所,长沙 410205)
苎麻 Genomic-SSR与 EST-SSR分子标记遗传差异性分析
刘晨晨,栾明宝*,陈建华*,王晓飞,许英,孙志民
(中国农业科学院麻类研究所,长沙 410205)
为了明确苎麻不同 SSR的遗传差异性,利用 Genomic-SSR与 EST-SSR两种 SSR标记对19个苎麻核心种质的遗传多样性进行分析。根据统计结果,Genomic-SSR平均检测到的观测等位基因数为3.4643、有效等位基因数为 2.1982、Shannon多样性指数为 0.8864、观测杂合度为0.5254、期望杂合度为0.5172;EST-SSR平均检测到的观测等位基因数为2.3333、有效等位基因数为1.9438、Shannon多样性指数为 0.7120、观测杂合度为 0.5128、期望杂合度为0.4778。Genomic-SSR和 EST-SSR两种引物的有效等位基因数 (Ne)和观测杂合度 (Ho)差异不显著,Genomic-SSR的 Shannon指数显著高于 EST-SSR。研究结果表明,在标记多态性及基因型鉴别等方面,Genomic-SSR与 EST-SSR均具有显著的遗传差异性,但是两种标记都能有效的鉴别不同基因型个体。Genomic-SSR可优先用于分子身份证、高密度遗传连锁图谱的构建和遗传多样性分析;EST-SSR用来研究苎麻近缘种间的遗传多样性、进化分析、连锁图谱和比较基因组学更有优越性。
苎麻;遗传差异性;分子标记;Genomic-SSR;EST-SSR
苎麻是多年生宿根性草本植物,是重要的纤维纺织作物。为了培育优质高产的品种,育种学家需要更好地了解种质资源的遗传多样性以及主要性状的遗传规律。虽然表型性状和生化性状曾被广泛地运用在以上研究中,但其具有明显不足,比如多态性低,受环境影响大等。分子标记可以克服以上标记的不足,目前在许多作物的遗传多样性和遗传研究方面被广泛利用[1]。随着分子生物学技术快速的发展,各种分子标记技术不断出现,大大提高了科研人员对植物进行遗传分析研究的能力。其中 SSR由于具有共显性、多态性和信息量高以及容易检测等特点,已成为目前应用最广泛的分子标记[2]。早期 SSR标记开发需构建基因组文库,测序后根据 SSR两侧高保守序列设计特异性引物进行 PCR扩增,这种基于基因组文库数据开发的SSR标记被称为 Genomic-SSR,但是此方法开发成本高,周期长[3]。
随着功能基因组的发展,EST发展迅速,各个重要物种的EST序列的数目迅速增大,由于EST是来源于基因转录区域的3’或5’端测序的cDNA序列,与功能基因紧密连锁,所以EST -SSR已广泛应用于构建与特定功能相关的遗传连锁图谱[4]。
Genomic-SSR和 EST-SSR在许多作物中被证实具有显著的遗传差异性[5-7]。明确苎麻不同来源 SSR的遗传差异性,将有助于作物分子遗传机理的探讨,对作物种质评价以及相关研究具有重要意义。目前,尚未有苎麻Genomic-SSR和EST-SSR遗传差异的报道。本研究利用19个苎麻核心种质对Genomic-SSR和 EST-SSR遗传差异性进行分析,为充分利用不同来源的SSR标记进行研究提供理论支持。
1 材料与方法
1.1 材料
选取大浴见刀白、葛根麻、耒阳黄壳麻、黄平黄秆麻、小青杆、平昌家麻、大叶红蚱蜢、黎川厚皮苎麻、桐木青麻、资溪麻、南城厚皮苎麻等19个苎麻核心种质 (表1)。
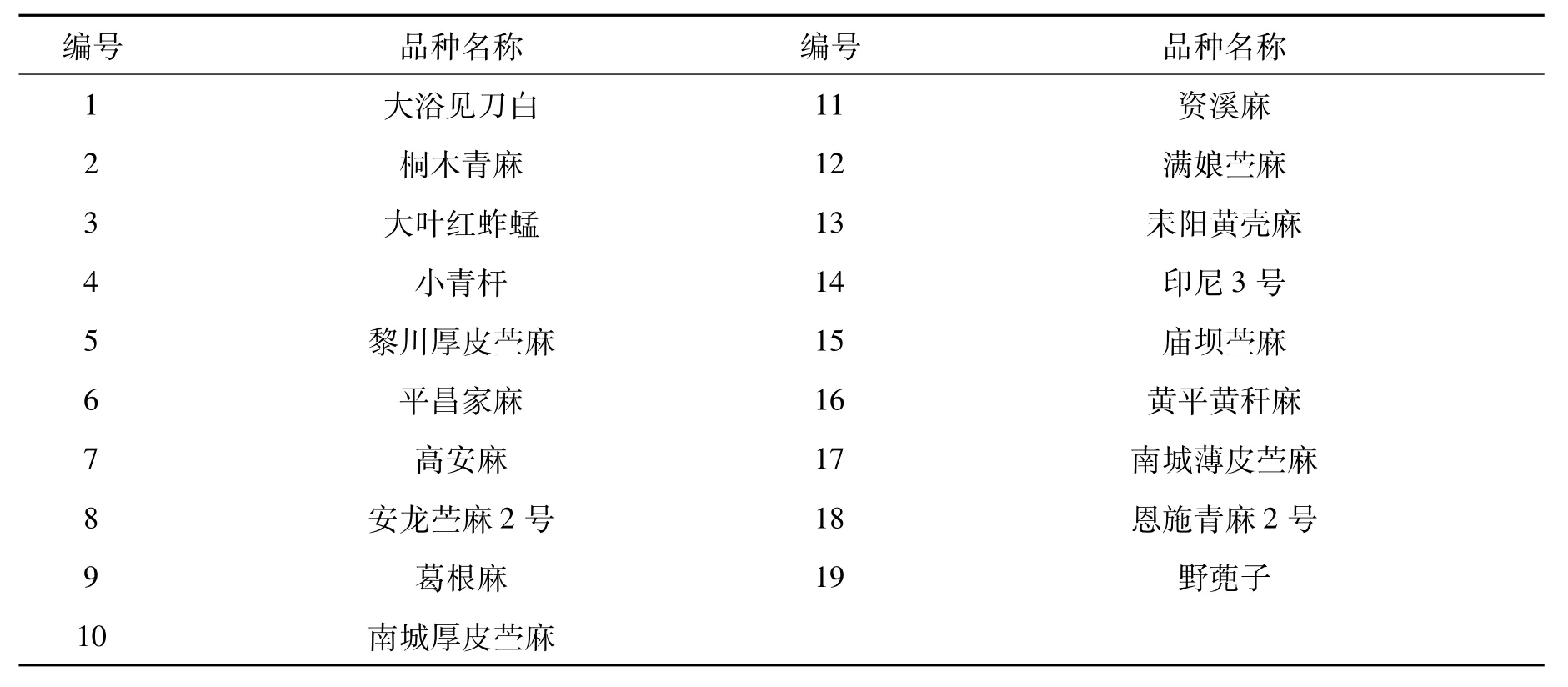
表1 苎麻试验材料Tab.1 Ramie varieties for SSR analysis
1.2 DNA提取
在国家种质长沙苎麻圃取苎麻种质植株的嫩芽,利用CTAB植物基因组 DNA快速提取试剂盒提取 DNA。用1%琼脂糖凝胶电泳检测纯度与浓度。
1.3 SSR引物合成
28对 Genomic-SSR为我们课题组根据苎麻基因组文库序列设计合成;21对 EST-SSR引物序列参照 Luan等[8]合成。
1.4 PCR扩增及电泳检测
PCR的反应体积为10 μL,内含DNA体积为 1 μL,dNTP为 0.36 μL,Taq酶为0.16 μL,buffer为1 μL,引物为1 μL,H2O为6.48 μL。反应程序为:94℃预变性5 min,95℃变性30 s,退火温度53℃进行45 s,72℃延伸1 min,33个循环,72℃延伸10 min,4℃保存。扩增产物用8%的变性聚丙烯酰氨凝胶垂直电泳进行检测,银染检测多态性,拍照记录条带。
1.5 统计方法
数字1和0分别表示供试材料电泳条带的有或无,用 Excel进行统计。利用软件 Popgene32 (version 1.31)[9]计算Shannon多样性指数、观测等位基因数 (Na)、有效等位基因数 (Ne)、观测杂合度 (Ho)和期望杂合度 (He);利用NTSYS--pc 2.1软件计算相似系数,按照 UPGMA方法进行聚类分析,并绘制聚类图。方差分析采用DPS软件进行。
2 结果与分析
2.1 Genomic-SSR和 EST-SSR多态性
利用28对Genomic-SSR引物进行扩增,得到99个条带(图1),每对引物扩增等位基因在2~5之间,平均3.5个。21对 EST-SSR引物对 19个苎麻品种进行扩增,共得到 49个条带,每对引物扩增等位基因在2~3之间,平均2.3个。Genomic-SSR引物的 Shannon指数变化范围为0.1269~1.3015,平均值 0.8864,观测等位基因数和有效等位基因数分别为3.4643和2.1982,观测杂合度和期望杂合度分别为0.5254和0.5172。EST-SSR的Shannon指数的变化范围为0.4362~1.0540,平均值 0.7120,观测等位基因数和有效等位基因数分别为2.3333和1.9438,观测杂合度和期望杂合度分别为0.5128和0.4778。Genomic-SSR和 EST-SSR两种引物的有效等位基因数 (Ne)和观测杂合度 (He)差异不显著,Genomic-SSR的 Shannon指数显著高于EST-SSR(见表2)。

图1 部分条带图Fig.1 part stripes
2.2 Genomic-SSR和 EST-SSR相似系数的相关性分析
利用28对 Genomic-SSR标记计算出的19个品种的相似系数在0.4141~0.8081之间,平均值为0.5865,其中桐木青麻与资溪麻、黄平黄秆麻相似系数最小,小青杆与黎川厚皮苎麻相似系数最大。根据21对 EST-SSR标记计算了 19个苎麻品种的相似系数 (表3),结果显示品种之间相似系数在0.3878~0.8163之间,平均值为0.6093。其中大叶红蚱蜢与小青杆、资溪麻相似系数最小,平昌家麻和耒阳黄壳麻、南城厚皮苎麻和黄平黄秆麻相似系数最大。综合 49对SSR标记 (Genomic-SSR和 EST-SSR)得出的相似系数在 0.4527~0.7568之间,平均值为0.5940,其中桐木青麻和黄平黄秆麻相似系数最小,小青杆和黎川厚皮苎麻相似系数最大。对Genomic-SSR、EST-SSR和 Genomic-SSR+EST-SSR的相似系数进行相关分析,结果见表4。结果表明,Genomic-SSR和EST-SSR相似系数并无相关性,而与综合相似系数均具有相关性。

表2 Shannon指数、有效等位基因数与观测杂合度的方差分析Tab.2 ANOVA of Shannon index,effective number of alleles and observed heterozygosity between Genomic-SSR and EST-SSR

表3 利用 Genomic-SSR和 EST-SSR计算的19个苎麻品种的相似系数Tab.3 Similarity coefficients of 19 ramie varieties detected by Genomic-SSR and EST-SSR
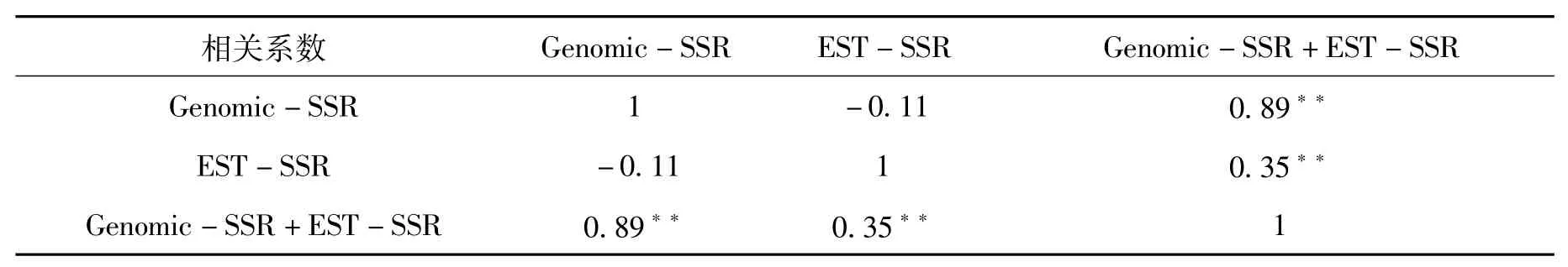
表4 相关性分析Tab.4 Correlation analysis
2.3 聚类分析
通过计算的遗传相似系数按UPGMA的方法进行聚类分析,更能直观的表现 19个苎麻品种之间的遗传关系。用28对 Genomic-SSR引物和21对 EST-SSR引物均能将19个苎麻品种区分开。
2.3.1 Genomic-SSR聚类图
由图2可知,Genomic-SSR标记在相似系数0.81处,可以将 19种苎麻材料全部区分。以遗传相似系数0.52为界,将苎麻材料分为两个类群,大浴见刀白和桐木青麻聚为一个类群,其余的材料又分为两个亚群,其中葛根麻和南城厚皮苎麻单独聚为一个亚群,剩下的苎麻品种为另一个亚群。
2.3.2 EST-SSR聚类图
由图3可知,在相似系数0.82处,EST-SSR能将其19种苎麻材料全部区分。以遗传相似系数0.52为界,将19个苎麻品种分为两大类群,大叶红蚱蜢单独为一个类群,剩下的材料又分为两个亚群,安龙苎麻2号单独为一个亚群,其余的材料聚为一个亚群。
2.3.3 Genomic-SSR和 EST-SSR综合聚类图
根据Genomic-SSR和EST-SSR两种多态性标记计算得到的遗传相似系数,按 UPGMA的方法进行聚类分析结果如图4。以遗传相似系数0.54为界,19个苎麻品种分为两个类群,大叶红蚱蜢单独为一个类群,其余的材料又分为两个亚群,大浴见刀白、葛根麻和南城厚皮苎麻聚为一个亚群,剩下的品种聚为另一个亚群。

图2 Genomic-SSR聚类图Fig.2 Dendrogram of GS with Genomic-SSR

图3 EST-SSR聚类图Fig.3 Dendrogram of GS with EST-SSR

图4 EST-SSR和 Genomic-SSR综合聚类图Fig.4 Combined dendrogram of GS with Genomic-SSR and EST-SSR
3 讨论
3.1 Genomic-SSR和 EST-SSR标记的遗传差异性比较
本研究利用 Genomic-SSR和 EST-SSR两种分子标记对 19个苎麻品种进行遗传差异性分析,结果显示,由 Genomic-SSR标记计算出的Shannon指数显著高于 EST-SSR。Genomic-SSR和 EST-SSR标记之间存在显著的遗传差异性,这与小麦的相关研究结果一致[4]。以前我们实验室报道了 EST-SSR的多态性为64.9%[10],而我们对 Genomic-SSR研究结果显示,其多态性为86.1% (结果未发表)。表明苎麻EST-SSR标记的多态性明显低于 Genomic-SSR标记,具有比较高的保守性。出现这种结果的原因,一种可能是由于内含子多态性,EST序列并不含有内含子,但在基因组中,内含子夹杂在目的基因中间,以基因组DNA为模板设计扩增的 Genomic-SSR引物可能扩增出了内含子片段,其多态可能是内含子多态,并不仅仅是简单重复序列[11];其次可能因为在物种进化过程中的选择牵连效应导致EST的多态性降低造成的[12],关键性状出现杂合变异的物种在选择过程中被淘汰,EST来自高度保守的 DNA转录区,直接控制生物性状,而非关键性状出现变异的却可以生存下来。
3.2 聚类分析
用两种标记对19个苎麻品种的相似性系数进行聚类分析,结果显示,虽然聚类排列顺序有所不同,但除个别品种之外,两种标记均能将不同基因型的材料区分开来,根据 EST-SSR和Genomic-SSR两种标记的相似系数得到图4,发现结果与 Genomic-SSR标记的结果更为相似,这可能是由于 EST-SSR来自高度保守的转录区域,所以其多态性理论上不如 Genomic-SSR,在鉴别亲缘关系较近的基因型上不如基因组SSR灵敏。虽然EST-SSR显示的多态性略低,但是由于其来自于基因编码区,对遗传图谱的构建、基因定位有重要作用,可以作为 Genomic-SSR的补充。
根据 Genomic-SSR和 EST-SSR两种标记得到的不同品种之间的相似系数无相关性,可能有以下两种原因。一种原因可能是在本试验中利用的SSR标记数目较少,扩增出的条带也较少,因此获得的品种间的遗传相似系数误差较大,可靠性不高,导致无法真实获得两种标记的相关性。另一种原因可能是两种标记具有遗传差异性,其中一种标记获得的聚类结果不是真实的聚类结果而导致两种标记间无相关性。我们前期的试验结果也表明,EST-SSR标记与田间性状的聚类结果差异较大[10]。
3.3 SSR标记在苎麻遗传多样性评价中的应用
苎麻遗传多样性评价是苎麻种质资源保护、创新和利用的基础。苎麻遗传多样性评价是苎麻种质资源保护、创新和利用的基础。本研究表明,EST-SSR的遗传多样性指数明显低于 Genomic-SSR,且Genomic-SSR标记的多态性较高,这与水稻和小麦上的研究结果相符合[13,14],但是两种标记都能有效的鉴别不同基因型个体,且在有效等位基因数和观测杂合度上并无显著差异性。Genomic-SSR具有较高的遗传多样性指数和多态性,表明其具有较高的鉴别种质的能力,另外,随着非编码序列调控功能的大量发现,Genomic-SSR在发现性状调控因子方面的潜力巨大,可优先用于分子身份证、高密度遗传连锁图谱的构建和遗传多样性分析。EST-SSR的显著特点是来自基因高保守的转录序列,不易发生变异。虽然其揭示的多态性要低于基因组SSR,但在物种之间的通用性要优于 Genomic-SSR[15,16]。由于其是对基因内部变异的直接评价与体现,所以用来研究苎麻近缘种间的遗传多样性、进化分析、连锁图谱和比较基因组学更有优越性。
4 结论
在标记多态性及基因型鉴别等方面,Genomic-SSR与 EST-SSR均具有显著的遗传差异性,但是两种标记都能有效的鉴别不同基因型个体。Genomic-SSR可优先用于分子身份证、高密度遗传连锁图谱的构建和遗传多样性分析;EST-SSR用来研究苎麻近缘种间的遗传多样性、进化分析、连锁图谱和比较基因组学更有优越性。
[1]谭龙涛,喻春明,陈平,等.苎麻自交纯合进度研究 [J].中国农业科学,2014,47(22):4371-4379.
[2]甄贞,曹庆芹,沈元月,等.SSR技术及其在果树研究上的应用 [J].中国农学通报,2007,23(6):145-148.
[3]R··Oder M S,Korzun V,Wendehake K,et al.A microsatellite map of wheat[J].Genetics,1998,149:2007-2023.
[4]周延清.DNA分子标记技术在植物研究中的应用 [M].北京:化学工业出版社,2005:136-143.
[5]杨新泉,刘鹏,韩宗福,等.普通小麦Genomic-SSR和EST-SSR分子标记遗传差异及其与系谱遗传距离的比较研究[J].遗传学报,2005,32(4):406-416.
[6]常玮,赵雪,李侠,等.大豆 EST-SSR标记开发及与 Genomic-SSR的比较研究 [J].中国油料作物学报,2009,31 (2):149-156.
[7]宋跃朋,江锡兵,张曼,等.杨树Genomic-SSR与 EST-SSR分子标记遗传差异性分析 [J].北京林业大学学报,2010,32(54):1-7.
[8]Luan M B,Zou Z Z,Zhu J J,et al.Development of a core collection for ramie by heuristic search based on SSR markers[J]. Biotechnology&Biotechnological Equipment,2014,28(5):798-804.
[9]Yeh F C,Yang R C,Boylet T,1999.POPGENE(version 1.31):Software Microsoft Windows-based Freeware for Population Genetics Analysis.University of Alberta,Alberta,Canada.
[10]邹自征,陈建华,栾明宝,等.应用RSAP、SRAP和 SSR分析苎麻种质亲缘关系 [J].作物学报,2012,(5):840-847.
[11]Van K,Hwang Y,Kim Y.Discovery single nucleotide polymorphism in soybean using primers designed from ESTs[J].Euphytica,2004,139:147-157.
[12]Maynard S J,Haigh J.The hitch-hiking effect of a favorable gene[J].Genet Res,1974,23(1):23-35.
[13]Eujay I,Sorrells M E,Baum M,et al.Assessment of genotypic variation among cultivated durum wheat based on EST-SSRs and genomic SSRs[J].Euphytica,2001,119:39-43.
[14]Cho Y G,Ishii T,Temnykh S,et al.Diversity of microsatellite derived from genomic libraries and GenBank sequences in rice (Oryza sativa L.)[J].Theor Appl Genet,2000,100:713-722.
[15]Gao L F,Tang J,Li H,et al.Analysis of microsatellites in major crops assessed by computational and experimental approaches [J].Mol.Breed,2003,12:245-261.
[16]Gupta P K,Varshney R K.The development and use of microsatellite markers for genetic analysis and plant breeding with emphasis on bread wheat[J].Euphytica,2000,113:163-185.
Genetic Differences in Ramie Analyzed between Genomic-SSR and EST-SSR
LIU Chen-chen,LUAN Ming-bao*,CHEN Jian-hua*,WANG Xiao-fei,XU Ying,SUN Zhi-min
(Institute of Bast Fiber Crops,Chinese Academy of Agricultural Sciences,Changsha 410000,China)
In order to clarify the genetic differences among different SSRs,Genomic-SSR and EST -SSR were used to analyze the genetic diversity of 19 important ramie genetic resources.According to the statistical results,the average observed-alleles detected by Genomic-SSR was 3.4643,effective alleles was 2.1982,shannon was 0.8864,heterozygosity was 0.5254,expected heterozygosity was 0.5172.The average observed-alleles detected by EST-SSR was 2.3333,effective alleles was 1.9438,shannon was 0.7120,heterozygosity was 0.5128,expected heterozygosity was 0.4778.There were no significant differences in effective number of alleles(Ne)and observed heterozygosity(Ho)between Genomic-SSR and EST-SSR.Genomic-SSR Shannon index was significantly higher than that of EST-SSR.The above results showed there were significant genetic differences in marker polymor-phism and genotype identification between Genomic-SSR and EST-SSR,but the two kinds of markers could also effectively identify different genotypes.Genomic-SSR had priority for molecular identification,construction of high-density genetic linkage map and analysis of genetic diversity,EST-SSR had more advantages of studying the genetic diversity among close ramie species,evolutionary analysis,genetic map and comparative genomics.
ramie;genetic differences;molecular marker;Genomic-SSR;EST-SSR
S563.1
A
1671-3532(2015)02-0057-07
2015-01-26
国家自然科学基金 (31471547;30900913);湖南省自然科学基金 (13JJ4116);国家科技支撑计划 (2013BAD01B03 -13)
刘晨晨 (1990-),女,在读硕士,研究方向:鉴定评价与种质创新。E-mail:chenchenliu2012@126.com。
*
陈建华 (1963-),博士,研究员,研究方向:苎麻种质资源。E-mail:cjhbt@sina.com。栾明宝 (1978-),博士,副研究员,研究方向:苎麻种质资源。E-mail:luanmingbao2002@126.com。
