大鼠急性心肌缺血早期内皮微颗粒水平及心肌细胞凋亡变化
2015-01-08郭壮波伍光颖李超霞钟志勇
李 强 郭壮波 伍光颖 李超霞 钟志勇
(暨南大学医学院第四附属医院,广州市红十字会医院1急诊科,广东 广州510220;2检验科,广东广州510220;3广东省医学动物实验中心,广东佛山528248)
血管内皮细胞具有维持血管弹性,保持血管内膜完整,防止血细胞黏附、防血栓形成等重要功能。内皮功能障碍、炎症反应、细胞凋亡均为动脉粥样硬化(atherosclerosis,AS)的关键因素。内皮功能障碍贯穿于AS及斑块不稳定的形成过程中,从而导致包括急性冠脉综合征(acute coronary syndrome,ACS)在内的临床事件[1]发生。因此评估内皮损伤程度、内皮功能状态对动脉粥样硬化性疾病和急性心血管事件的发生具有重要价值。EMP是内皮细胞激活或凋亡时产生的膜性小囊泡。EMP新近被认为是能够反映内皮损伤及功能障碍的替代性标记,但其对于ACS的预测价值尚不清晰。本研究拟建立大白鼠急性心肌缺血的模型,通过检测心肌缺血不同时段EMP和cTNT、CK-MB的动态变化,及统计大鼠心肌缺血后心肌细胞凋亡率,探讨EMP作为早期急性心肌缺血评估指标的可能性。
1 材料和方法
1.1 材料
1.1.1 实验动物 健康雄性SD大鼠24只,SPF级,由广东省医学实验动物中心提供(实验动物使用许可证号:SYXK粤2013-0002)。根据体质量随机分为Sham组、MI组、I/R组,每组8只。
1.1.2 试剂与仪器 试剂:CK-MB试剂盒(武汉华美生物科技),cTnT ELISA Kit(武汉华美生物科技);CD31-PE荧光标记单抗(美国 BD公司);CD42b-FITC荧光标记单抗(美国BD公司)。仪器:7020型全自动生化分析仪(日本HITACHI公司);流式细胞仪(型号:FACSCATON,美国BD公司)。
1.2 方法
1.2.1 研究分组 Sham组大鼠进行开胸与穿线处理,但不结扎阻断冠状动脉左前降支。MI组在Sham组的基础上,结扎冠状动脉左前降支,结扎后不再复通。I/R组在Sham组的基础上,结扎冠状动脉左前降支30min后进行复通。
1.2.2 心肌缺血模型构建 大鼠腹腔注射3%戊巴比妥钠(60 mg/kg)麻醉,剃去颈部和胸部毛发,以75%酒精擦拭消毒颈部皮肤后作正中切口约1 cm,暴露气管,进行气管插管并连接呼吸机(呼吸机工作条件:呼吸频率70~80次/MIn,潮气量7~8 mL,呼吸时间比为1∶1)。待大鼠呼吸与呼吸机同步后,测量大鼠心电图基础值。取心电图无异常大鼠,消毒胸部皮肤后,剪开皮肤并钝性分离胸部肌肉直至暴露肋骨,剪开第3与第4根肋骨,扩开大鼠胸腔,充分暴露心脏。用眼科镊撕开大鼠心脏心包膜,寻找大鼠左心耳与动脉圆锥,在左心耳与动脉圆锥之间穿入0号线,结扎,以心电图Ⅱ导联检测,有典型缺血心电图改变者判定冠状动脉左前降支成功结扎,可进行下一步缝合或者复通操作。所有大鼠模型建立完毕后,逐层缝合大鼠肌肉和皮肤,挤出大鼠胸腔空气后撤去呼吸机,归笼单笼饲养。
1.2.3 标本的采集与处理 Sham组以穿线为造模结束时间点,MI组,I/R组以复通冠状动脉左前降支为造模结束时间点,在造模结束后2和24 h,分别采集大鼠血清与血浆(柠檬酸钠抗凝),于-80℃保存备用。造模结束后2、24 h,分别解剖取大鼠心脏,以4%中性甲醛固定。
1.2.4 指标测定 cTNT:依照ELISA Kit说明书,使用ELISA Kit进行检测。CK-MB:全自动生化分析仪检测样本中CK-MB含量。EMP:流式细胞术检测样本EMP。染色:样本加抗 CD31-PE(1∶100比例用PBS稀释)和抗 CD42b-FITC(1∶200比例用 PBS稀释)各10μL,然后加入50μL血浆样本,于暗处孵育30 min。孵育结束后加入1 000μL PBS混匀待测。上机测定:设定上机吸样速度为中速,吸样时间为30 s,上机检测EMP,记录 CD31+/CD42b-为 EMP的量。心肌细胞凋亡检测:以Tunel法检测各组大鼠心肌细胞凋亡情况,每只大鼠造模后2h和24h分别处死,取心脏固定后制备石蜡切片,依照罗氏Tunel细胞凋亡检测试剂盒进行操作,DAB染色,光学显微镜下每张切片选取具有代表性的3个视野,使用IPP 6.0软件分别对凋亡细胞(细胞核呈棕色)和正常细胞进行计数,统计不同大鼠心肌细胞的凋亡率。
1.3 统计学分析
统计学方法对各量化检测指标进行统计处理并列表说明,各组数据以,采用SPSS 21.0统计软件进行重复测量的方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 各组CK-MB的水平比较
造模后2 h和24 h,各组组间CK-MB水平比较未见统计学差异(P>0.05)。两个时间点前后比较,Sham组大鼠的CK-MB水平变化无统计学差异(P>0.05);MI组大鼠的CK-MB表达水平显著性升高(P<0.05)。见表 1。
表1 各组大鼠血液CK-MB的表达(±s,U/L)
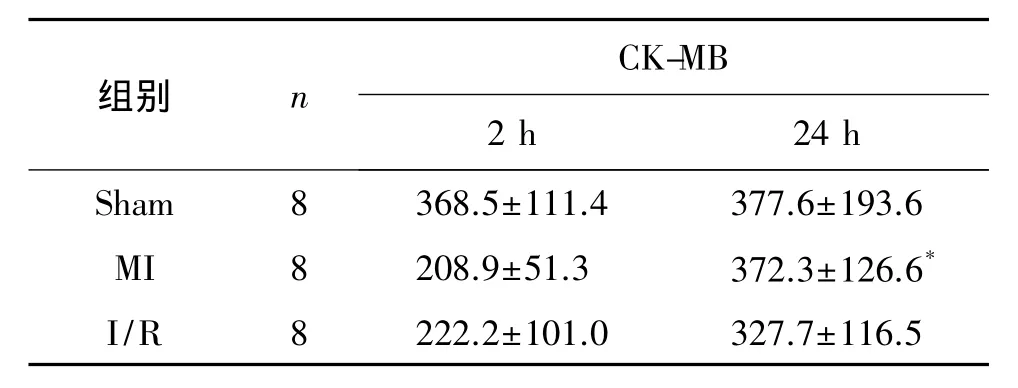
表1 各组大鼠血液CK-MB的表达(±s,U/L)
注:与造模后2 h比较,*P<0.05
CK-MB组别 n 2 h 24 h Sham 8 368.5±111.4 377.6±193.6 MI 8 208.9±51.3 372.3±126.6*I/R 8 222.2±101.0 327.7±116.5
2.2 ELISA检测各组大鼠cTNT的水平比较
造模后2 h,各组组间CK-MB水平比较未见统计学差异(P>0.05)。造模后24 h,I/R组cTNT表达水平低于MI组(P<0.05)。两个时间点前后比较,Sham组、MI组大鼠的cTNT水平无明显变化(P>0.05)。I/R组大鼠的cTNT水平呈现下降的趋势(P<0.05);与MI组比较cTNT水平呈现下降的趋势,差异有统计学意义(P<0.05)。见表2。
表2 各组SD大鼠cTNT的表达(¯±s,pg/mL)

表2 各组SD大鼠cTNT的表达(¯±s,pg/mL)
注:与造模后2 h比较,#P<0.05;与MI组比较,*P<0.05
cTNT组别 n 2 h 24 h Sham 8 131.0±124.2 129.8±52.7 MI 8 120.7±62.6 149.0±38.8 I/R 8 179.2±15.1 88.4±29.7#*
表3 各组大鼠血清EMP的表达(±s,个/50μL)

表3 各组大鼠血清EMP的表达(±s,个/50μL)
注:与 MI组比较,*P<0.05;与 Sham 组比较,#P<0.01
EMP组别 n 2 h 24 h Sham 8 0.50±1.07 0.13±1.35 MI 8 31.25±27.18# 33.63±33.78#I/R 8 0.50±0.76* 10.13±28.24*
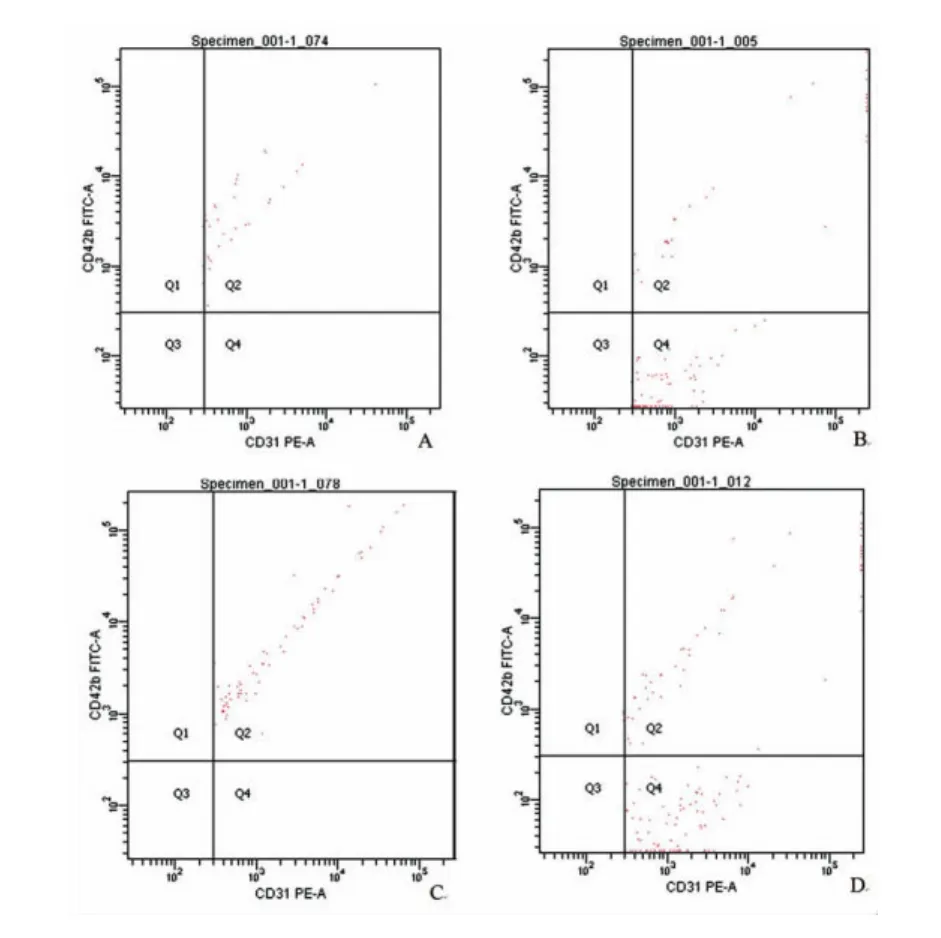
图1 造模后2、24 h Sham组与MI组EMP流式细胞图
2.3 流式细胞仪检测各组大鼠EMP水平比较
造模后2 h,MI组大鼠EMP表达水平显著高于Sham组及I/R组(P<0.05);造模后24 h,MI组大鼠EMP表达水平显著高于Sham组(P<0.05);I/R组大鼠EMP表达水平与Sham组比较无统计学差异(P>0.05);MI组大鼠EMP表达水平显著高于I/R组,差异有统计学意义(P<0.05)。各组间EMP表达水平造模后2 h与造模后24 h EMP表达水平比较无统计学差异(P>0.05)。见表3及图1-2。
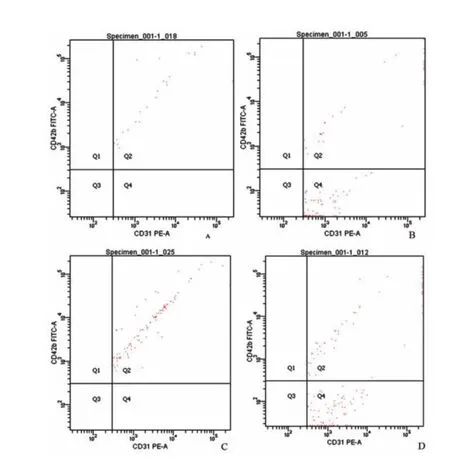
图2 造模后2、24 h I/R组与MI组EMP流式细胞图
2.4 Tunnel检测各组大鼠心肌细胞凋亡率的影响
造模后2 h MI组、I/R组大鼠的心肌细胞凋亡率分别与Sham组比较,显著提高(P<0.05),I/R组大鼠的心肌细胞凋亡率比MI组稍降低,但无统计学差异(P>0.05);造模后24 h,MI组、I/R组大鼠的心肌细胞凋亡率分别较Sham组稍高,而I/R组比MI组稍低,但均无统计学差异(P>0.05);各组间造模后2 h与造模后24 h心肌细胞凋亡率比较均无统计学差异(P>0.05)。见表4及图3-4。
表4 各组大鼠心肌细胞凋亡率的比较±s,%)

表4 各组大鼠心肌细胞凋亡率的比较±s,%)
注:与Sham组比较,*P<0.05
组别 n 凋亡率2 h 24 h Sham 8 8.21±1.10 45.14±20.65 MI 8 41.56±12.51* 49.14±18.30 I/R 8 39.27±10.42* 47.71±13.63

图3 造模后2 h Sham组和MI组大鼠TUNEL染色结果(×400)

图4 造模后2 h Sham组和I/R组大鼠TUNEL染色结果(×400)
3 讨 论
冠心病是目前导致死亡的主要原因。ACS则是冠心病的一种较为严重的临床表现形式,多种因素导致冠状动脉内斑块糜烂及破裂、血栓形成、血管痉挛,而血管内皮功能障碍正是心血管疾病发生的中心环节和始动因素,其中“内皮损伤反应学说”认为化学因素、免疫因素等刺激对内皮细胞造成损伤,导致内皮功能障碍。因此,寻找一种能够定量评估内皮功能状态的指标,对于预测ACS的发生和发展至关重要。
EMP正是内皮细胞激活或凋亡时释放的一种膜性囊泡。目前普遍认为EMP不仅是存在于循环中的内皮细胞脱落的碎片,而且通过其表面不同蛋白分子与靶细胞相互作用起到信息传递的作用,并参与到许多与循环系统疾病相关的病理生理过程中。近年来,研究发现 EMP 在 ACS[2-5]、糖尿病[6-7]、肾脏疾病[8]、周围血管病[9]、自身免疫性疾病如系统性红斑狼疮[10]患者中显著升高,被认为是内皮功能障碍的指标。EMP能够利用流式细胞术定量检测[11]。不同的表型预示着EMP的细胞来源不同。CD31抗原是内皮细胞源性的特异抗原,CD42抗原是血小板源性的特异抗原,本研究检测血浆抗CD31阳性、抗CD42阴性的内皮微粒的水平,有效排除血小板源性的微粒子影响。结果显示造模后两个时间段 MI组EMP水平均较 Sham组明显升高,表明EMP可以反映不同时段急性心肌缺血时内皮功能障碍的程度。而造模后2h I/R组与Sham组比较无明显变化,可能与在短时间内血管复通后减少了内皮损伤有关。目前介入治疗(percutaneous coronary intervention,PCI)已成为ACS的主要治疗手段,极大地改善了患者的预后。本研究亦提示ACS进行介入治疗必需争分夺秒,尽可能将内皮损伤的程度降至最低,对于患者的预后无疑是有利的。但是心脏介入治疗并非所有患者都受益,部分患者并未从中受益,究其原因是在对靶血管行PCI术后仍存在着缓血流或无复流现象,或PCI术后出现缺血再灌注损伤。有研究显示,罪犯血管内的EMP水平在血管疏通后明显高于外周循环,提示冠脉即使在再灌注治疗成功后仍处于高凝状态[12]。介入治疗本身同时对血管是一种刺激。血管成形术后远端保护装置中收集的冠脉血样本中,能监测到高浓度的微颗粒;PCI术后8h,循环EMP升高,且冠脉内EMP水平与“无复流”相关[13]。研究证实,无复流的发生和发展的核心机制实际是冠脉微血管内皮炎症和损伤,陆永光等[14]的研究提示EMP可作为评价ACS患者在行PCI后无复流导致冠脉微血管内皮炎症反应和损伤程度的标志物,或成为改善I/R损伤的一个新靶点。
细胞凋亡是主动性细胞死亡形式,动物及人的急性心肌缺血过程均可诱导细胞凋亡[15]。大量研究显示急性心肌缺血等心血管疾病存在细胞凋亡,而细胞凋亡正是导致I/R损伤的重要环节之一。本研究显示造模后2h,MI组及I/R组心肌细胞凋亡率均显著提高;I/R组CK-MB、cTNT水平略高于MI组亦与再灌注过程中心肌细胞损伤有关。早期干预是否能阻断细胞凋亡,是未来的研究方向。
EMP的临床应用仍有很多局限性。首先目前大部分的证据源自于横断面的研究,前瞻性研究数据较少[16]。其次定义EMP的标准表面分子标志组合,制订检测EMP的标准流程和分析其数据变量的标准方法等问题是未来需要关注的热点;其它限制如有哪些因素能影响体内EMP的变化以及EMP随采集时间长短的波动程度等。
目前虽然对于有传统心血管危险因素(如吸烟、高血压、高血脂、糖尿病等)的患者实行一级预防和二级预防,仍未能减少心血管事件的发生[17],而EMP在心血管疾病初级预防的风险评估中显示出它的价值[18],尤其是对那些处于中度风险的患者。有证据证明在已知心血管疾病的患者中EMP对于复发高风险个体确定更有价值,能有效提高二级预防效果和减少心血管事件发生。展望未来,深入研究若对于心血管风险因素的治疗,EMP呈现敏感的下降趋势,它们或许在监测治疗方面体现价值;若EMP和心血管疾病有因果关系,它们或将成为新的治疗靶点,为临床心血管病的诊治提供新的策略。
[1] Casscells W,Naghavi M,Willerson JT.Vulnerable atherosclerotic plaque:a multifocal disease [J].Circulation,2003,107(16):2072-2075.
[2]Mallat Z,Benamer H,Hugel B,et al.Elevated levels of shed membrane microparticles with procoagulant potential in the peripheral circulating blood of patients with acute coronary syndromes[J].Circulation,2000,101(8):841-843.
[3]Bernal-Mizrachi L,JY W,Jimenez JJ,et al.High levels of circulating endothelial microparticles in patients with acute coronary syndromes[J].Am Heart J,2003,145(6):962-970.
[4]Jung C,Sörensson P,Saleh N,et al.Circulating endothelial and platelet derived Microparticles reflect the size of myocardium at risk in patients with ST-elevation myocardial infarction[J].Atheroselerosis,2012,221(1):226-231.
[5]程 飞,陶 军,冯鉴强,等.内皮微颗粒通过NADPH氧化酶损伤内皮细胞功能[J].南方医科大学学报,2010,30(5):1103-1106.
[6]Sabatier F,Darmon P,Hugel B,et al.Type 1 and type 2 diabetic patients display different patterns of cellular microparticles[J].Diabetes,2002,51(9):2840-2845.
[7]蒋红丽,王连升,王长谦.冠状动脉性心脏病合并2型糖尿病患者的内皮细胞微粒水平[J].上海医学,2011,34(3):183-185.
[8]Boulanger CM,Amabile N,Guérin AP,et al.In vivo shear stress determines circulating levels of endothelial microparticles in end-stage renal disease[J].Hypertension,2007,49(4):902-908.
[9]Tan KT,Tayebjee MH,Lynd C,et al.Platelet microparticles and soluble P selection in peripheral artery disease:Relationship to extent of disease and platelet activation markers[J].AnnMed,2005,37(1):61 -66.
[10] Dignat-George F,Camoin-Jau L,Sabatier F,et al.Endothelial microparticles:a potential contribution to the thrombotic complications of the antiphospholipid syndrom [J].Thromb Haemost,2004,91(4):667-673.
[11]Enjeti AK,Lincz LF,Seldon M.Detection and measurement of microparticles:an evolving research tool for vascular biology[J].Semin Thromb Hemost,2007,33(8):771-779.
[12]Morel O,Pereira B,Averous G,et al.Increased levels of procoagulant tissue factor-beating microparticles within the occluded coronary artery of patients with ST-segment elevation myocardial infarction:role of endothelial damage and leukocyte activation[J].Atheroosclerosis,2009,204(2):636-641.
[13] Biasucci LM,Porto I,Di Vito L,et al.Diferences in micropartiele release in patients with acute coronary syndrome and Stable angina[J].Circ J,2012,76(9):2174-2182.
[14]陆永光,文 宏,曾书焱,等.替罗非班对冠脉无复流患者内皮微粒和可溶性细胞间黏附分子-1的影响[J].实用医学杂志,2010,26(9):1540-1543.
[15] Zalewski J,Nessler J.The endogenous cardi0protection during reperfusion in acute myocardial infarction[J].KardioPol,2011,69(Suppl 3):67-74.
[16]Lacroix R,Judicone C,Poncelet P,et al.Impact of preanalytical parameters on the measurement of circulating microparticles:towards standardization of protocol[J].J Thromb Haemost,2012,10(3):437-446.
[17]Cooney MT,Dudina AL,Graham IM.Value and limitations of existing scores for the assessment of cardiovascular risk:a review for clinicians[J].J Am Coll Cardiol,2009,54(14):1209-1227.
[18]陈 根,秦旭平,李 洁.内皮源性超极化因子与心血管疾病[J].中华生物工程医学,2014,20(2):171-175.
