大鼠隐睾模型的建立及胚胎干细胞原位注射的治疗研究
2015-01-08刘贵华袁浩锋汪中扬
瞿 虎 刘贵华 袁浩锋 汪中扬 杨 轶 张 靖
(中山大学附属第六医院1泌尿外科,广东广州510655;2生殖中心,广东广州510655;3东莞市第三人民医院泌尿外科,广东东莞523326)
隐睾在男性新生儿的发病率约为2%~4%,早产儿中的发病率更高,且发病率呈上升趋势[1]。隐睾处于腹内或腹股沟区的高温环境会导致血睾丸屏障的通透性增加,使睾丸萎缩质量下降,生精小管内各支持细胞之间及支持细胞与生殖细胞之间的连接蛋白减少[2],从而阻碍生殖细胞的减数分裂,造成新生精子数目减少、畸形及活力低下。尽管针对隐睾的激素诱导治疗及睾丸下降固定的外科治疗已经持续了很多年,但远期效果仍然存在争议,仍然存有不育的风险(单侧隐睾可达33%,双侧隐睾可达66%)[3]。本研究拟探讨胚胎干细胞的睾丸内原位注射对此类睾丸功能损害修复作用的可能性。
1 材料和方法
1.1 实验材料
3月龄Wistar雄性大鼠40只,体质量约300~400 g(购自中山大学实验动物中心),双侧睾丸均已下降,处于睾丸生精功能最佳时间,其中20只大鼠用于模型建立的观察研究,另外20只用于胚胎干细胞原位注射的疗效研究。小鼠胚胎干细胞为中山大学生命科学院的松阳洲教授团队馈赠。
1.2 实验分组
用于胚胎干细胞原位注射20只Wistar大鼠随机分为A组和B组,每组10只。
①A组:即干细胞组(ES),取大鼠左侧睾丸,在隐睾模型建立2周后行睾丸下降固定术,下降的同时注射小鼠胚胎干细胞(每只睾丸100μL,多点注射,细胞数约20 000个),下降2周后取材(大鼠的一个生精周期为12.8 d)。同时取大鼠右侧睾丸作为自身空白对照(NPBS组),在隐睾模型建立2周后行睾丸下降固定术,下降的同时注射PBS溶液(每只睾丸100μL,多点注射),下降2周后取材。
②B组:即组间对照组(JPBS组):取大鼠左侧睾丸,在隐睾模型建立2周后行睾丸下降固定术,下降的同时注射PBS溶液(每只睾丸100μL,多点注射),下降2周后取材。
1.3 实验方法
1.3.1 大鼠热损伤(隐睾)模型的建立 20只Wistar大鼠,选取右侧睾丸手术建立隐睾模型,10%水合氯醛腹腔注射(0.3 mL/100 g)麻醉,腹部正中切口,将右侧睾丸经腹股沟管挤入腹腔,剪断尾部引带,利用附睾脂肪垫将睾丸缝线固定于同侧腹壁肌肉上。分别于隐睾7、10、14、21及28 d后行隐睾下降固定术,下降后选取不同的时间点行附睾穿刺液及睾丸病理检查,确证睾丸损害不可逆恢复时间。
1.3.2 建模后的睾丸下降固定术 麻醉后原切口入路开腹,找到固定腹壁上的右睾丸,剪断固定缝线;于右阴囊最低处小切口以小弯钳经阴囊及腹股沟管探入腹腔牵引睾丸下降入阴囊内,将睾丸固定于阴囊壁内。
1.3.3 附睾穿刺液的获取 室温下,麻醉后切开右侧阴囊,于附睾尾部细针穿刺挤出液体,移液器吸取(0.5μL),加入盛有0.1 mL生理盐水的 EP管内待检(30 min内用完)。EP管摇匀,取10μL稀释后的附睾穿刺液滴于载玻片上,加上盖玻片,100倍光镜下随机选取5个视野观察寻找是否有活动的精子,如此反复5次;另取5μL精子悬液滴于载玻片上,加上1%的伊红5μL染色,在100倍光镜下随机选取5个视野观察寻找是否有精子,如此反复5次。
1.3.4 睾丸组织的病理形态 结扎睾丸血管,迅速取出睾丸,用细针于睾丸白膜上随机刺破4个点,于mDF固定液中固定48 h后换置于10%的中性福尔马林溶液中,石蜡包埋切片(层厚3μm),每个标本切片5张,HE染色,病理形态学观察睾丸间质、生精小管及生精上皮的形态学改变。
1.3.5 胚胎干细胞的原位注射 根据前期建模研究,在隐睾模型建立2周后在睾丸复降的同时,采用胰岛素微量注射器于睾丸纵轴中点的横断面周围行多点注射,每个点的穿刺注射深度约为1 mm,每只睾丸的注射量为100μL,总细胞数约20 000个。
1.3.6 观察指标 各组大鼠注射2周后行附睾穿刺液及睾丸组织病理检查,观察以下指标:
生精小管的直径(d):选取有代表性的视野,利用医学图像分析软件Digimizer v4.2.6随机测量20个圆形生精小管的直径;
生精小管百分率(r):保留1层或以上生精细胞层数的生精小管/总的生精小管(随机选取100个生精小管计算,共5次取中位数);
生精小管的Johnsen评分(z):另于高倍镜下随机行20个生精小管Johnsen评分的中位数。
1.4 统计学分析
所有数据均采用SPSS 16.0软件处理,计量资料数据用¯x±s表示,方差不齐的数据用中位数和四分位数表示,多组间的比较采用方差分析,Bonferroni法行多个样本间的两两比较,P<0.05认为差异有统计学意义。
2 结果
2.1 大鼠建模后各时间点附睾穿刺液的精子情况
大鼠隐睾后仅7 d后的附睾穿刺液中可见到极少量无活力的精子,以畸形为主,睾丸下降1周后精子的数目稍有增多且部分存在活力;隐睾10、14、21和30 d的附睾穿刺液中,睾丸复降2月的附睾穿刺液中均未能发现精子。
2.2 大鼠建模后各时间点睾丸的病理表现
大鼠隐睾后7 d后的睾丸病理显示无实质性损害,10 d及以上,即使脱离了热环境,超过一半以上的生精小管可能出现永久性的不可逆性损伤,主要表现为生精小管的严重萎缩,管壁内仅残存支持细胞。在睾丸下降的早期,几乎所有的生精小管内均只残留支持细胞。随着下降时间的延长,部分生精小管的生精细胞层数仍然存在不同程度的恢复,r及z都有增加的趋势,含有生精细胞的d继续增加(P<0.05),但恢复的生精细胞多数排列紊乱,余下的至少超过一半以上的生精小管则继续萎缩,可能永久丧失生精功能。见图1、2及表1。
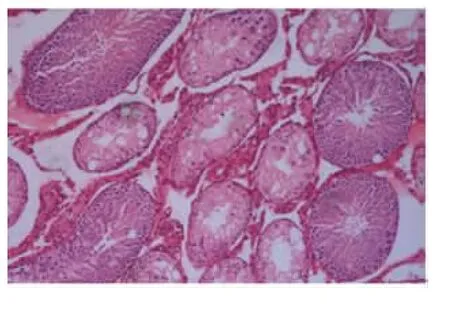
图1 隐睾2周,下降固定后最长至2个月大鼠部分生精小管恢复的病理图片(HE染色,×50)

图2 隐睾2周,下降固定后最长至2个月大鼠无生精小管恢复的病理图片(HE染色,×50)
2.3 干细胞原位注射后各组大鼠生殖情况的比较
干细胞注射后各组大鼠附睾穿刺液中均未能发现精子。但ES组的z评分高于NPBS组(P<0.05),与JPBS组相比差异无统计学意义(P>0.05),d和r 3组比较差异无统计学意义(P>0.05),见表2。
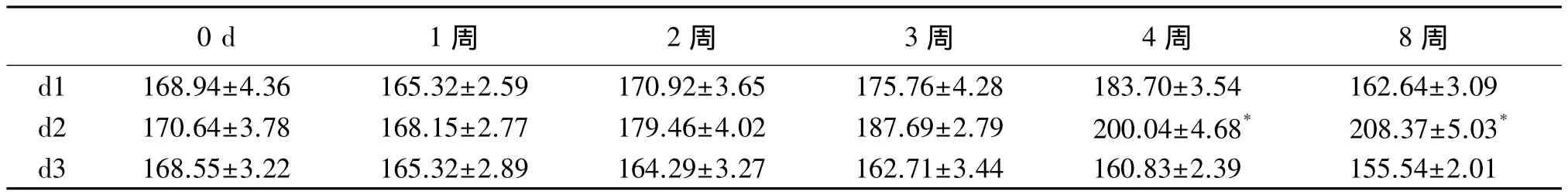
表1 大鼠隐睾建模后2周生精小管直径随睾丸下降时间的变化(¯x±s,μm)
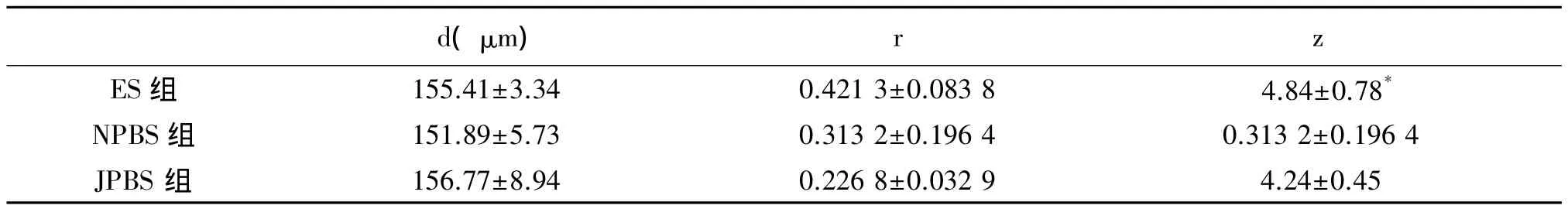
表2 干细胞原位注射后各组大鼠生殖情况的比较(n=10,¯x±s)
3 讨 论
近十年来,睾丸功能障碍在自体及同种异体移植、间质细胞移植、干细胞移植等方面取得了较为显著的进展,有望为男性不育及性功能障碍患者的治疗提供新的方法和手段[4]。在异种组织移植方面已经有多家报道将异体异种未成熟睾丸组织移植到作为受体的小鼠睾丸内可以获得相应供体动物的精子[5]。Clouthier等[6]曾通过显微注射的方法将转基因SD大鼠的精原干细胞移植到免疫缺陷的小鼠睾丸内,通过对细胞进行标记后,可以看到其在小鼠睾丸组织内生长,并在小鼠附睾内发现大鼠精子。Hermann等[7]利用超声波引导的方法将供体猕猴的精原干细胞悬液移植入受体猕猴的睾丸网中,移植后的受体恢复了精子发生并产生有功能的精子,因条件限制并未产生后代,但灵长类精原干细胞的移植成功为进一步临床应用奠定了基础。而在人类睾丸组织移植进展方面,Sato等[8]发现将睾丸癌患婴的睾丸组织移植到免疫缺陷的裸鼠体内且未应用外源性激素的情况下,精原干细胞可以分化到第一次减数分裂前期的粗线期精母细胞。
利用胚胎干细胞的全能性来尝试修复治疗各种组织器官的损害是近年的热点,以小鼠胚胎干细胞的研究最为成熟,并对一些动物疾病模型,如糖尿病、心肌梗死、帕金森病、脱髓鞘疾病等取得较好疗效。越来越多的研究者趋向于直接移植胚胎干细胞的方法来治疗动物疾病模型,部分研究者将胚胎干细胞静脉注射来治疗受损的动物组织器官,但此法缺少针对性,且要求胚胎干细胞首先突破机体的免疫系统和血管内皮网,起效慢,对注射剂量的选择和模型动物的要求均较高。相比下胚胎干细胞原位注射则优势显著,比较成功的报道有心肌梗死的治疗,研究者将事先标记过的大鼠胚胎干细胞多点注射于大鼠梗死心肌的周围后,发现这些胚胎干细胞逐渐开始出现自发节律性的收缩,免疫组化和电镜证实这些细胞已经分化为心肌细胞,并能阻止心室重构、减少梗死瘢痕和改善心功能[9]。但直接行胚胎干细胞睾丸原位移植则较少报道,尤其对于受损伤的睾丸原位注射胚胎干细胞是否具有疗效,目前尚未见确切的文献报道。本研究即基于此方面进行探索。胚胎干细胞具有全能性,利用鼠或人类的胚胎干细胞诱导生成配子来解决生殖障碍的设想早已引起研究者的极大兴趣[10]。干细胞既可在体外条件下向雄性生殖细胞分化,也能在体内的生精微环境中向精子分化[11]。近年来,干细胞曲细精管内移植的相关研究取得了令人瞩目的进展[12]。既往相关研究采用精原干细胞或其他来源干细胞移植的方法多报道采用显微注射的方法注射入睾丸网曲细精管内,有采用输精管注射的方法。有研究将外源基因注射到曲细精管中[13],或将外源基因注入到睾丸组织,结合电穿孔[14],通过转染精子干细胞使成熟精子中携带有外源基因从而制备转基因动物。国内已有研究证实[15]直接睾丸内多点注射的可行性与成功率,其注射方法更简单,并且转染时间更长,相对于显微注射来说,避免了复杂及昂贵的显微手术器械及手术本身对睾丸的进一步损伤。本研究采用睾丸直接注射方法即是基于此理论。
在本研究中仅热处理1周后的大鼠附睾内穿刺仍可见到精子,且以畸形精子为主,精子的数目在其睾丸下降1周后增多且存在部分活力,结合病理改变,提示短期的睾丸热损伤是明显可逆的。当热作用时间延长至10、14、21至30 d时,附睾穿刺液中未能见到精子,提示超过10 d的热处理可能已经严重影响到睾丸的生精功能,与Furland等[16]的研究相符合。隐睾10及14 d的大鼠,在睾丸下降的早期,几乎所有的生精小管内均只残留支持细胞,提示存在生精细胞的继续坏死脱落。随着下降时间的延长,早期生精小管的直径、恢复生精细胞层数的生精小管比例及生精功能评分都有增加的趋势,但在下降的后期(2个月后),包括生精小管直径d、恢复的生精小管比例r及生精小管的Johnsen评分z在内的三项指标的均值较前1个月均明显下降。结合病理形态观察,发现晚期大部分生精小管明显萎缩变薄,而恢复生精细胞层数的生精小管直径则较前明显增宽,但生精细胞多数排列紊乱。提示后期仍未能恢复的生精小管最终走向萎缩,可能永久丧失生精功能。相对而言本研究相对更为确切的提示了睾丸损伤的不可逆性的时间段。
本研究中我们采用原位注射的方法,采用小鼠胚胎干细胞是因易于获得且此前已有成功异体移植研究报道,采用直接注射法到隐睾热损伤而造成生精功能受损的大鼠睾丸内一是此法方便易行,二是避免已行隐睾建模及二期下降的睾丸再行显微注射造成的进一步损伤干扰,而使胚胎干细胞直接处于睾丸的局部微环境之中[17]。且胚胎干细胞拥有明显低于一般体细胞的免疫原性,而睾丸组织又是机体的免疫豁免器官,对植入的异体组织基本不会发生排斥反应[18]。本研究的结果提示ES组与NPBS组在生精小管的Johnsen评分上存在统计学差异(P<0.05),但其余各组及各指标无统计学差异,生精小管内未见小鼠的精子细胞。胚胎干细胞在睾丸微环境内能否定植分化形成精原干细胞在本研究时间段中尚未能得到证实,可能存在如原位注射未到位、热损伤睾丸局部微环境等多种影响干扰。但是利用胚胎干细胞的全能性来原位替代治疗受损组织细胞已成功报道应用于心肌组织,我们认为虽然本研究的前期结果未显示出明显的阳性及预期结果,但此研究方向和方法仍具有极高的可行性及成功可能,针对前期实验中发现的不足的相关研究目前我们仍在进行中。
[1]Virtanen HE,Toppari J.Epidemiology and pathogenesis of cryptorchidism[J].Hum Reprod Update,2008,14(1):49-58.
[2]Liu Y,Li X.Molecular basis of cryptorchidism-induced infertility[J].Sci China Life Sci,2010,53(11):1274-1283.
[3]Miller K,Coughlin M,Lee P.Fertility after unilateral cryptorchidism.Paternity,time to conception,pretreatment testicular location and sixe,hormone and sperm parameters[J].Horm Res,2001,55(5):249-253.
[4]王嘉悦,吴嫣爽,单智焱,等.曲细精管内移植多能干细胞的研究[J].生殖与避孕,2012,33(12):849-853.
[5]张 凯,王望九,刘向国,等.睾丸组织块和精原干细胞异种移植的发展及现状[J].生物学杂志,2012,29(2):81-83.
[6]Clouthier DE,Avarbock MR,Maika SD,et al.Rat spermatogenesis in mouse testis[J].Nature,1996,381(6581):418-421.
[7]Hermann BP,Sukhwani M,Winkler F,et al.Spermatogonial stem cell transplantation into rhesus testes regenerates spermatogenesis producing functional sperm[J].Stem Cell,2012,11(5):715-726.
[8]Sato Y,Nozawa S,YoshiikeM,et al.Xenografting of testicular tissue from an infant human donor results in accelerated maturation[J].Hun Reprod,2010,25(5):1113-1122.
[9]蒙艳斌,贺莉萍,钱海燕,等.胚胎干细胞梗死区中心和周边移植治疗急性心肌梗死[J].中国组织工程研究与临床康复,2009,13(23):4543-4547.
[10]Clark AT,Bodnar MS,Fox M,et al.Spontaneous differentiation of germ cells from human embryonic stem cells in vitro[J].Hum Mol Genet,2004,13(7):727-739.
[11]王 雪,陈 方,周君梅.ES细胞和iPS细胞体外向雄性生殖细胞分化的研究进展及其对研究隐睾性不育的意义[J].中华小儿外科杂志,2012,33(3):226-229.
[12]Hayashi K,Ohta H,Kurimoto K,et al.Reconstitution of themouse germ cell specification pathway in culture by pluripo-tent stem cells[J].Cell,2011,146(4):519-532.
[13]Yamazaki Y,Yagi T,Ozaki,et al.In vivo gene transfer to mouse spermatogenic cells using green fluorescent protein as a marker[J].J Exp Zool,2000,286(2):212-218.
[14]Chan PJ.Sperm-mediated DNA transfer to cells of the uterus and embryo[J].Mol Reprod Dev,2000,56(Suppl 2):316-318.
[15]李副兵.睾丸内注射精子载体法介导基因转移实验研究[D].重庆:第三军医大学,2006.
[16]Furland NE,Maldonado EN,Aresti PA,et al.Changes in lipids containing long-and very long-chain polyunsaturated fatty acids in cryptorchid rat testes[J].Biol Reprod,2007,77(1):181-188.
[17]李玲玲,刘 洋,金 波.精原干细胞微环境的生物学特性[J].中华男科学杂志,2012,18(4):359-363.
[18]Streilein JW.Unraveling immune privilege[J].Science,1995,270(5239):1158-1159.
