Nkx2.5在妊娠期糖尿病胎鼠心脏发育中的表达及意义
2015-01-08李伟群柳国胜韩莎莎宋莉莉强瑞雪
李伟群 柳国胜 韩莎莎 宋莉莉 强瑞雪
(广州开发区医院儿科,广东广州510730)
妊娠期糖尿病(gestational diabetes mellitus,GDM)是指妊娠后才发生或首次发现的糖尿病[1]。其不仅对母亲的身体有危害,而且对胎儿也有许多不良的影响,尤其是与心脏发育异常密切相关[2],且即便其血糖纠正后,其致心脏发育异常的影响依然存在[3]。目前为止,妊娠期糖尿病如何导致胎儿先天性心脏病的机制还不明确。Nkx2.5是所有脊椎动物心脏发生中最早表达的转录因子,也是心脏前体细胞最早的标志物。有报道认为Nkx2.5参与了妊娠期糖尿病母亲所生先天性心脏病患儿的发病过程[4]。因此本研究通过药物诱导建立妊娠期糖尿病大鼠模型,采用免疫组织化学和实时荧光定量PCR检测妊娠期糖尿病胎鼠心脏Nkx2.5蛋白和mRNA的表达,以此了解其是否参与了妊娠期糖尿病胎鼠心脏发育异常的发病过程,从而为阐述妊娠期糖尿病胎鼠心脏发育异常机制提供新的线索。
1 材料与方法
1.1 材料
健康成年雌性SD大鼠(体质量230~290 g)80只,购于广东省实验动物中心。STZ(美国Sigma公司),血糖检测用美国强生公司生产的卓越型血糖仪和试纸。光学显微镜及成像系统(日本Olympas光学工业株式会社)。兔抗大鼠Nkx2.5多克隆抗体购自美国Bioworld Technology公司。S-P免疫组化染色试剂盒购自福建迈新生物技术有限公司。实时荧光定量 PCR用的 SYBR®Premix Ex TaqTM购自Invitrogen公司。定量PCR仪:美国BIO-RAD荧光定量PCR仪CFX96。
1.2 方法
1.2.1 动物分组及造模 80只SD雌鼠按数字表随机分为对照组及实验组(GDM组),各40只。将各组雌鼠按照雄雌比例为1∶3分别与成年雄鼠合笼过夜,次晨取阴道分泌物涂在玻片上镜检,发现精子者记为妊娠第0天,标记孕鼠计算孕期,并隔离喂养。本妊娠期糖尿病大鼠的动物模型是参照国内文献(柳国胜等[5])报道的实验模型方法建立的。GDM组腹腔注射STZ 40 mg/kg(溶于现配的0.1 mol/L,pH 4.4的柠檬酸-柠檬酸钠缓冲液),对照组注射等量的柠檬酸-柠檬酸钠缓冲液。72 h后经尾静脉采血测血糖,血糖≥8.12 mmol/L者,纳入实验组。意外死亡和建模失败者共有4只,对照组40只,血糖正常。各组于孕12、孕15、孕19 d随机分组分批剖宫,取胎鼠心脏组织,置于4%甲醛溶液中固定后,脱水,石蜡包埋,常规切片,供免疫组化分析,HE染色。
1.2.2 免疫组化测定 切片脱蜡后,置入0.01 mmol/L柠檬酸钠抗原修复液中进行组织抗原修复。加过氧化酶阻断剂阻断内源性过氧化物酶的活性,加兔抗鼠Nkx2.5抗体,苏木素复染,脱水后中性树胶封片,显微镜拍照,图像分析。
1.2.3 mRNA检测 采用实时荧光定量PCR法,以β-actin为内参照,检测胎鼠心脏组织中 Nkx2.5 mRNA的表达。Trizol法提取胎鼠心脏组织RNA,逆转录为cDNA,取2μL进行PCR反应。内参片段为 β-actin,片段长度 200bp;目的片段为 Nkx2.5,片段 长 度 176bp。 设 计 的 引 物:Nkx2.5-F1:5′-GCCAACAGCAACTTCGTGA-3′;Nkx2.5-R1:5′-GAGTCATCGCCCTTCTCCTA-3′。预变性,变性,退火,延伸,共40个循环,熔解曲线分析。
1.3 统计学分析
采用SPSS13.0统计软件处理相关数据。计量资料数值以¯x±s表示,组内差别用单因素方差分析,组间差别比较采用LSD-t检验,P<0.05认为差异有统计学意义。
2 结果
2.1 两组雌鼠喂养期间体重及血糖变化情况
建模初SD母鼠数量为80只,GDM组意外死亡和建模失败者共有4只,符合条件者实为76只。给药后第3天GDM组母鼠血糖明显高于对照组母鼠血糖,P<0.01。GDM组母鼠体质量与对照组相比,两组体质量差异有统计学意义,P<0.01,见表1。
表1 母鼠血糖、体重情况比较(±s)

表1 母鼠血糖、体重情况比较(±s)
注:与同一时间点对照组比较,*P<0.01。
组别(n) 血糖(mmol/L) 体质量(g)GDM 组 12 d(36) 13.94±0.66* 310.6±6.8*GDM 组 15 d(25) 13.54±0.55* 322.2±5.9*GDM 组 19 d(13) 12.70±0.39* 344.8±5.4*对照组 12 d(40) 3.83±0.53 319.8±5.6对照组 15 d(24) 3.85±0.66 333.4±6.5对照组 19 d(11) 3.71±0.37 362.3±4.5
2.2 胎鼠心脏发育总体情况观察
GDM组母鼠各孕龄胚胎均出现不同程度的心脏畸形,畸形表现为左心室流出道梗阻、动脉单干、室间隔缺损、室间隔裂、心肌壁肥厚及心腔扩大等。对照组母鼠仅在孕19 d发现1例心肌肥厚。GDM组母鼠胚胎心脏畸形率显著高于对照组母鼠(χ2=14.75,P<0.01),见表 2。

表2 胎鼠心脏畸形例数比较(n)
2.3 Nkx2.5蛋白在胎鼠心肌组织的表达
IPP 6.0图像彩色分析系统阳性细胞计数显示,高倍镜下(400×)阳性细胞表现为细胞核呈黄色或棕褐色,每一切片随机取3个视野,平均值作为Nkx2.5蛋白表达的平均灰度值:对照组及GDM组Nkx2.5蛋白的表达均随胎龄的增长而呈上升趋势,GDM组Nkx2.5蛋白的表达孕12 d至孕15 d上升幅度较大,见图1。对照组孕19 d较孕12 d或孕15 d表达明显升高,GDM组孕15 d或孕19 d较孕12 d明显升高,差异有统计学意义,P<0.05(见图2)。而在同一孕期,GDM组Nkx2.5蛋白的表达强度相对对照组显著减少,差异有统计学意义,P<0.05(见图3)。
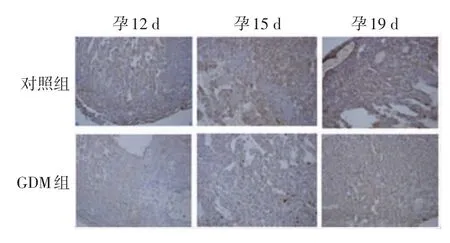
图1 胎鼠心脏组织中Nkx2.5表达情况(DAB染色,×200)

图2 两组胎鼠组内心肌组织Nkx2.5蛋白免疫组化半定量比较
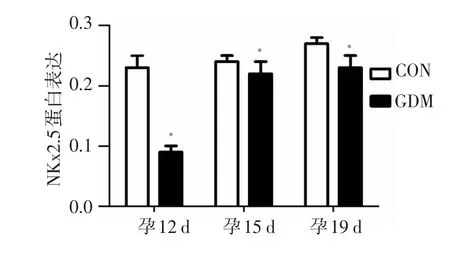
图3 两组胎鼠组间心肌组织Nkx2.5蛋白免疫组化半定量比较
2.4 Nkx2.5mRNA在胎鼠心肌组织的表达
GDM组与对照组中Nkx2.5mRNA在胎鼠心肌组织的表达均随孕期的延长呈增长的趋势。其中孕12 d及孕19 d GDM组Nkx2.5mRNA较对照组减少,差异有统计学意义(P<0.05)。孕 15 d GDM组Nkx2.5mRNA与对照组相比,差异无统计学意义(P>0.05),见图 5。

图4 Nkx2.5的扩增曲线和熔解曲线

图5 β-actin的扩增曲线和熔解曲线

图6 各组胎鼠心脏组织Nkx2.5mRNA表达情况比较
3 讨 论
妊娠期糖尿病是妊娠期一种常见而严重的并发症,其可引起自然流产、死产、巨大儿、胎儿宫内发育迟缓及先天发育畸形等。但其造成胎儿发育异常的机制尚未明确。高血糖可造成孕妇体内各种氧化物及代谢异常,胎儿发育过程中所需的某些转录因子或关键物质在此环境中发生质或量的改变,从而导致胎儿发育畸形。具体机制还未明确。最近伊朗学者Tabib[6]研究发现妊娠期糖尿病母亲所生胎儿,先天性心脏病的发病率高达8.8%,约是正常母亲胎儿的8倍。本实验GDM组各孕龄阶段均发现了不同程度的心脏畸形,其发生率达15.73%,远远高于对照组。
Nkx2.5是心脏同源域蛋白,它是最早发现的脊椎动物心脏发育的标志物,在心肌分化前即表达在心脏原始干细胞中,并持续到成年。它在心脏特异性基因表达方面有着重要的地位,也是心脏分化过程中不可缺少的,其参与了心脏发育形成及生后正常功能的维持。Nkx2.5突变或缺失可引起人类先天性心脏发育异常,包括房间隔缺损、室间隔缺损、法乐氏四联症、肺动脉闭锁、二尖瓣发育异常及心脏传导系统异常[7-8]。
本实验免疫组化结果显示,在孕12 d、孕15 d、孕19 d时,GDM组及对照组胎鼠心脏中均能检测到Nkx2.5的表达,且随着孕期的增长,其蛋白在两组中的表达量均呈上升的趋势,且表达的部位与唐娟等[9]对正常小鼠心脏发育过程中Nkx2.5的表达情况的研究相类似。表明在糖尿病胎鼠的心脏组织中Nkx2.5的表达亦呈现一个动态变化的过程。
本实验观察到实验组Nkx2.5蛋白及其mRNA的表达在孕12 d较对照组明显减少。对于小鼠来说,孕12 d是小鼠胚胎发育的早期,此时也是胎鼠心脏发育的关键时期,母鼠体内高血糖能通过胎盘进入胎鼠体内,造成胎鼠体内同样表现高血糖。此时的高糖状态可能改变了胎鼠体内的某些与心脏发育相关的因子 (如Nkx2.5)的功能或表达量,从而引起了心脏发育异常。已有研究证实敲除小鼠的Nkx2.5基因,小鼠因心脏发育障碍和生长迟缓而死亡[10]。有文献认为Nkx2.5基因表达量的减少会引起心脏传导细胞数的减少,从而引起心脏发育异常[11]。可见Nkx2.5基因表达的减少与心脏发育异常密切相关。本实验发现Nkx2.5蛋白及其mRNA在实验组表达在孕早期较对照组下降,同时也发现实验组胎儿心脏畸形的例数较对照组增多,符合以上文献的报道。因此我们推测Nkx2.5可能参与了妊娠期糖尿病致胎儿心脏发育异常的过程,且是通过表达下降来干预的。另外,本实验观察到实验组Nkx2.5mRNA的表达在孕15 d与对照组相比是增加的,而其同期蛋白的表达却比对照组下降,这并不矛盾,蛋白质的合成过程复杂且受多种因素调节,近年来研究发现,当DNA转录为mRNA后,还可能受到microRNA及长链非编码RNA等因子的转录后翻译水平的负调节。有研究报道,高糖状态下可引起某些 microRNA的表达增多[12],而 microRNA可与靶mRNA互补配对,导致mRNA的翻译抑制或降解,从而使蛋白质的表达下调[13-16]。因此,在妊娠期糖尿病致胚胎心脏畸形的过程中,心脏发育关键基因的表达是否还受microRNA的调节,还需进一步加以证实。
Nkx2.5在心脏发育中具有重要作用,但是心脏的发育过程受多个因子调控,这些因子相互作用,形成复杂的调控网络,Nkx2.5表达异常对心脏发育的致畸作用可能还依赖于其他的遗传或上位因素[17]。妊娠期糖尿病中,Nkx2.5具体通过何种方式参与胎儿心脏的异常发育,尚需要进一步的研究来证实。
[1]Magee MS,Walden CE,Benedetti TJ,et al.Influence of diagnostic criteria on the incidence of gestational diabetes and perinatal morbidity[J].JAMA,1993,269(5):609-615.
[2] Reece EA,Eriksson UJ.The pathogenesis of diabetesassociated congenital malformations[J].Obstet Gynecol Clin North Am,1996,23(1):29-45.
[3]Lisowski LA,Verheijen PM,De Smedt MM,et al.Altered fetal circulation in type-1 diabetic pregnancies [J].Ultrasound Obstet Gynecol,2003,21(4):365-369.
[4]Belmont JW,Mohapatra B,Towbin JA,et al.Molecular genetics of heterotaxy syndromes[J].Curr Opin Cardiol,2004,19(3):216-220.
[5]柳国胜,赵立华,刘海英,等.链脲霉素致大鼠妊娠糖尿病影响胎鼠发育的实验模型研究[J].中国新生儿科杂志,2008,23(1):26-29.
[6]Tabib A,Shirzad N,Sheikhbahaei,et al.Cardiac malformation in fetuses of gestational and pre gestational diabetic mothers[J].Iran JPediatr,2013,23(6):664-668.
[7]Reamon-Buettner SM,Hecker H,Spanel-Borowski K,et al.NovelNKX2-5 mutations in diseased heart tissues of patients with cardiac malformations[J] .Am J Pathol,2004,164(6):2117-2125.
[8]Dinesh SM,Kusuma L,Smitha R,et al.Single-muleotide polymorphisms of Nkx2.5 found in congenital heart disease patients of Mysore,South India [J].Genet Test Mol Biomarker,2010,14(6):873-879.
[9]唐 娟,刘 艳,杨 光,等.小鼠心脏发育的形态学研究[J].四川动物,2009,28(3):403-406.
[10] Tanaka M,Chen Z,Bartunkova S,et al.The cardiac homeobox gene Csx/Nkx2.5 lies genetically upstream of multiple genes essential for heart development[J].Development,1999,126(6):1269-1280.
[11]Jay PY,Harris BS,Maguire CY,et al.Nkx2-5 mutation causes anatomic hypoplasia of the cardiac conduction system[J].J Clin Invest,2004,113(8):1130-1137.
[12]Karolina DS,Armugam A,Tavintharan S,et al.MicroRNA 144 impairs insulin signaling by inhibiting the expression of insulin receptor substrate 1 in type 2 diabetes mellitus[J].PLOSOne,2011,6(8):e22839.
[13]McArthur K,Feng B,Wu Y,et al.MicroRNA-200b regulates vascular endothelial growth factor-mediated alterations in diabetic retinopathy [J].Diabetes,2011,60(4):1314-1323.
[14]Feng B,Chen S,McArthur K,et al.MiR-146a-mediated extracellular matrix protein production in chronic diabetes complications[J].Diabetes,2011,60(11):2975-2984.
[15]Schalkwijk CG,Stehouwer CD.Vascular complications in diabetes mellitus:the role of endothelial dysfunction [J].ClinSci(Lond),2005,109(2):143-159.
[16]Chen S,Apostolova MD,Cherian MG,et al.Interaction of endothelin-1 with vasoactive factors in mediating glucoseinduced increased permeability in endothelial cells[J].Lab Invest,2000,80(8):1311-1321.
[17]Benson DW,Martin LJ.Complex Story of the Genetic Origins of Pediatric Heart Disease[J].Circulation,2010,121(11):1313-1321.
