刺玫果果肉石油醚层化学成分及胰脂酶和α-糖苷酶抑制活性研究
2015-01-08李小第姜会敏霍雅玉张海龙
李小第,姜会敏,霍雅玉,高 阳,鲍 和,张海龙*
1西安交通大学医学部第二附属医院药剂科,西安 710004;2 西安交通大学医学部药学院,西安 710061
刺玫果是蔷薇科蔷薇属落叶灌木山刺玫Rosa davurica Pall.的干燥成熟果实,为深红色的球形或卵形,是一种经济价值极高的野生果类[1]。本品果实性温,味酸,药食同源,营养丰富,最早收载于《神农本草经》,用于治疗坏血病,我国历来将其作为民间药,大量采食或用于泡茶、泡酒等。《中药大辞典》谓其有健脾理气、养血调经的作用,用于治疗消化不良、气滞腹泻、胃痛、月经不调等。近年来国内外大量研究表明,该果实中含有黄酮类、三萜类、鞣质类等物质,具有抗衰老、抗疲劳、耐缺氧、防治心血管疾病、治疗慢性支气管炎等作用[2]。到目前为止,国内外对刺玫果的研究大多针对完整的果实,而没有将其种子和果肉分开进行研究。本文在前人研究的基础上,首次将刺玫果的种子和果肉进行了剥离,对刺玫果果肉石油醚层进行了分离,得到12 个化合物,经理化性质和波谱数据分析,鉴定为二十九烷(1)、α-生育酚(2)、邻苯二甲酸二乙酯(3)、邻苯二甲酸二丁酯(4)、β-谷甾醇(5)、α-香树脂醇(6)、乌苏醇(7)、白桦脂醇(8)、白桦脂酸(9)、19α-羟基乌苏酸(10)、胡萝卜苷(11)和麦芽糖(12)。其中,化合物1~3、6~7 和12 均首次从该植物中分离得到。活性测定结果表明,石油醚层对胰脂肪酶有一定的抑制活性,对酵母菌来源α-葡萄糖苷酶有较好的抑制活性而对大鼠小肠来源α-葡萄糖苷酶抑制活性较弱。
1 仪器与材料
1.1 仪器
SHB-Ⅲ循环水式多用真空泵(郑州长城科工贸有限公司);EYELAN-1100 旋转蒸发仪(上海爱朗仪器有限公司);Nicolet Avatar 330 傅里叶变换红外光谱仪(美国热电公司);Bruker Am-400 型核磁共振仪(美国布鲁克公司);酶标仪(上海珀金埃尔默仪器有限公司);GENIUS 16-K 低温离心机(新奥仪器公司);Mellter AE240 电子天平(中国梅特勒-托利多仪器厂);PHS-25 型数显pH 计(上海精密科学仪器有限公司)。
1.2 材料
柱层析用硅胶(青岛海洋化工厂);薄层层析用硅胶GF254(青岛海洋化工厂);Sephadex LH-20(GE Healthcare Bio-Sciences AB,Sweden);猪胰脂肪酶(porcine pancreatic lipase,type II,PPL)、4-甲基伞形酮油酸酯(4-MUO)、α-葡萄糖苷酶(S.cerevisiae,G0660-750U)及 4-硝 基 苯-α-D-吡喃葡萄糖苷(PNPG)均购自美国Sigma 公司;阿卡波糖(德国拜耳公司);正常雌性SD 大鼠,200~220 g,由西安交通大学医学部动物中心提供,动物合格证号:SCXK(陕)2012-003;其他试剂均为分析纯。药材于2011年8 月采自黑龙江省小兴安岭,经西安交通大学药学院王军宪教授鉴定为刺玫果(Rosa davurica Pall.)。
2 提取与分离
将3.2 kg 干燥果肉粉碎,用70%乙醇回流提取三次,每次3~4 h,合并提取液,回收溶剂,浓缩至无醇味,得到总提物浸膏290.2 g。将总浸膏用适量蒸馏水分散后用石油醚萃取得石油醚萃取部分22 g,将其与粗硅胶(100~200 目)按1∶1 干法拌样,湿法装柱,石油醚-乙酸乙酯体系梯度洗脱(200 ∶1,100∶1,50∶1,30∶1,20∶1,10∶1,8∶1,5∶1,3∶1,2∶1,1∶1,0∶1);等份收集,每份500 mL,共收集568 份,各流分通过TLC 检识合并,经过反复硅胶柱层析,Sephadex LH-20 分离,重结晶和制备薄层色谱等方法得到12 个单体化合物,分别是化合物1(8 mg)、2(20 mg)、3(200 mg)、4(30 mg)、5(300 mg)、6(10 mg)、7(5 mg)、8(10 mg)、9(12 mg)、10(9 mg)、11(60 mg)、12(80 mg)。
3 结构鉴定
化合物1 C29H60,白色粉末,mp.63~64 ℃,易溶于氯仿,10%硫酸乙醇显淡红色。EI-MS (m/z):338,295,281,267,253,239,225,183,169,127,113,99,85,71,57;1H NMR (400 MHz,CDCl3)δ ppm:0.88(6H,t,2 ×CH3),1.25(54H,brs,27 ×CH2);13C NMR (100 MHz,CDCl3)δ ppm:31.9(C-3,27),29.7(C-4~26),22.7(C-2,28),14.1(C-1,29)。其氢谱、碳谱数据与文献中二十九烷(Nonacosane)数据[3]基本一致,故该化合物被鉴定为二十九烷。
化合物2 C29H50O2,淡黄色油状物,mp.430~431 ℃,易溶于氯仿,10% 硫酸乙醇显黄绿色。1H NMR (400 MHz,CDCl3)δ:4.21(1H,s,6-OH),2.60(2H,t,J=6.6 Hz,H-4),2.16(3H,s,5-CH3),2.11(6H,s,7,8-CH3),1.78(2H,m,H-3),1.23(3H,s,2'-CH3),0.86(12H,m,4',8',12',13-CH3);13C NMR(100 MHz,CDCl3)δ:145.7(C-9),144.7(C-6),122.7(C-8),121.2(C-7),118.6(C-5),117.5(C-10),74.7(C-2),39.9(C-1'),39.5(C-11'),37.6(C-3'),37.5(C-5',7'),437.(C-9'),32.9(C-4'),32.8(C-8'),31.7(C-3),28.1(C-12'),25.0(C-10'),24.6(C-6'),23.9(2-CH3),22.9(12'-CH3),22.8(C-13'),21.2(C-2'),20.9(C-4),19.9(4'-CH3),19.8(8'-CH3),12.4(7-CH3),11.9(8-CH3),11.4(5-CH3)。其氢谱、碳谱数据与文献中α-生育酚(α-tocopherol)数据[4]基本一致,故该化合物被鉴定为α-生育酚。
化合物3 C12H14O4,白色粉末,易溶于氯仿,10%硫酸乙醇显淡红色。IR (KBr)νmax(cm-1)2951(υasCH3),2850(υsCH3),1697(C=O),1429(δasCH3),1294,1188(C-O-C),1463,687(C=C),721。EI-MS (m/z)中结合222,207,177,149,76 等碎片离子峰,经EI-MS 中的NIST 谱图库检索,其分子式为C12H14O4,分子量为222,与邻苯二甲酸二乙酯的质谱裂解高度一致。1H NMR (400 MHz,CDCl3)δ:7.74 (2 H,dd,J=10.1,2.2 Hz,H-3,6),7.54 (2 H,dd,J=10.1,2.2 Hz,H-4,5),4.38 (4 H,q,J=6.1 Hz,H-2',2″),1.38 (6H,t,J=8.2 Hz,H-3',3″);13C NMR (100 MHz,CDCl3)δ:162.4 (C-1'),127.0 (C-1,2),125.7 (C-3,6),123.6 (C-4,5),56.4 (C-2',2''),8.9 (C-3',3'')。与文献[5]中的核磁数据一致,故鉴定该化合物为邻苯二甲酸二乙酯(diethyl pthalate)。
化合物4 C16H22O4,白色粉末,易溶于氯仿,10%硫酸乙醇显红色。1H NMR (400 MHz,CDCl3)δ:7.72(2H,m,H-3,6),7.53(2H,m,H-4,5),4.31(4H,t,J=6.7 Hz,H-2',2″),1.72(4H,q,H-3',3″),1.44(4H,sext,H-4',4″),0.96(6H,t,J=7.4 Hz,H-5',5″);13C NMR (100 MHz,CDCl3)δ:167.7(C-1',1″),132.3(C-1,2),130.9(C-3,6),128.8(C-4,5),65.5(C-2',2″),30.6(C-3',3″),19.2(C-4',4″),13.7(C-5',5″)。其氢谱、碳谱数据与文献中邻苯二甲酸二丁酯(dibutyl pthalate)数据[6]一致,故该化合物被鉴定为邻苯二甲酸二丁酯。
化合物5 C29H50O,白色针状结晶(丙酮),mp.430~431 ℃,易溶于氯仿,10%硫酸乙醇显紫红色。样品与β-谷甾醇对照品共薄层,用石油醚∶乙酸乙酯=2∶1、石油醚∶丙酮=3∶1、氯仿∶乙酸乙酯=5∶1 展开,用10%硫酸乙醇、5%磷钼酸及碘显色,其Rf值及显色行为均一致。因此,确定该化合物为β-谷甾醇(β-sitosterol)。
化合物6 C30H50O,白色粉末,mp.185~187℃,易溶于氯仿,10%硫酸乙醇显紫红色。1H NMR(400 MHz,CDCl3)δ:5.15(1H,t,J=3.6 Hz,H-12),3.23(1H,dd,J=10.8,5.1 Hz,H-3),1.05,1.00,0.95,0.91,0.87,0.86,0.81,0.79(each 3H,s,23~30);13C NMR(100 MHz,CDCl3)δ:38.8(C-1),27.3(C-2),79.1(C-3),38.7(C-4),53.1(C-5),18.4(C-6),32.3(C-7),40.0(C-8),47.7(C-9),37.7(C-10),23.2(C-11),123.4(C-12),140.9(C-13),42.9(C-14),29.1 (C-15),25.3(C-16),33.5(C-17),55.2(C-18),39.3(C-19),37.0(C-20),31.2(C-21),41.3(C-22),28.2(C-23),15.5(C-24),15.7(C-25),17.1(C-26),23.7(C-27),28.2(C-28),17.7(C-29),21.2 (C-30)。其氢谱、碳谱数据与文献中α-香树脂醇(α-amyrin)数据[7]基本一致,故该化合物被鉴定为α-香树脂醇。
化合物7 C30H50O2,白色粉末,易溶于氯仿,10%硫酸乙醇显蓝色。1H NMR (400 MHz,CDCl3)δ:5.14(1H,t,J=3.3,H-12),3.51(1H,d,J=10.3 Hz,H-28a),3.19(2H,m,H-3a,28b),1.10,1.00,0.99,0.95,0.79(each 3H,d,J=7.0 Hz,H-23~27),0.93(3H,d,J=7.0 Hz,H-29),0.82(3H,d,J=6.0 Hz,H-30);13C NMR (100 MHz,CDCl3)δ:38.8(C-1),26.0(C-2),79.0(C-3),38.0(C-4),55.1(C-5),18.3(C-6),32.8(C-7),38.8 (C-8),47.8(C-9),36.9(C-10),23.3(C-11),125.0(C-12),138.7(C-13),40.0(C-14),27.2(C-15),23.4(C-16),42.0(C-17),54.0(C-18),39.4(C-19),39.3(C-20),30.6(C-21),35.2(C-22),28.1(C-23),15.6(C-24),15.7(C-25),16.8(C-26),23.3(C-27),69.9(C-28),17.3(C-29),21.3(C-30)。其氢谱、碳谱数据与文献中乌苏醇(uvaol)数据[8]一致,故该化合物被鉴定为乌苏醇。
化合物8 C30H50O2,白色粉末,mp.256~257℃,易溶于氯仿,10%硫酸乙醇显紫红色。1H NMR(400 MHz,CDCl3)δ:4.68(1H,d,J=1.8 Hz,H-29a),4.58(1H,s,H-29b),3.80(1H,d,J=10.8 Hz,H-28a),3.33(1H,d,J=10.8 Hz,H-28b),3.20(1H,dd,J=10.8,4.7 Hz,H-3),2.38(1H,m,H-19),1.68(3H,s,H-30),1.02(3H,s,H-27),0.98(3H,s,H-26),0.97(3H,s,H-23),0.82(3H,s,H-25),0.76 (3H,s,H-24);13C NMR (100 MHz,CDCl3)δ:40.9(C-1),50.4(C-2),79.0(C-3),38.9(C-4),55.3(C-5),18.3(C-6),34.2(C-7),40.9(C-8),50.4(C-9),37.3(C-10),20.8(C-11),25.2(C-12),37.1(C-13),42.7(C-14),27.0(C-15),29.1(C-16),47.8(C-17),47.6(C-18),48.7(C-19),150.5(C-20),29.7(C-21),34.0(C-22),28.0(C-23),15.4(C-24),16.0(C-25),16.1(C-26),14.8(C-27),60.5(C-28),109.7(C-29),19.1(C-30)。其氢谱、碳谱数据与文献中白桦脂醇(betulin)数据[9]一致,故该化合物被鉴定为白桦脂醇。
化合物9 C30H48O3,白色粉末,mp.295~298℃,微溶于甲醇、乙醇、丙酮,易溶于吡啶,10%硫酸乙醇显紫红色。1H NMR (400 MHz,CDCl3)δ:4.74(1H,s,H-29a),4.61(1H,s,H-29b),3.19(1H,m,H-3),3.00(1H,brs,H-19),1.69,0.97,0.97,0.93,0.82,0.75(each 3H,s,6 × CH3);13C NMR (100 MHz,CDCl3)δ:38.7(C-1),27.4(C-2),79.0(C-3),38.9(C-4),55.3(C-5),18.3(C-6),34.3(C-7),40.7(C-8),50.5(C-9),37.2(C-10),20.8(C-11),25.5(C-12),38.4(C-13),42.4(C-14),30.5(C-15),32.1(C-16),56.3(C-17),46.9(C-18),49.2(C-19),150.4(C-20),29.7(C-21),37.0(C-22),28.0(C-23),15.3(C-24),16.0(C-25),16.1(C-26),14.7(C-27),180.5(C-28),109.7(C-29),19.4(C-30)。其氢谱、碳谱数据与文献中白桦脂酸(betulic acid)数据[10]一致,故该化合物被鉴定为白桦脂酸。
化合物10 C30H48O4,白色粉末,10%硫酸乙醇显紫红色。1H NMR (400 MHz,DMSO-d6)δ:11.83(1H,s,COOH),5.16(1H,s,H-12),3.00(1H,m,H-3),2.36 (1H,s,H-18),1.29,1.07,0.90,0.85,0.83,0.70,0.68(each 3H,s,7 × CH3);13C NMR(100 MHz,DMSO-d6)δ:38.2(C-1),27.0(C-2),76.9(C-3),38.4(C-4),54.9(C-5),18.2(C-6),32.7(C-7),39.3(C-8),46.7(C-9),36.6(C-10),23.2(C-11),126.9(C-12),138.6(C-13),41.1(C-14),28.3(C-15),25.2(C-16),46.9(C-17),53.2(C-18),71.6(C-19),41.4(C-20),26.4(C-21),37.3(C-22),28.1(C-23),16.4(C-24),15.2(C-25),16.6(C-26),24.0(C-27),179.0 (C-28),26.0(C-29),16.1(C-30)。其氢谱、碳谱数据与文献中19α-羟基乌苏酸(19α-hydroxyursolic acid)数据[11]一致,故该化合物被鉴定为19α-羟基乌苏酸。
化合物11 C35H60O6,白色粉末,10%硫酸乙醇显紫红色。样品与胡萝卜苷对照品共薄层,用氯仿∶甲醇=9∶1、氯仿∶乙酸乙酯=1∶1、石油醚∶丙酮=1∶1 展开,用10%硫酸乙醇、5%磷钼酸及碘显色,其Rf值及显色行为均一致。因此,确定该化合物为胡萝卜苷(daucosterol)。
化合物12 麦芽糖,无色针晶(氯仿-甲醇),易溶于水。1H NMR (400 MHz,CD3OD)δ:5.09(1H,d,J=3.4 Hz,H-1),4.46 (1H,d,J=7.8 Hz,H-1');13C NMR (100 MHz,CD3OD)δ:98.2(C-1'),93.9(C-1),78.1(C-5),78.0(C-4),76.2 (C-3),74.8 (C-3'),73.8(C-2'),72.9 (C-2),71.8 (C-5'),71.7(C-4'),62.8(C-6),62.7(C-6')。多种条件下与麦芽糖标准品共薄层Rf值一致,数据与文献[12]报道基本一致,故鉴定该化合物为麦芽糖(maltose)。
4 活性测定
4.1 胰脂肪酶抑制活性测定
胰脂肪酶活性中心与4-甲基伞形酮油酸酯(4-MUO)可发生不可逆结合,并释放出4-甲基伞形酮(4-MU)。4-MU 是一种香豆素,即7-羟基-4-甲基香豆素,具有荧光,在37 ℃下进行荧光测定,激发波长和吸收波长分别为320、450 nm,通过测定样品加入前后荧光的变化,判断样品对胰脂肪酶活性的影响[13]。
分别取25 μL 样品液及25 μL PBS 溶液(空白)于96 孔板中,加入25 μL 胰脂酶溶液,室温下孵育15 min 后加入50 μL 4-MUO 溶液,孵育20 min,分别测定0、20 min 时的荧光值,每个样品3 个重复,取其平均值[14],奥利司他为阳性对照。样品对胰脂肪酶的抑制率,其计算公式如下:

式中:Fb0、Fb20为空白在0、20 min 的荧光值;Fs0、Fs20为样品在0、20 min 的荧光值。
测定结果显示,阳性药奥利司他IC50=0.08 μg/mL,刺玫果果肉石油醚层IC50=32.7 μg/mL。其中,刺玫果果肉石油醚层在9.375、18.75、37.5、75、150 μg/mL 浓度时的抑制率分别为:18.9%、44.3%、68.6%、82.8%和92.1%,在300 μg/mL 浓度时的抑制率达到98.4%,浓度继续增加,抑制率不再明显变化。
4.2 α-葡萄糖苷酶抑制活性测定
4-硝基苯-α-D-吡喃葡萄糖苷(PNPG)在α-葡萄糖苷酶作用下发生α-糖苷键水解,产生对硝基苯酚,后者在405 nm 处有最大吸光度。通过测定样品加入前后吸光度的变化,判断样品对α-葡萄糖苷酶活性的影响[15]。吸光度值越大,说明生成的对硝基苯酚越多,抑制作用越弱;相反,吸光度值越小,则说明抑制活性越强。
分别取100 μL 样品液及100 μL PBS 溶液(空白)于96 孔板中,加入25 μL 酵母菌来源的α-葡萄糖苷酶,37 ℃下孵育15 min 后加入25 μL 2.5 mmol/L PNPG 溶液;同法取180 μL 样品溶液及180 μL PBS 溶液(空白)于96 孔板中,加入10 μL 大鼠小肠来源的α-葡萄糖苷酶,37 ℃下孵育15 min 后加入20 μL 2.5 mmol/L PNPG 溶液,37 ℃下孵育15 min。在405 nm 处分别测定0、15 min 时的吸光度。每个样品3 个重复,取其平均值[16-18]。样品对α-葡萄糖苷酶的抑制率,其计算公式如下:
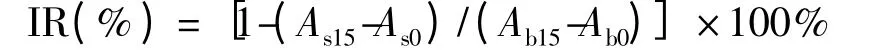
式中:Ab0、Ab15为空白在0、15 min 的吸光度值;As0、As15为样品在0、15 min 的吸光度值。
测定结果如下:对酵母菌来源α-葡萄糖苷酶的抑制活性,阳性药阿卡波糖IC50=716.7 μg/mL,果肉石油醚部分IC50=14.7 μg/mL,其中,果肉石油醚层的浓度为12.5、25、50、100 μg/mL 时对酵母菌来源的α-葡萄糖苷酶的抑制率分别为15.6%、58.6%、82.4%、90.8%,浓度继续增加,抑制率并未见明显提高。对大鼠小肠来源α-葡萄糖苷酶的抑制活性,阳性药阿卡波糖IC50=25.3 μg/mL,果肉石油醚部分的抑制活性由于未达到50%而无法求出其IC50值,其中,在250 μg/mL 浓度时的抑制率为23.4%,在1000 μg/mL 浓度时的抑制率为34.8%。
5 结论与展望
从刺玫果果肉石油醚层中分离得到的12 个化合物中,化合物1~3、6~7 和12 为首次从该植物中分离得到。活性研究结果表明,刺玫果果肉石油醚层对胰脂酶具有一定的抑制活性,对酵母来源的α-葡萄糖苷酶具有较强的抑制作用,远远强于阳性对照药阿卡波糖,但对大鼠小肠来源α-葡萄糖苷酶抑制活性较弱。从上述体外活性研究结果可以推测,刺玫果果肉可能具有降脂和降糖的作用,但在动物体内的降糖和降脂作用有待于进一步研究。同时,对胰脂酶和酵母来源的α-葡萄糖苷酶抑制作用的活性成分也需随着研究的深入而进一步确定。
1 Zhong FL(钟方丽),Wang XL(王晓林),Zhang N(张娜).Study on extraction process of total saponins from the fruit of Rose davurica Pall.J Anhui Agric Sci (安徽农业科学),2011,39:1387-1389.
2 Feng SS(冯杉杉),Jin ZX(金哲雄).Research progress of fructus rosae davuricae.Heilongjiang Med J(黑龙江医药),2014,27:785-787.
3 Wang QZ,Liang JY.Studies on the chemical constituents of Evodia rutaecarpa (Juss.)Benth.Acta Pharm Sin,2004,39:605-608.
4 Kitajima J,Kimizuka K,Arai M,et al.Constituents of Ficus pumila leaves.Chem Pharm Bull,1998,46:1647-1649.
5 Gaikwad S,Devare S,Kale A,et al.Isolation and characterization of a diethyl phthalate an bioactive compound from Cassia auriculata L.Int J Pharm Sci Rev Res,2013,19:56-57.
6 Wang DM,Pu WJ,Wang YH,et al.A new isorhamnetin glycoside and other phenolic compounds from Callianthemum taipaicum.Molecules,2012,17:4595-4603.
7 Mahato SB,Kundu AP.Review article number 98:13C NMR spectra of pentacyclic triterpenoids-a compilation and some salient features.Phytochemistry,1994,37:1517-1575.
8 Zhang JY,Li N,Hu K,et al.Chemical constituents from processed seeds of Strychnos nux-vomica.J Chin Pharm Sci,2012,21:187-191.
9 Wang YH(王映红),Han YL(韩景兰),Wang P(王鹏),et al.Study on the chemical constituents of the stem and leaves of Osmanthus fordii Hems.Chin J Pharm Anal (药物分析杂志),2008,28:386-389.
10 Khaliq S,Volk FJ,Frahm AW.Phytochemical investigation of Perovskia abrotanoides.Planta Med,2007,73:77-83.
11 Li QW,Hui J,Shang DJ,et al.Investigation of the chemical constituents of the roots of Potentilla anserina L.in Tibet.Chin Pharm J,2003,55:179-184.
12 Zhang DS(张冬松),Huang SW(黄顺旺),Gao HY(高慧媛),et al.Isolation and identification of chemical constituents from Castanea mollissima Blume.J Shenyang Pharm Univ (沈阳药科大学学报),2008,25:454-456.
13 Platel K,Srinivasan K.Influence of dietary spices and their active principles on pancreatic digestive enzymes in albino rats.Nahrung,2000,44:42-46.
14 Sugiyama H,Akazome Y,Shoji T,et al.Oligomeric procyanidins in apple polyphenol are main active components for inhibition of pancreatic lipase and triglyceride absorption.J Agric Food Chem,2007,55:4604-4609.
15 Chaudhary V,Small DM,Kasapis S.Effect of a glassy gellan/polydextrose matrix on the activity of α-D-glucosidase.Carbohyd Polym,2013,95:389-396.
16 Oki T,Matsui T,Osajima Y.Inhibitory effect of α-glucosidase inhibitors varies according to its origin.J Agric Food Chem,1999,47:550-553.
17 Shinde J,Taldone T,Barletta M,et al.α-Glucosidase inhibitory activity of Syzygium cumini (Linn.)Skeels seed kernel in vitro and in Goto-Kakizaki (GK)rats.Carbohydr Res,2008,343:1278-1281.
18 Kim YM,Wang MH,Rhee HI.A novel α-glucosidase inhibitor from pine bark.Carbohyd Res,2004,339:715-717.
