基于人呼吸道上皮细胞炎症模型的连翘提取物抗炎活性实验研究
2015-01-08刘建洲张立伟
刘建洲,张立伟
山西大学分子科学研究所,太原 030006
连翘[Forsythia suspensa (Thunb.)Vahl.]始载于《神农本草经》,是传统常用中药,味苦,微寒,归肺、心、小肠经。连翘具有清热解毒、消肿散结、疏散风热等功效[1],临床中广泛用于对呼吸系统炎症、发热等病症的治疗[2]。
呼吸道上皮是病原体入侵呼吸系统的首要组织防线,在先天免疫系统中具有重要的作用。急性肺损伤是一种以炎症和肺毛细血管通透性增加为特征的临床综合征[3],此时,呼吸道上皮细胞能够产生细胞因子、趋化因子及抗菌肽等免疫因子参与炎性反应[4]。革兰氏阴性杆菌产生的脂多糖(LPS)是导致肺损伤的首要原因[5]。以LPS 为诱导剂介导的细胞炎症模型已经有相当多的报道,但大多采用巨噬细胞为载体模型[6-9]。根据中医用药习惯,连翘针对人上焦肺系统等疾病的治疗有较好的效果,因此,本文以呼吸道上皮细胞为研究对象将更有针对性。由于NO 是介导炎症反应的关键因子,在内毒素致机体损伤中起到重要作用[10],动物模型和人体研究[11]都表明,过多的活性氧(ROS)产生可导致呼吸气道炎症、高反应性、微血管渗透性过高、组织损伤与重塑等,因此,本文以NO、ROS 为检测指标,建立人呼吸道上皮细胞(BEAS-2B)炎症细胞模型,筛选连翘提取物抗炎活性部位,寻找可能的抗炎成分,为连翘抗炎活性的进一步研究提供基础。
1 材料与方法
1.1 材料
1.1.1 药材
连翘(青翘),2012 年8 月采于山西省安泽县杜村乡东唐村南山,蒸制后晾干储存,经鉴定为青翘果实。
1.1.2 细胞
BEAS-2B 购自通派(上海)生物科技有限公司。该细胞株是由正常人支气管上皮细胞NHBE 细胞感染腺病毒12-SV40 杂交病毒,连续传代筛选而永生化得到。它具有正常人呼吸道上皮细胞的形态和功能,保持上皮细胞的超微结构特征,染色体核型为近二倍体,在传代过程中保持稳定,该细胞株是体外研究支气管上皮细胞功能的理想模型[12]。
1.1.3 试剂
改良型RPMI-1640 培养基(HyClone),胎牛血清(FBS,Gibco 公司),胰蛋白酶(0.25%,北京全式金生物技术有限公司),青霉素链霉素混合液(100×,Biotopped 公司),脂多糖(LPS,Sigma 公司),四甲基偶氮唑蓝(MTT,Biotopped 公司),NO 检测试剂盒(碧云天生物技术研究所),活性氧(ROS)检测试剂盒(碧云天生物技术研究所),地塞米松(Dex)与吲哚美辛(Indo)均购自中国食品药品检定研究院,二甲基亚砜(DMSO,天津市富宇精细化工有限公司),其余试剂均为国产分析纯试剂。
1.1.4 仪器
OHAUS CP114 电子天平(奥豪斯仪器有限公司),TGL-16 冷冻离心机(湖南湘仪),冷冻干燥机(宁波新芝生物科技有限公司),Spectra Max 190 酶标仪(美国Molecular Devices 公司),Galaxy 170S CO2培养箱(New Brunswick 公司),FACSCalibur 流式细胞仪(美国BD 公司)。
1.2 连翘不同提取物(FSE)的制备
1.2.1 连翘乙醇提取物(FSEE)
将青翘粉碎过50 目筛,称取10 g 粉末,按料液比1∶10 加40%乙醇100 mL,90 ℃水浴加热回流3 h,趁热过滤,滤渣再加100 mL 40%乙醇,再次90 ℃水浴加热回流1 h,趁热过滤,合并两次滤液,于旋转蒸发仪上浓缩至无醇味,冻干,避光密封于干燥器中备用。
1.2.2 60%、90%连翘酯苷A(FTA)
将按1.2.1 法制得的连翘提取液湿法装柱,以聚酰胺为柱材料,经中压制备色谱制得含60% FTA的连翘提取物;将该产物进一步分离,以MDS-5 为柱材料,经中压制备色谱制得含93.60% FTA 的连翘提取物[13]。
1.3 细胞培养
用含10% FBS 的RPMI-1640 培养基(含青霉素100 U/mL,链霉素100 μg/mL)于37 ℃、5% CO2培养箱中培养,以0.25%的胰蛋白酶消化细胞传代,取对数生长期细胞用于实验。
1.4 BEAS-2B 细胞炎症模型及实验分组给药
取对数生长期细胞,调整细胞密度为2 ×105cells/mL,接种于24 孔细胞培养板(500 μL/孔),37℃、5% CO2条件下培养24 h。采用预防给药方式,对照组、地塞米松(1 μM)、吲哚美辛(1 μM)、FSEE(25、50、100 μg/mL)、60% FTA(25、50、100 μg/mL)、90% FTA(25、50、100 μg/mL)作用2 h 后,给予终浓度为1 μg/mL[14]的LPS(E.coli,O55∶B5)刺激,培养24 h 后,胰酶消化,1000 rpm 离心收集细胞,PBS 清洗3 次后进行活性氧检测;收集细胞上清液,-20 ℃储存备用。
1.5 连翘提取物对BEAS-2B 细胞活力的影响
取对数生长期细胞,调整细胞密度为1 ×105cells/mL,100 μL/孔接种于96 孔细胞培养板,给药浓度梯度为:0、2、4、8、16、32、64、128、256 μg/mL,同时设空白对照组。MTT 法(5 mg/mL)检测并计算细胞相对增值率(RGR)。
1.6 细胞形态观察
呼吸道上皮细胞(BEAS-2B)在FSE 作用24 h后,倒置相差显微镜(200 倍)观察细胞形态并拍照。
1.7 细胞培养液上清中NO 检测
取1.5 项细胞培养上清,10000 rpm 冷冻离心10 min,按Griess 试剂盒说明书方法检测上清中NO的含量,检测波长为540 nm,每组设6 个复孔。
1.8 细胞内ROS 检测
收集1.5 项细胞,按说明书装载探针,取一对照孔另设Rosup 组作为产生活性氧的阳性对照,激发波长为488 nm,发射波长为525 nm,流式细胞仪进行检测。
1.9 统计学处理
采用Origin 8.0 和Excel 2007 对数据进行处理,数据以表示。用SPSS17.0 统计软件进行统计分析,多组间采用单向方差分析(one-way ANOVA)进行比较,P<0.05 为差异有统计学意义。
2 实验结果
2.1 不同FSE 对BEAS-2B 细胞的毒性作用
经前期研究发现,在FSE 浓度小于100 μg/mL情况下,随着时间的延长,其对BEAS-2B 细胞的毒性并不明显。因此,本实验选择24 h 作为检测FSE对BEAS-2B 细胞毒性作用的监测点。从表1、2、3可以看出,给药浓度在低于128 μg/mL 时,FSEE、90% FTA、60% FTA 对BEAS-2B 细胞的毒性作用较小;给药浓度在128~256 μg/mL 时,90% FTA 与60% FTA 表现出对BEAS-2B 细胞的毒性作用。倒置显微镜下拍照,60% FTA 组细胞形态如图1 所示。在浓度达到256 μg/mL 时,细胞数量明显减少,触角消失,细胞缩小呈模糊的泡状。
表1 90% FTA 对BEAS-2B 细胞活力的影响(n=6,)Table 1 Effect of 90%FTA on viability of BEAS-2B cells (n=6,)

表1 90% FTA 对BEAS-2B 细胞活力的影响(n=6,)Table 1 Effect of 90%FTA on viability of BEAS-2B cells (n=6,)
注:与Control 组比较,* P<0.05,#P<0.01。Note:Compared with Control group,* P<0.05,#P<0.01.
表2 60% FTA 对BEAS-2B 细胞的作用(n=6,)Table 2 Effect of 60% FTA on viability of BEAS-2B cells (n=6,)
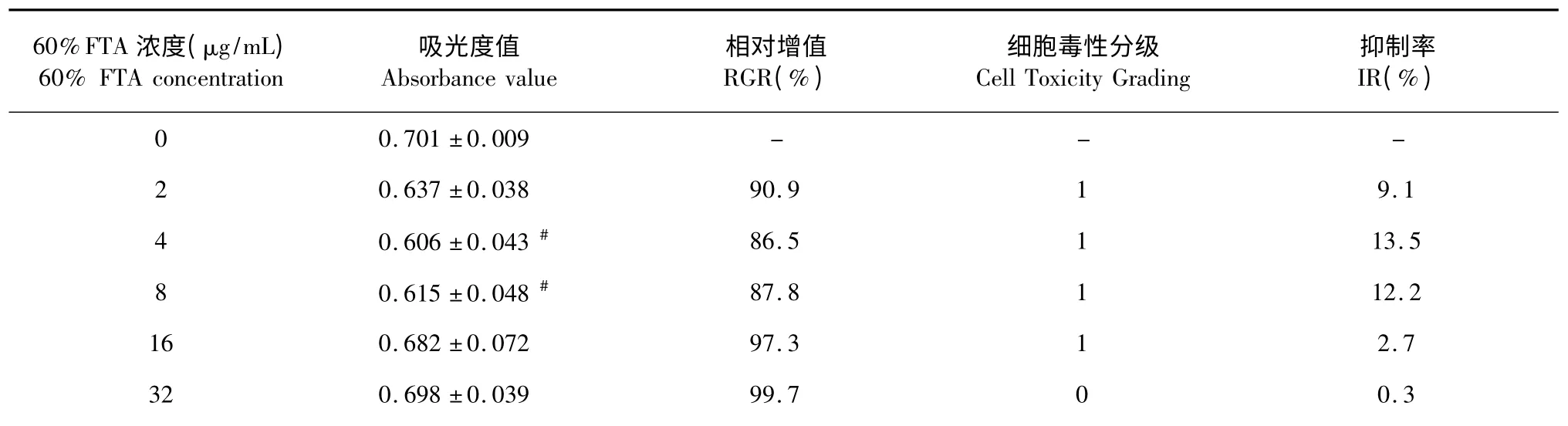
表2 60% FTA 对BEAS-2B 细胞的作用(n=6,)Table 2 Effect of 60% FTA on viability of BEAS-2B cells (n=6,)

注:与Control 组比较,* P<0.05,#P<0.01。Note:Compared with Control group,* P<0.05,#P<0.01.
表3 FSEE 对BEAS-2B 细胞的作用(n=6,)Table 3 Effect of FSEE on viability of BEAS-2B cells (n=6,)

表3 FSEE 对BEAS-2B 细胞的作用(n=6,)Table 3 Effect of FSEE on viability of BEAS-2B cells (n=6,)
注:与Control 组比较,* P<0.05,#P<0.01。Note:Compared with Control group,* P<0.05,#P<0.01.

图1 60%FTA 对BEAS-2B 细胞作用的形态观察结果(10 ×20)Fig.1 Morphological observations of BEAS-2B cells treated with 60% FTA
2.2 吲哚美辛、地塞米松对BEAS-2B 细胞的毒性影响
给药浓度在62.5~2000 nM 之间,吲哚美辛与地塞米松均未表现出对BEAS-2B 细胞的毒性,后续试验采用的阳性对照组的给药浓度为1000 nM。
2.3 BEAS-2B 细胞培养上清液NO 含量检测
如图2 所示,1 μg/mL LPS 刺激BEAS-2B 细胞24 h 后,模型组NO 释放量显著增加(P<0.01);阳性对照组(吲哚美辛、地塞米松)NO 释放量均明显减少(P<0.01);FSE 给药组也表现出较强的降低NO 释放的效果,90% FTA 组且存在剂量依赖关系,浓度越高,降低NO 释放效果愈加明显。
2.4 BEAS-2B 细胞胞内ROS 含量检测
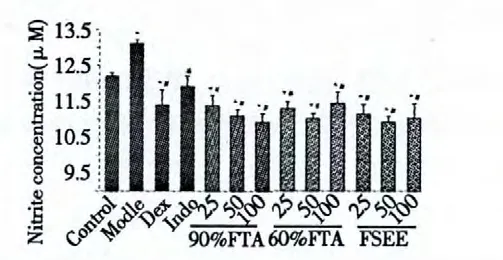
图2 FSE 对LPS 诱导的BEAS-2B 细胞产生NO 的影响Fig.2 Effect of FSE on NO production from LPS-induced BEAS-2B cells
如图3 所示,1 μg/mL LPS 刺激BEAS-2B 细胞24 h 后,模型组与Rosup 组ROS 释放量显著增加(vs.Control,P<0.01);阳性对照组(吲哚美辛)ROS释放量明显减少(vs.Model,P<0.01);FSE 给药组均表现出较强的降低ROS 含量的作用,90%FTA、60%FTA、FSEE 组随着浓度的增加,降低细胞内ROS 含量的效果越明显,有剂量依赖关系。90%FTA 组的降低ROS 含量的效果明显好于另外两组,在中、高剂量时,效果与阳性药相近。
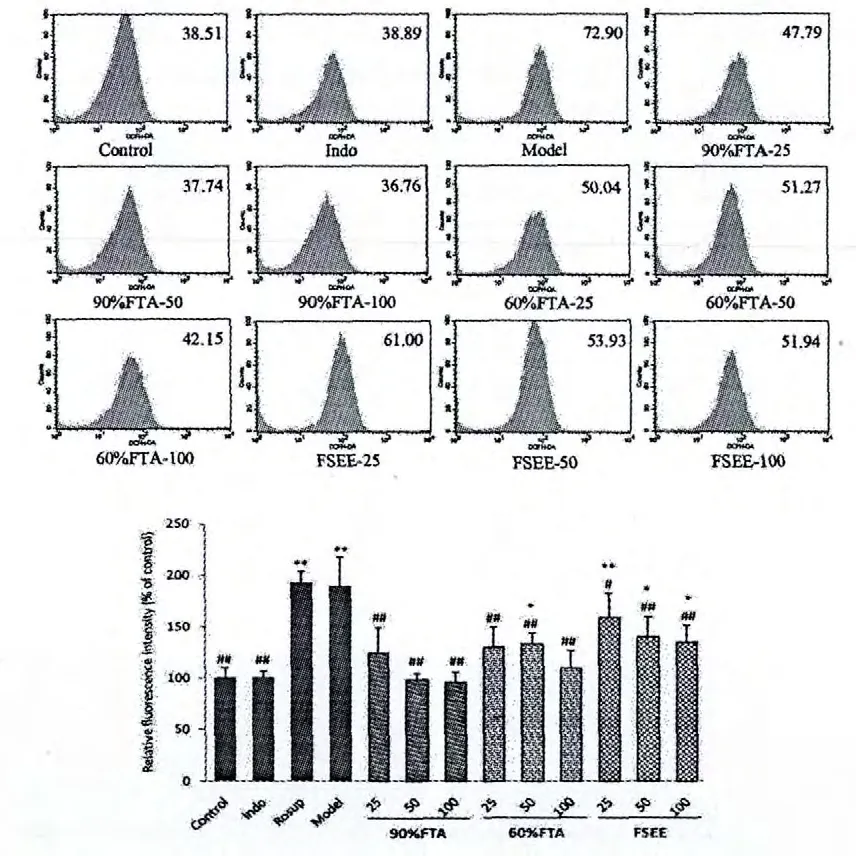
图3 FSE 对LPS 诱导的BEAS-2B 细胞产生ROS 的影响Fig.3 Effect of FSE on ROS production from LPS-induced BEAS-2B cells
3 讨论
连翘有抗菌、抗炎、强心、利尿、镇吐等药理作用,是双黄连口服液、双黄连粉针剂、清热解毒口服液等中药制剂的主要原料。研究发现[15]50%的连翘醇提取物水溶液20 mL/kg 腹腔注射,对大鼠巴豆油性肉芽囊有非常明显的抗渗出作用及降低炎灶微血管壁脆性作用;复方连翘注射液具有明显的抗炎作用,能降低大鼠和小鼠毛细血管通透性,减少炎性渗出,对蛋清所致足爪水肿有抑制作用,并能增强小鼠炎性渗出细胞的吞噬能力,从而增强机体的防御机能。
连翘挥发油软胶囊治疗急性上呼吸道感染具有显著疗效[16],而利用体外培养的细胞进行药物性能的研究是目前各实验室常用的研究方法之一,因此本实验采用人呼吸道上皮细胞为研究对象,对连翘用于治疗上焦系统的疾病的原因进行探讨。本实验采用MTT 方法首先对不同的连翘提取物进行细胞毒性的研究,高浓度的提取物可致使BEAS-2B 细胞产生细胞病变,触角逐渐消失,细胞变圆并缩小,细胞呈现模糊的泡状;低浓度的FSE 反而对该细胞具有一定的“营养维持”作用,低浓度给药组较正常对照组细胞形态整齐均一,MTT 方法测得60% FTA(128 μg/mL)、FSEE(128 μg/mL)吸光度值显著大于正常对照组(P<0.01)。也可能是因为当提取物的浓度达到一定程度后,对BEAS-2B 细胞是一种生理刺激,应激反应促使细胞增值以应对这种变化。实验还发现,连翘酯苷浓度越大,其对细胞的毒性越大。为避免因药物的浓度太大对实验结果的影响,因此本实验的给药剂量分别设置为25、50、100 μg/mL。
据实验研究[17],连翘具有拮抗内毒素的作用并可显著抑制细菌内毒素诱发的炎性因子的过度表达。参与免疫反应,神经递质传递,血管扩张的NO在各组织中的生理浓度是决定其关键地位的最主要因素[18]。高浓度的NO 被认为是炎症反应和内毒素血症的细胞毒性因子,研究细胞内NO 的水平对研究炎症反应具有重要的意义。宋宏等[19]通过对BEAS-2B 细胞在臭氧气液界面暴露后的损伤研究发现,通过给予N-乙酰半胱氨酸药物保护后,NO 释放量显著减少(P<0.05)。本实验采用LPS 诱导BEAS-2B 细胞产生炎症,通过对NO 的含量的检测来寻找连翘提取物可能的抗炎有效部位。
通过我们之前的研究[20]发现,不同连翘提取物对角叉菜胶致大鼠足趾肿胀炎症模型有较好的治疗效果,以90%FTA 效果最佳。与模型组比较,90%FTA 提取物中、高剂量组能极显著降低血清中TNFα 与IL-2 的水平和提高血清中SOD 的水平。BEAS-2B 细胞炎症实验结果显示,连翘提取物(FSE)具有较好的降低NO 与细胞内ROS 含量的作用,且这种效果存在显著性差异。90% FTA 的提取物减少NO分泌的效果存在剂量依赖关系,三种提取物都能在一定程度上降低BEAS-2B 细胞内ROS 含量的作用,以90% FTA 的效果最佳,且给药浓度越高,作用效果越好,呈量效关系。据此两方面的原因,我们推测连翘有效的抗炎活性成分可能为连翘酯苷A。当然也不排除FSE 中的某种成分针对其它的炎症模型也具有很好的抗炎活性,关于连翘中抗炎成分还有待进一步的研究,这将对中药合理用药,充分发挥药材的治疗效果具有重大的意义。
1 Chinese Pharmacopoeia Commission (国家药典委员会).Pharmacopoeia of the People’s Republic of China (中华人民共和国药典).Beijing:China Medical Science Press,2010.Vol I,159-160.
2 Li HB,Chen F.Preparative isolation and purification of phillyrin from the medicinal plant Forsythia suspense by high speed counter current chromatography.J Chromatogr A,2005,1083:102-105.
3 Chopra M,Reuben JS,Sharma AC.Acute lung injury:apoptosis and signaling mechanisms.Exp Biol Med (May-wood),2009,234:361-371.
4 Schutte BC,Mccray PB.[beta]-defensins in lung host defense.Annu Rev Physiol,2002,64:709-748.
5 Tsai KS,Grayson MH.Pulmonary defense mechanisms against pneumonia and sepsis.Curr Opin Pulm Med,2008,14:260-265.
6 Gao Y,Fang L,Qi Y,et al.Shuang-Huang-Lian exerts antiinflammatory and anti-oxidative activities in lipopolysaccharide-stimulated murine alveolar macrophages.Phytomedicine,2014,21:461-469.
7 Wen CL,Chang CC,Kuo CL,et al.Anti-inflammatory effects of methanol extract of Antrodia cinnamomea mycelia both in vitro and in vivo.J Ethnopharmacol,2011,137:575-584.
8 Guan JY,Shen H,Cui DF,et al.Effects of forsythoside on lipopolysaccharide (LPS)-stimulated RAW264.7 macrophages.African J Pharm Pharmacol,2013,1847-1853.
9 Lee JH,Hwang KH,Kim GH.Inhibition of wild herb Rhaponticum uniflorum on synthesis of inflammatory mediators in macrophage cells.Food Sci Biotechnol,2013,22:567-572.
10 Yang F,Contois AS,Fang L.Nitric oxide derived nitrate anion contributes to endotoxic shock and multiple organ injury.Crit Care B,Actin Med,2002,30:650.
11 Sugiura H,Ichinose M.Oxidative and nitrative stress in bronchial asthma.Antioxid Redox Signal,2008,10:785-797.
12 Singer SS,Hagedorn JE,Smith DM,et al.The enzymatic basis for the rat liver 6-hydroxymelatonin sulfotransferase activity.Pineal Res,1995,18:49-55.
13 He WL(何文珑),Jia JP(贾金萍),Zhang LW(张立伟).Optimization of polyamide medium voltage preparation technology for forsythiaside.Food Eng (食品工程),2014,2:20-22.
14 Schulz C,Farkas L,Pfeifer M,et al.Differences in LPS-induced activation of bronchial epithelial cells (BEAS-2B)and type II-like peumocytes (A-549).Scand J Immunol,2002,56:294-302.
15 Pharmacology group of combine traditional Chinese and western medicine institute (湖北省中西医结合研究所药理组).Compound forsythia injection pharmacological action research.XinYiIYaoTongXun (新医药通讯),1975,l:66.
16 Xiao HM(肖会敏),Guo QQ(郭倩倩),Wang SW(王四旺),et al.Clinical observation on forsythia volatile oil soft capsule treatment of upper respiratory tract infection.J Tradit Chin Med (中医药临床杂志),2011,23:595-596.
17 Fu Q(傅强),Cui HL(崔华雷),Cui NJ(崔乃杰).Experimental study on inhibitory effect of forsythia extract on inflammatory response induced by endotoxin.Tianjin Med J(天津医药),2003,31:161-163.
18 Moncada S,Palmer RM,Higgs EA.Nitric oxide:physiology,pathophysiology,and pharmacology.Pharmacol Rev,1991,43:109-142.
19 Wang KL(王科霖),Guan DB(管东波),Song H(宋宏).Oxidative damage effect in respiratory epithelial cells inducedby exposure to ozone in air-liquid interface.J Environ Health(环境与健康杂志),2011,28:397-400.
20 He WL(何文珑).Anti-inflammatory activity and metabolomics of Forsythiaside A:A preliminary study.Taiyuan:Shanxi University (山西大学),MSc.2014.
