艾纳香不同部位多酚和黄酮类抗氧化活性研究
2015-01-08韦睿斌庞玉新张影波王中洋孙懂华
韦睿斌 ,杨 全 ,庞玉新,袁 蕾,张影波,王中洋,孙懂华
1广东药学院中药学院,广州 510006;2 中国热带农业科学院热带作物品种资源研究所 农业部华南作物基因资源与种质创制重点开放实验室,儋州 571737;3 海南省艾纳香工程技术研究中心,儋州 571737
艾纳香[Blumea balsamifera (L.)DC.]为菊科艾纳香属多年生木质草本植物或亚灌木,别名大风艾、冰片艾等,主要药用部位为全草或者地上部分,产于贵州、广西、广东、海南等地[1]。早在1980 年,Wat 等[2]就对菊科44 种草本植物和两种新鲜植物进行研究,发现艾纳香具有光敏性和对大肠杆菌和白色念珠菌抑制作用等生物活性。近年来,在单体分离的基础上,国内外学者如许实波[3]、Saewan[4]、Haswgawa[5]等对艾纳香及其提取物的生物活性和药理活性进行了详尽的研究,结果表明:艾纳香具有良好的抗菌活性、抗肿瘤活性、保肝活性、抗氧化活性、抗酪氨酸激酶活性等,其中艾纳香黄酮类成分具有抗氧化活性。
在植物组织中,酚酸很少以游离态形式存在,一般多与有机酸、糖以及各种酯化结合形式存在。郑丹等[6]从艾纳香地上部分分离并检测到小麦黄素、芹菜素、木犀草素、原儿茶酸(甲酯)、咖啡酸(甲酯)、β-谷甾醇以及胡萝卜苷等。Huang L 等[7]从艾纳香地上部分得乙醇提取物中分离出香草酸、丁香酸、香豆酸、咖啡酸、和原儿茶酸,并能显著减少老鼠血液凝固时间和尾部出血时间。
多酚类化合物的主要功能性质是作为许多酶体系的抑制剂或激活剂、金属螯合剂以及自由基清除剂。多酚类化合物通过酚羟基的离解和自由基途径产生抗氧化作用,是医药、食品、化妆品中很有前景的一类天然抗氧化剂和自由基清除剂。就艾纳香而言,目前研究主要集中于黄酮类成分化学分析、药理作用等方面。有关艾纳香酚酸类成分研究报道较少,未见涉及艾纳香酚酸类抗氧化活性研究的报道。本研究在建立艾纳香酚酸含量测定方法的基础上,分析海南产艾纳香中总黄酮、总酚酸含量与抗氧化活性相关性,进一步比较药材中总黄酮和总酚酸含量,以期为艾纳香资源化开发与利用提供参考。
1 仪器与试药
Multiskan® Go 型全波长酶标仪(赛默飞世尔科技),Sartarius CPA225D 电子分析天平[赛多利斯科学仪器(北京)有限公司],KQ-500DB 型数控超声波清洗器(昆山市超声仪器有限公司),Beckman Coulter DU 800 紫外/可见光分光光度计[美国贝克曼库尔特(北京)有限公司]。
维生素C(Vitamin C,Vc,纯度>99%,北京索莱宝科技有限公司),1,1-二苯基-2-三硝基苯肼(DPPH,纯度>97%,美国Sigma 公司),2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS,纯度>99%,西亚试剂),6-羟基-2,5,7,8-四甲基色烷-2-羧酸(Trolox,纯度>97%,美国Sigma 公司),2,4,6-三吡啶基三嗪(TPTZ,纯度>98%,西亚试剂),芦丁对照品(上海源叶生物科技有限公司,批号:153-18-4,质量分数>98%),没食子酸对照品(中国药品生物制品检定所,批号:110831-201204,质量分数为89.9%),福林酚试剂(上海荔达生物科技有限公司),其余试剂均为分析纯,H2O 为蒸馏水。
试验材料采自农业部儋州热带药用植物种质资源圃,经中国热带农业科学院庞玉新副研究员鉴定为菊科艾纳香属植物艾纳香Blumea balsamifera(L.)DC.的全草,标本存放于中国热带农业科学院热带作物品种资源研究所标本馆。
2 实验方法
2.1 艾纳香不同部位多酚的含量测定
2.1.1 对照品储备溶液的制备
精密称取于105 ℃干燥至恒重的没食子酸对照品适量,加蒸馏水制成1 mg/mL 的对照品储备溶液。
2.1.2 供试品溶液的制备
分别精密称取艾纳香嫩茎、嫩叶、功能叶样品粉末(60 目)0.5 g,至具塞锥形瓶中,加95%乙醇溶液25 mL,称定重量,超声(频率40 kHz、功率400 W)50 min,放冷。称定重量,用95%乙醇补足减失的重量,摇匀,滤过,稀释至不同浓度备用。
2.1.3 测定波长的选择
分别精密量取没食子酸对照品储备液、供试品液0.5 mL 置微量离心管中,各加Folin-Ciocalteu 试剂0.5 mL,静置5 min 后,加入20% Na2CO3溶液1 mL,静置10 min。以150 g 离心力离心8 min,取上清液备用。以相应的试剂溶液为空白,在300~900 nm 波长间进行全波长扫描,结果最适检测波长为760 nm。
2.1.4 方法学考察
我的接近并最终投身文学,近一甲子矣。在此漫漫岁月,虽无骄人成绩,所幸终日矻矻,与文学相伴了一生。朋友曾与我谈及一同起步的同行许多已巍然成树,叹息我等才情有限,始终不成气候,最多算棵草而已,很没劲。我同意他的比喻,却不同意他的自卑。没有长成树木,长成了草,也是文学原野上的生命。而且,一粒种子,能长成一棵草,生动地活着,其实也并不容易。说树不是一天长成的,草又何尝不是?天时地利人和,一样不能少。就一个写作者而言,不说社会历史那么高大上的原因了,仅仅稿件的发表就不知耗费了编辑们多少辛劳。
2.1.4.1 线性关系
分别精密量取“2.1.1”项下对照品储备液250、200、150、100、50 μL,置于5 mL 容量瓶中,加蒸馏水至刻度。精密量取500 μL,以下步骤按照“2.1.3”项下从“各加Folin-Ciocalteu 试剂0.5 mL”起,进行操作,以相应的试剂溶液为空白对照,在760 nm 分别测定吸光值(A)。以浓度X(ρ)为横坐标,吸光值Y(A)为纵坐标,进行线性回归,得Y=0.0 173X-0.0 020,r=1,线性范围为0.0090~0.0450 mg/mL。
2.1.4.2 精密度试验
精密量取对照品储备液0.5 mL,置微量离心管中,按“2.1.3”项下方法测定吸光值,连续测定6次。结果吸光值RSD 值为0.01%,表明仪器精密度良好。
2.1.4.3 稳定性试验
取同一供试品溶液,置微量离心管中,按“2.1.3”项下方法操作,每隔5 min 测定其吸光值,共计60 min。结果显示溶液在显色后30 min 时RSD 值为0.24%,表明供试品溶液在30 min 内较稳定。
2.1.4.4 重复性试验
取同一批艾纳香药材0.5 g,6 份,精密称定,按“2.1.2”项下方法制备供试品溶液,精密量取供试品溶液0.5 mL,按“2.1.3”项下方法测定吸光值。结果总酚酸含量RSD 为1.79%,表明方法重复性良好。
2.1.4.5 加样回收试验
取已知含量的艾纳香样品粉末(60 目)0.25 g,6 份,精密称定。分别加入没食子酸对照品,按“2.1.2”项下方法制备供试品溶液,精密量取供试品溶液0.5 mL,按“2.1.3”项下方法测定吸光值,计算加样回收率,结果表明,平均回收率为101.22%,RSD为0.66%,结果见表1,本法测定艾纳香多酚含量方法准确可靠。
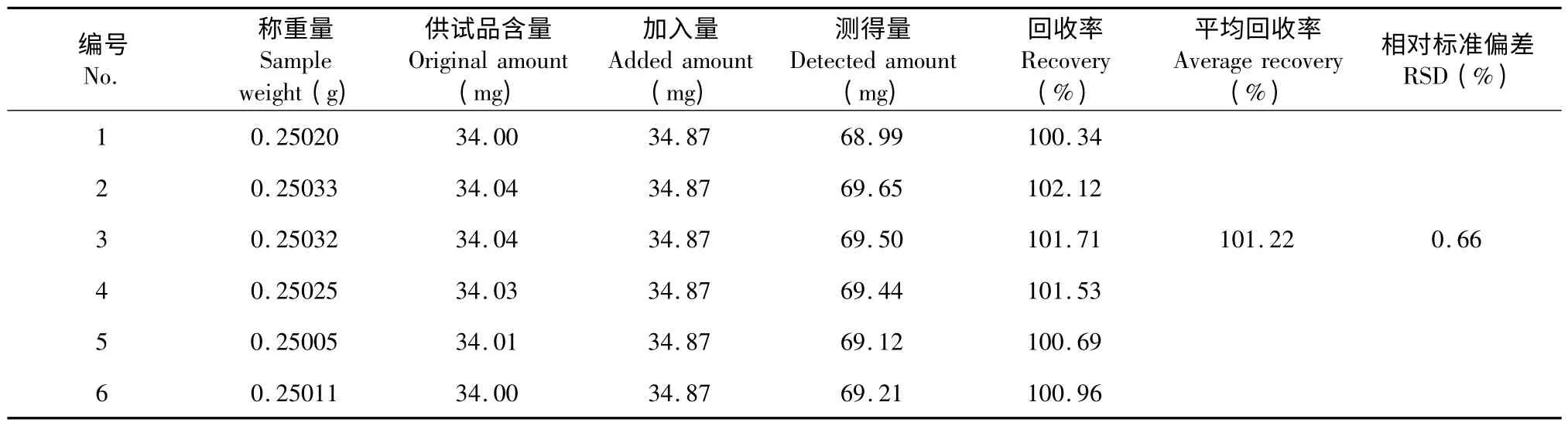
表1 艾纳香多酚加样回收率试验结果(n=6)Table 1 Recovery test results of total phenolic acid from B.balsamifera (n=6)
2.1.5 样品中多酚的测定
将不同浓度的样品溶液,按“2.1.3”项下方法测定各供试品溶液的吸光值,结果以相当于没食子酸(Gallic acid)的毫克数表示(mg Gallic acid/g)。
2.2 艾纳香不同部位总黄酮的含量测定
供试品溶液制备同“2.1.2”项下所述,采用AlCl3显色法[8]测定艾纳香中不同部位总黄酮含量,以芦丁为标准品,结果以相当芦丁(Rutin)的毫克数表示(mg Rutin/g)。
2.3 艾纳香不同部位抗氧化活性的测定
2.3.1 清除DPPH 自由基的能力
精密称取0.0150 g DPPH,无水乙醇溶解并定容至250 mL,即得DPPH 储备液,于4 ℃保存备用。将不同质量浓度的样品溶液配制成1.00、0.50、0.25、0.125、0.0625、0.03125 g/L 的乙醇溶液,即供试品溶液。
操作步骤:将100 μL 供试品溶液和100 μL DPPH 溶液共置于96 孔板中,设置3 个平行样品组,对照组为100 μL 的乙醇溶液和100 μL DPPH 溶液,空白组分别加入100 μL 供试品溶液和100 μL 乙醇溶液。点样完毕后,室温放置30 min,然后在517 nm 下测定其吸光值,重复测量3 次,取平均值。根据吸光值变化判断试样对DPPH 自由基清除能力。按照公式(1)计算其清除率,并计算出IC50。
清除率=[1-(As-Ab)/ Ac]×100% (1)
式中Ac 为对照溶液吸光度,As 为样品溶液吸光度,Ab 为空白溶液吸光度。
2.3.2 清除ABTS 自由基的能力
分别精密称取97.03 mg ABTS、16.76 mg K2S2O8,分别置于25 mL 棕色容量瓶中,用去离子水溶解并定容,室温下避光静置12~16 h,得ABTS 储备液。使用前用无水乙醇稀释至吸光值为0.70 ±0.02,得。将不同质量浓度的样品溶液配制成1.50、1.00、0.50、0.25、0.125、0.0625 g/L 乙醇溶液,即供试品溶液。
2.3.3 Trolox 等效抗氧化能力(Trolox equivalent antioxidant capacity,TEAC)计算
精密称取0.0100 g Trolox 粉末,无水乙醇溶解并定容于25 mL 容量瓶中,得Trolox 标准溶液。将上述Trolox 溶液用无水乙醇按需要稀释为不同浓度,分别于DPPH 和ABTS 体系测定其吸光值,计算抑制率。以Trolox 浓度为横坐标,抑制率为纵坐标绘制标准曲线,分别得DPPH 体系的曲线方程Y=6.3858X+0.414,r=0.9995;ABTS 体系的曲线方程Y=0.0065X+0.0784,r=0.9996。通过上述方程计算Trolox 在两个体系的IC50值,Trolox 的IC50值与样品的IC50值得比值即为样品的RACT50。
2.4 数据分析
采用origin8.0 进行数据处理和相关性分析。
3 结果与分析
3.1 艾纳香不同部位多酚和总黄酮含量
为了研究艾纳香抗氧化活性与黄酮多酚类化合物的关系,分别采用Folin-Ciocalteu 比色法和硝酸铝络合分光光度法测定艾纳香不同部位中多酚与总黄酮的含量,见表2。由表2 可知,艾纳香不同部位多酚与总黄酮含量顺序与其提取液清除DPPH+·和ABTS+·的能力顺序基本一致,即艾纳香功能叶>艾纳香嫩叶>艾纳香嫩茎。

表2 艾纳香不同部位的多酚(mg Gallic acid/g)和总黄酮(mg Rutin/g)含量及IC50(g/L)与RACT50(μmol/g)Table 2 Contents of total flavonoids (mg Rutin/g)and phenolic acid (mg Gallic acid/g),IC50(g/L)and RACT50(μmol/g)of different parts of B.balsamifera
3.2 艾纳香不同部位清除DPPH 和ABTS 自由基能力
DPPH+·是一种在有机溶剂中稳定的以氮为中心的自由基,其乙醇溶液呈紫色,在可见光波长517 nm 下具有特定的光吸收,当试样供给氢原子与DPPH+·的未成对电子结合时,吸光值会随着未成对电子数量的减少而下降。通过测定最大吸收波长处吸光值的减弱程度评价试样对DPPH+·清除能力。清除DPPH+·效果之强弱,即代表该试样能提供氢(Hydrogen donor)给自由基之强弱。ABTS 法本质上一种间接方法,是用来检测物质清除ABTS+·这种自由基的能力,与真实的氧化分解没有关系,它只是用TEAC 值来表征测试样品与经氧化得到的ABTS+·反应的能力而非阻断该氧化过程,因此TEAC 值在概念上类似于阻断系数,并不是直接反应被检物质的活力,全面判断一种物质的抗氧化能力还要结合DPPH 法。ABTS 经活性剂氧化后生成稳定的蓝绿色阳离子自由基,ABTS+·是一种较稳定的自由基,其无水乙醇或磷酸缓冲液(PBS)呈蓝绿色,其抗氧化活性物质可抑制其产生并使反应体系褪色,表现出吸光度降低,颜色变得越浅,表明活性物质清除ABTS+·的能力越强。通过测定加入活性物质前后在ABTS+·这种自由基的最大吸光波长下(734 nm)检测吸光值的变化,计算出试样对ABTS+·的清除能力。
图2 表明,艾纳香不同部位提取液对DPPH+·和ABTS+·均有一定清除能力,在较低的质量浓度(0.0313 mg/mL)下即有较高的清除效果。在1~0.03125 g/L 的质量浓度范围内随着提取物的浓度的增加,其对DPPH+·和ABTS+·清除能力逐渐增强,说明艾纳香不同部位提取物对DPPH+·和ABTS+·的清除能力存在明显的量效关系。在同一浓度时,艾纳香功能叶清除能力最强,其次为嫩叶,而嫩茎最弱,两种方法的活性测定结果趋势一致。
3.3 Trolox 等效抗氧化能力计算

图2 艾纳香不同部位提取物对DPPH(A、C、E)和ABTS(B、D、F)自由基清除效果Fig.2 DPPH (A,C,E)and ABTS (B,D,F)radical scavenging capacity of different parts of B.balsamifera
Trolox 是一种类似于VE的水溶性物质,用Trolox 等同抗氧化活性值(TEAC)评价抗氧化能力,结果多表示为达到一定浓度测试物质相当的抗氧化能力所需要的Trolox 的浓度。以Trolox 的浓度为横坐标,抑制率为纵坐标分别绘制ABTS 和DPPH 自由基清除能力测定体系的曲线方程,根据曲线方程计算Trolox 在两个评价体系的IC50值,分别为DPPH体系36 μmol/L,ABTS 体系506 μmol/L。分别计算出艾纳香不同部位提取液DPPH 体系和ABTS 体系的IC50,Trolox 的IC50与试样的IC50比值即为试样的RACT50。IC50和RACT50值可表示试样抗氧化活性,IC50值越小,RACT50越大,表示此试样的抗氧化活性越强,反之则相对较弱。由表2 看出,DPPH 体系和ABTS 体系趋势一致,艾纳香不同部位提取液不同评价体系抗氧化顺序为:艾纳香功能叶>艾纳香嫩叶>艾纳香嫩茎。
3.4 相关性分析
现代研究表明抗氧化活性与植物体中多酚和总黄酮含量有密切的关系[9]。因此对艾纳香不同部位提取物的多酚和总黄酮含量进行测定,并进行相关性分析,通过统计学分析寻找艾纳香产生抗氧化活性的主要原因。结果见图3 和表3。
如图3A 所示,以艾纳香不同部位DPPH 体系RACT50值(x)为自变量,多酚、黄酮含量(y)为因变量进行相关性分析,得相关系数。同样的方法获得ABTS 体系的相关系数(图3B),多酚与总黄酮含量的相关系数(图3C),DPPH 与ABTS 方法间的相关性(图3D)。由表3 和图3 可知,艾纳香不同部位提取液的抗氧化能力与多酚和总黄酮的含量均呈正相关,其中,DPPH 体系与多酚、总黄酮含量相关系数R 分别为0.948 和0.954,ABTS 体系相关系数R 分别为0.949 和0.950,说明多酚与总黄酮是自由基清除能力的主要影响因素,多酚与总黄酮含量相关系数R 为0.999,说明艾纳香多酚与总黄酮两类有较大相似性,DPPH 与ABTS 两种抗氧化活性测定方法间相关系数R 为0.935,说明二者方法相关性很高,可能与二者具有相似的反应机理有关。
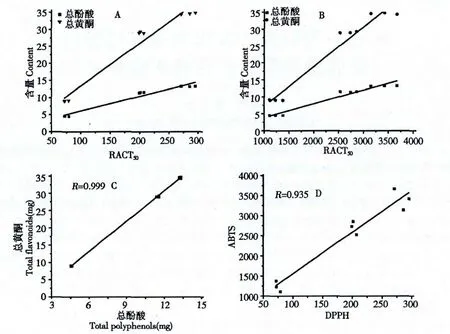
图3 艾纳香不同部位提取液自由基清除能力与多酚和总黄酮含量相关性[(DPPH,A)、(ABTS,B)]以及多酚与黄酮含量间(C),DPPH 与ABTS 两种检测方法间(D)的相关性Fig.3 Correlations between radical scavenging capacities and total flavonoids and polyphenols contents[(DPPH,A)and(ABTS,B)]as well as between total flavonoids and polyphenols content assays (C)and between DPPH and ABTS assays (D)
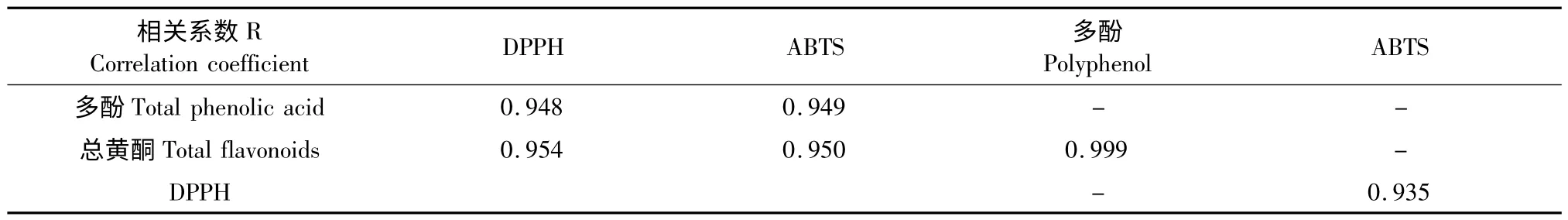
表3 活性物质与抗氧化方法间的相关性Table 3 Correlation coefficient (R)between active substances and radical scavenging capacity assays
4 结论
资料显示,植物中酚类化合物是一种天然抗氧化剂,其中多酚和黄酮中酚羟基结构中的邻位酚羟基很容易被氧化成醌类结构,同时对活性氧等自由基具有很强的捕捉能力,这使得多酚和黄酮具有较强的抗氧化性以及清除自由基的能力,且抗氧化活性的强弱与其所含多酚和黄酮类成分含量的高低具有较高的相关性。本实验研究结果显示,艾纳香不同部位提取液均有一定的抗氧化活性,其中功能叶对DPPH、ABTS 自由基清除效果最好,其次是嫩叶。通过相关性研究发现,各部位提取液抗氧化活性与总多酚和黄酮含量之间有明显的相关性,说明总多酚和总黄酮为艾纳香提取液清除自由基作用的主要影响因素。
目前,艾纳香为我国重要的民族药之一,在黎、苗、壮等民族均有悠久的用药历史,上述研究结果表明艾纳香含有丰富的多酚和黄酮类化合物,具备开发为抗氧化功能产品的价值和潜力。黄酮多酚类化合物是植物比较重要的抗氧化活性物质,二者发挥抗氧化活性与其结构有着非常密切的关系,因此,艾纳香中多酚和黄酮的种类、结构以及与抗氧化活性的关系尚有待进一步阐释。
1 Guan LL(官玲亮),Pang YX(庞玉新),Wang D(王丹),et al.Research progress on Chinese minority medicine of Blumea balsamifera L.DC.J Plant Gene Res(植物遗传资源学报),2012,13:695-698.
2 Wat CK,Johns T,Towers G.Phototoxic and antibiotic activities of plants of the Asteraceae used in folk medicine.J Ethnopharm,1980,2:279-290.
3 Xu SB(许实波),Zhao JH(赵金华).Blumea flavonols of protective effect of experimental liver injury in rats.Acta Pharmacol Bull (中国药理学通报),1998,14:99-100.
4 Saewan N,Koysomboon N,Chantrapromma K.Anti-tyrosinase and anti-cancer activities of flavonoids from Blumea balsamifera DC.J Med Plan Res,2011,5:1018-1025.
5 Haswgawa H,Yamada Y,Komiyama K,et al.Dihydroflavonol BB-1,an extract of natural plant Blumea balsamifera,abrogates TRAIL resistance in leukemia cells.Blood,2006,107:679-688.
6 Zheng D(郑丹),Zhang XQ(张晓琦),Wang Y(王英),et al.Chemical constituents of the aerial parts of Blumea riparia.Chin J Nat Med (中国天然药物),2007,5:421-424.
7 Huang L,Lin C,Li A,et al.Pro-coagulant activity of phenolic acids isolated from Blumea riparia.Nat Prod Commun,2010,5:1263-1266.
8 Pang Y(庞玉新),Huang M(黄梅),Yu FL(于福来),et al.Comparative analysis on the contents of main chemical compositions in Blumea balsamifera(L.)DC.from Hainan and Guizhou province.Acade J Guangdong Coll Pharm(广东药学院学报),2014,30:448-452.
9 Riceevans CA,Miller NJ,Paganga G.Structure-antioxidant activity relationships of flavonoids and phenolic acids.Free Radical Bio Med,1996,20:933-956.
