翼蓼块根提取物的抗氧化活性和血管紧张素转化酶抑制活性研究
2015-01-08郭利杰许明录
王 兰,郭利杰,许明录
1河南师范大学,新乡 453007;2 河南科技学院,新乡 453003
研究发现人体内代谢产生的自由基不仅会引起衰老,还会引发很多疾病,如动脉硬化、糖尿病、白内障等[1]。这些疾病主要是自由基过氧化物的累积所致。人体内各种外源性和内源性自由基在一定外界环境下,与生物体内的许多物质如脂肪酸蛋白质等作用,夺取氢原子,从而使相关细胞的结构与功能遭到破坏。虽然目前一些人工合成的抗氧化剂具有一定的抗氧化效果,但是其安全性却遭到了质疑,所以研究具有抗氧化能力的安全有效天然产物已经成为了当今研究的热点。
高血压是最常见的心血管病,患高血压疾病的人数在全球呈增长趋势,是全球范围内的重大公共卫生问题。血管紧张素转化酶(ACE)是将血管紧张素I 转化为血管紧张素II 的重要的酶,血管紧张素II 能引起血管收缩,升高血压;促进肾上腺皮质释放醛固酮,所以抑制ACE 的活性可以直接预防高血压[2]。近年来人们从天然产物中分离出许多血管紧张素转化酶抑制肽,其降压效果虽然不如合成的药物,但是其对正常血压无影响的特点和天然来源的安全性使之成为人们治疗高血压的一个新的方向。因此,从天然物种中分离纯化药物毒副作用小、疗效更好的代替药物的研究势在必行。
翼蓼(Pteroxygonum giraldii Dammer et Diels)为蓼科翼蓼属的单种,是我国的特有物种。翼蓼主要产地为河北、山西、河南、陕西、甘肃、湖北及四川。生长在山坡石缝,山谷灌丛中。翼蓼的块根俗称“荞麦七”,是陕西七药的一种。在传统中药理论中,翼蓼具有清热解毒、凉血止血、止痛的功效,主要用治疗肠胃炎、痢疾、吐血、便血,崩带漏下、烧烫伤等症。近期研究发现,从翼蓼的块根中分离得到的化合物有黄酮、酚酸、三萜等类化合物[3,4]。有研究发现,黄酮类化合物具有不容忽视的抗氧化能力,对于一些因氧自由基损伤所引起的疾病可能有治疗价值。酚酸类化合物是指同一苯环上有若干个酚性羟基的一类化合物,酚酸类物质均有不同程度的清除自由基作用,是一类良好的天然抗氧化剂[5]。三萜类化合物是一类重要的天然抗氧化活性物质,具有较高的研究和应用价值。自然界中不断发现黄酮类物质具有降血压、调血脂作用,如银杏叶中的黄酮类物质可以抑制血管紧张素酶[6]、醋柳黄酮对兔血浆血管紧张素酶活性和血管紧张素I 具有显著抑制作用[7],目前尚没有发现翼蓼提取物具有ACE 抑制活性相关的报道。
本文以翼蓼块根为实验材料,主要对翼蓼块根甲醇提取物及乙酸乙酯、水、正丁醇萃取物的总酚、总黄酮含量,以及DPPH 自由基清除能力、金属离子螯合能力、还原能力,以及不同提取物的ACE 抑制活性等进行了分析,并就天然产物的总酚、总黄酮含量与抗氧化活性,以及抗氧化活性与ACE 的抑制活性做了初步探究,从而试图为天然药物的开发利用提供理论依据和参考。
1 材料与方法
1.1 材料与试剂
材料:翼蓼块根于2010 年10 月采于河南省太行山,经河南科技学院生命科技学院许桂芳教授鉴定。
试剂:Folin-Denis、DPPH(1,1-二苯基-2-三硝基苯肼,Sigma 公司产品)、Ferrozine 试剂(5 mmol/L)、血管紧张素转换酶(ACE)、马尿酰组氨酰亮氨酸(Hip-HIS-Leu,HHL)。
1.2 实验方法
1.2.1 提取与萃取
将干燥的翼蓼块根(0.5 kg)粉末盛装于10 L广口瓶内,用3 L 甲醇浸提,60 ℃恒温水浴锅,加热回流提取24 h。提取液用旋转蒸发仪进行浓缩蒸干,以上过程重复三次,合并三次提取物得到翼蓼块根的甲醇提取物(PGM)48.6 g。再用蒸馏水将翼蓼块根的甲醇提取物溶解,然后依次使用正己烷(Hexane,H)、二氯甲烷(Methylene chloride,Mc)、乙酸乙酯(Ethyl acetate,E)、正丁醇(Butanol,B)的顺序按1∶1 的比例进行萃取,每种溶剂萃取三次,最后得到水(Water,W)层。各提取液用旋转蒸发仪进行浓缩蒸干,得到各萃取层的量为:正己烷层(PGH,0.34 g)、二氯甲烷层(PGMc,2.27 g)、乙酸乙酯层(PGE,24.51 g)、正丁醇层(PGB,19.37 g)和水层(PGW,11.92 g)。各提取物溶解稀释后备下列实验使用。
1.2.2 总酚含量测定
总酚含量测定方法根据Ragazzi 等[8]描述,略做修改。在小试管中分别加入样品(1000 μg/mL)1mL+Folin-Denis 试剂2 mL,5 min 后,再加入Na2CO3饱和溶液2 mL,充分混合,在室温下反应30 min,并做三组重复。对照组中的样品用蒸馏水代替,其它条件不变。空白组中Folin-Denis 试剂用蒸馏水代替,其它条件不变,在波长725 nm 处测定吸光度值。
以每克样品中含没食子酸的毫克数表示总酚含量:
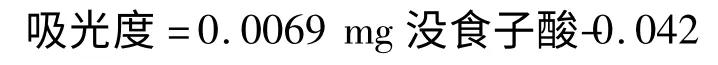
1.2.3 总黄酮含量测定
总黄酮含量测定的方法参考Park 等[9]的描述。在小试管中分别加入样品(1000 μg/mL)0.5 mL,1 mmol/L CH3COOK 溶液0.1 mL,2.8 mL 蒸馏水,95%乙醇1.5 mL,和10% AlCl3·6H2O 溶液0.1 mL。对照组中样品和AlCl3·6H2O 溶液用蒸馏水代替,其它条件不变。空白组中AlCl3·6H2O 溶液用蒸馏水代替,其它条件不变。所配溶液在室温下放置40 min 在415 nm 下测定吸光度值。做三组重复。
以每克样品中含槲皮素的毫克数表示总黄酮含量:
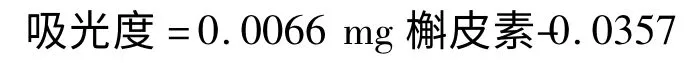
1.2.4 DPPH 自由基清除能力的测定
DPPH 自由基的清除能力测定依据Yen 和Chen(1995)[10]的方法,略做修改。在对照组内加入0.75 mL 0.2 mmol/L 的DPPH 甲醇溶液+0.75 mL蒸馏水,在实验组内加入0.75 mL 0.2 mmol/L 的DPPH 甲醇溶液+0.75 mL 待测样品溶液,在空白组内加入:0.75 mL 待测样品溶液+0.75 mL 甲醇溶液,混合均匀后于室温下在暗处静置30 min,然后在517 nm 处测定吸光度值。
待测样品对DPPH 自由基的清除能力:
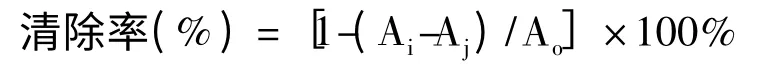
其中:Ao为对照组的吸光度;Ai为实验组的吸光度;Aj为空白组的吸光度。
本实验中将各层待测样品分别配制成0.1、1、10、100 μg/mL 的一系列浓度梯度的溶液,然后配制对照组、实验组、空白组,最后测定对应待测样品浓度的吸光度,每个样品的每个浓度重复3 次。计算DPPH 自由基清除率和不同层样品对DPPH 自由基清除能力的EC50值。实验中以抗坏血酸和BHA 的EC50值作为对照来研究其DPPH 自由基清除能力。
1.2.5 亚铁离子螯合作用
金属离子螯合实验方法根据Dinis 等[11]所述。将各层样品配制成一定浓度梯度溶液,取待测样品1 mL,依次加入80% 乙醇0.8 mL,2 mmol/L 的FeCl2·4H2O 0.1 mL,5 mmol/L 的Ferrozine 试剂0.1 mL,在室温下反应10 min 后在562 nm 下测吸光度值。对照组待测样品用乙醇代替,其他条件不变。螯合作用按下式计算:
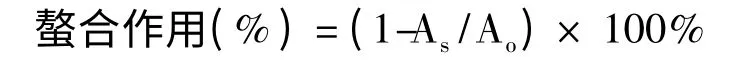
其中:As为待测溶液的吸光度;Ao为对照组溶液的吸光度。实验中用50 μg/mL 的EDTA 的螯合作用作对照。
1.2.6 还原能力测定
还原力测定方法依据Singh 和Rajini[12]所述。将各层配制成一系列浓度梯度的溶液,分别移取各浓度的待测样品0.2 mL 于试管中,加入磷酸缓冲液(pH 6.6)0.5 mL,再加入1%铁氰化钾溶液0.5 mL,在50 ℃下反应30 min。然后加入10% 三氯乙酸溶液0.5 mL 充分混和均匀,3000 rpm 下离心10 min。移取上清液0.5 mL 于试管中,加入0.5 mL 蒸馏水,再加入0.1% 三氯化铁0.1 mL,常温下反应5 min,然后使用紫外可见分光光度计于700 nm 波长下测定吸光度值。同时做对照组,将0.2 mL 的待测样品用蒸馏水代替,其他条件不变。
根据各反应组吸光度值的大小评价翼蓼块根各层的抗氧化能力,吸光度值越高表示还原能力越强。
1.2.7 ACE 活性抑制率测定
ACE 活性抑制实验方法根据Serra[13]所述,略做修改。分别将PGM、PGW、PGB、PGE 配制成浓度为1000 μg/mL 和500 μg/mL 的溶液。在2 mL 的离心管中加入50 μL 待测样品溶液和200 μL 5 mmol HHL (含有0.3 mol/L pH 8.3 硼酸盐缓冲液)。在37 ℃下恒温水浴5 min,然后加入50 μL 0.4 U/mL ACE 启动反应,继续在37 ℃恒温保持30 min,然后加入0.2 mL 1 mol/L 的HCl 终止反应,再加入1.2 mL 冰冷的乙酸乙酯,用力振荡混匀后在3500 rpm 下离心5 min,取出0.8 mL 酯层移入试管中,85 ℃烘干1 h,加入4 mL 的蒸馏水振荡2 min 溶解马尿酸,在228 nm 下测定吸光度值。对照组不加入待测样品溶液,空白组在反应前先加入0.2 mL 1 mol/L 的HCl 以终止反应,其他条件不变。同等条件下以100 μg/mL 卡托普利(Captopril)为阳性参考物。根据吸光度值计算出ACE 的抑制率。ACE 抑制率计算公式如下:
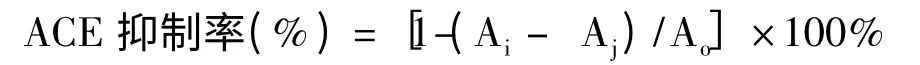
其中:Ao为对照组的吸光度;Ai为实验组的吸光度;Aj为空白组的吸光度。
2 结果与讨论
2.1 总酚与总黄酮含量测定结果及分析
将各层待测样品配制成浓度为1000 μg/mL 的溶液,分别测定其在725 nm 处和在415 nm 处的吸光度。结果表明各层总酚含量和总黄酮含量均存在一定差异(如表1)。翼蓼各层总酚含量以没食子酸等效物表示,结果表明:PGE 层总酚含量最高,PGW层含量次之,PGM 层含量最少;总黄酮的含量以槲皮素等效物表示,结果表明:PGE 层总黄酮含量相对较高,PGB 层含量最少。
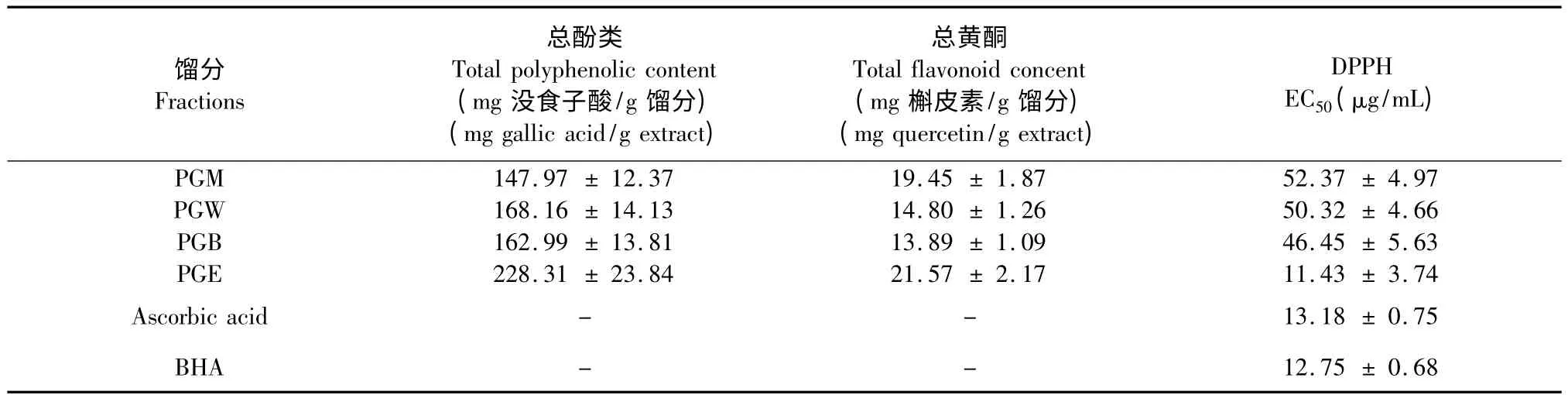
表1 不同提取物的总酚含量、总黄酮含量及清除DPPH 自由基的EC50值Table 1 The total phenol and flavonoid content of four extracts and the EC50value of DPPH· scavenging tests
2.2 DPPH 自由基清除能力的测定结果及分析
对各层待测样品的DPPH 自由基清除率的测定结果(如图1)、EC50值(表1)进行对比分析,可反映其抗氧化活性方面的价值。各层的DPPH 自由基清除能力总体上均随浓度增加而增强,但随浓度变化的趋势不同。低浓度时,PGM、PGW、PGB 随浓度增加,清除率变化不明显,而PGE 在低浓度时就有很大清除率,从10 μg/mL 到100 μg/mL,增长均在100%以上。EC50值越小,其抗氧化活性越强。各层的EC50值表明:PGE 萃取物的EC50值最小,抗氧化活性能力最强,PGB、PGW、PGW 抗氧化活性能力依次减弱。作为对照的抗氧化剂L-Ascorbic acid 和BHA 的EC50值分别是13.18 μg/mL 和12.75 μg/mL。而PGE 层的EC50值为11.43 μg/mL,低于所选取的标准品,说明该层具有较好的DPPH 自由基清除能力。总体上来说,以上各层的DPPH 自由基清除能力都很强,有很重要的研究价值。
2.3 亚铁离子螯合作用结果及分析
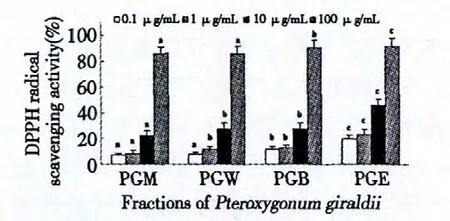
图1 翼蓼块根不同溶剂提取物的DPPH 自由基清除能力Fig.1 DPPH free radical scavenging activity of the different extracts from P.giraldii root
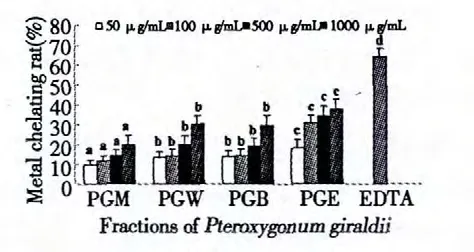
图2 翼蓼块根的不同溶剂提取物的亚铁离子螯合作用Fig.2 Ferrous ion chelating effects of methanol extract and its solvent fractions of P.giraldii and positive control EDTA
翼蓼块根的甲醇提取物和各有机溶剂组分的Fe2+螯合作用数据如图2 所示,随着浓度增加(50、100、500、1000 μg/mL),螯合作用增强,呈现出一定的浓度依赖性。其中,当浓度为100 μg/mL 时,PGE的螯合作用为31.01%,由数据可以看出翼蓼(PG)根的PGE 层具有最强的Fe2+螯合作用。然而,对比抗氧化剂EDTA(50 μg/mL)的64.35%的螯合作用明显较低。
2.4 还原能力测定结果及分析
吸光度值的高低可以间接反应抗氧化剂还原能力的大小[9]。由图3 可以看出,各层的吸光度值均随其浓度增加而增大,因此其还原能力也随其浓度增加而增强。同广泛使用的相应浓度的抗氧化剂BHA 对比分析可以看出,各层均表现出较好的还原能力,具有较强的抗氧化活性。
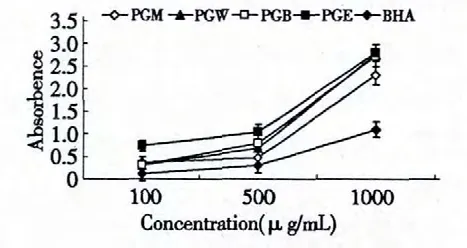
图3 翼蓼块根的不同溶剂提取物的还原力测定Fig.3 Reducing power of methanol extract and its solvent fractions of P.giraldii and BHA
2.5 ACE 抑制率测定结果及分析
实验结果显示,当待测样品浓度为1000 μg/mL和500 μg/mL 时,ACE 抑制率分别为(如图4 所示):PGE 为39.76%和35.37%,PGM 为39.45%和20.80%,PGB 为35.47%和32.21%,而标准品卡托普利(100 μg/mL)的抑制率为41.96%。对比数据可发现,当浓度为1000 μg/mL 时,PGE 和PGM 的抑制活性最好,接近标准品。
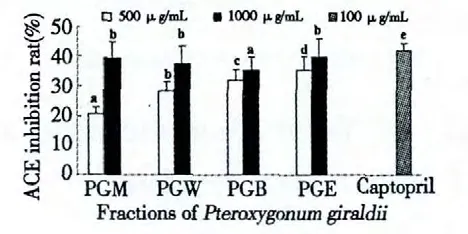
图4 翼蓼块根不同溶剂提取物的ACE 抑制活性Fig.4 ACE inhibitory activity of methanol extract and its solvent fractions of P.giraldii
3 结论
通过数据对比发现:翼蓼块根的总酚和总黄酮含量与其抗氧化活性呈正相关,在PGE 层表现尤为明显,其DPPH 自由基清除能力最强,金属离子螯合能力和还原能力也均比其它层强,与总酚和类酮含量呈现出明显的正相关,PGE 层的ACE 抑制活性略高于PGM 层,这与它们具有接近的类黄酮含量相关。究竟ACE 抑制活性与提取物中的抗氧化成分二者间的作用机理,尚需要进一步的研究和阐述,特别是PGE 层,富含黄酮类物质,其抑制ACE 活性与黄酮类成分的关系,均值得进一步研究。
本实验通过体外评价的方法,从不同的角度初步评估了翼蓼块根提取物体外抗氧化的能力,并研究了其抑制ACE 活性的能力,初步判断了抗氧化能力与抑制ACE 活性及总酚、总黄酮含量含量的相关性,但是,在翼蓼块根提取物中起到抑制ACE 活性的黄酮类化合物成分,还需要在活性实验的指导下,进一步分离纯化。该实验结果为今后活性化合物的研究与开发提供了理论依据和基础。
1 Gong JN(宫江宁),Zheng KL(郑奎玲),Liao LL(廖莉玲).7 种黔产补益类中草药抗氧化性的研究.J Sichuan Normal Univ (四川师范大学学报),2012,35:117-121.
2 Ma,SJ.Inhibitory effect of onion seasoning on angiotensin converting enzyme.J Kor Soc Food Sci Nutr,2000,29:395-400.
3 Chai X,Su YF,Zhang J,et al.A new triterpene and phenolic compounds from the roots of Pteroxygonum giraldii.Helv Chim Acta,2012,95:127-133.
4 Gao YH,Su YF,Yan SL,et al.Hexaoxygenated flavonoids from Pteroxygonum giraldii.Nat Prod Commun,2010,5:223-226.
5 Soodabeh S,Mohammad A.Antioxidants:Friends or foe in prevention or treatment of cancer:The debate of the century.Toxi Appl Pharm,2013,271:49-63.
6 Li XG (李旭光),Piao JJ(朴金建).银杏叶黄酮扩血管机理的探讨.J Med Coll Jimusi (佳木斯医学院学报),1998,21(2):50.
7 Zhu F (朱福),Zhang MS (章茂顺),Wang JL (王家良),et al.醋柳总黄酮对家兔血管紧张素转换酶的抑制作用.Chin J Clin Pharm (中国临床药学杂志),2000,2:95-98.
8 Ragazzi E,Veronese G.Quantitative analysis of phenolic compounds after thin layer chromatographic separation.J Chromatogr,1973,77:369-375.
9 Park YK,Koo MH,Ikegaki M,et al.Comparison of the flavonoid aglycone contents of Apismellifera propolis from various regions of Brazil.Arq Biol Technol,1997,40:97-106.
10 Yen,GC,Chen HY.Antioxidant activity of various tea extracts in relation to their antimutagenicity.J Agar Food Chem,1995,43:27-37.
11 Dinis TCP,Madeira VMC,Almeida LM.Action of phenolic derivatives (acetaminophen,salicylate,and 5-aminosalicylate)as inhibitors of membrane lipid peroxidation and as peroxyl radical scavengers.Arch Biochem Biophys,1994,315:161-169.
12 Singh N,Rajini PS.Free radical scavenging activity of an aqueous extract of potato peel.Food Chem,2004,85:611-616.
13 Serra CP,Cortes SF,Lombradi JA,et al.Validation of a colorimetric assay for the in vitro screening of inhibitors of angiotensin-convertingenzyme(ACE)fromplantsextracts.Phytomedicine,2005,12:424-432.
