皇菊不同部位挥发油化学成分比较分析
2015-01-08胡文杰邱修明曾建军邱道贇丁志伟
胡文杰,邱修明,曾建军,李 晨,邱道贇,丁志伟
井冈山大学生命科学学院,吉安 343009
植物挥发油是植物体内的次生代谢物质,由分子量相对较小的简单化合物组成,具有一定芳香气味,在常温下能挥发的油状液体物质[1]。该物质所含化学成分比较复杂,按其化学结构的不同可分为脂肪族、芳香族和萜类三大类化合物以及它们的含氧衍生物如醇、醛、酮、酸、醚、酯等,此外还有含氮和含硫的化合物,这些化合物均有沸点低且易挥发的特点[2]。
植物挥发油几乎没有毒副作用,因此被广泛的应用在医药、食品、化妆品等行业。近年来,国内外学者对植物挥发油的研究主要集中在医药保健、食品工业、抗菌、害虫防治及果蔬保鲜等[3-6]方面。因此,随着医药、食品、化妆品等行业的飞速发展,研究植物挥发油有着重要的现实意义。
菊花(Chrysanthemum morifolium)为菊科植物菊花的干状头状花序,是我国的传统名花[7]。该植物集观赏、食用和保健等一身,具有巨大的开发利用价值。皇菊属菊科菊属多年生草本植物,是我国传统的常用中药材之一。据文献记载,皇菊味甘苦,性微寒,有散风清热、清肝明目和解毒消炎等作用,对口干、火旺、目涩,或由风、寒、湿引起的肢体疼痛、麻木的疾病均有一定的疗效[8]。目前,有关皇菊的研究仅仅集中在化学成分[8]和繁育[9]方面,但现有化学成分的研究尚未从皇菊不同部位挥发油的化学成分方面进行系统的比较分析。为了能够更好地了解和研究皇菊挥发油成分,开发其实用价值,本实验以水蒸汽蒸馏法提取其不同部位挥发油,通过气相色谱-质谱联用技术进行分析鉴定其化学成分,以期找出皇菊不同部位挥发油化学组成及含量间的内在联系,为其资源开发利用提供科学依据。
1 材料与方法
1.1 材料
研究材料采自井冈山大学生物园,随机选取3棵作为本试验样株,植株生长状态良好,无病虫害。
1.2 方法
1.2.1 样品采集及处理
于2014 年10 月下旬,将3 株皇菊整株植株挖出,深度为根系分布所达范围。洗净泥沙并晾干植株表面水分后,将每棵样株分别分为叶、茎、根和花4 个部位。将茎和根切碎。每样株分别各部位称取鲜重后,用封口袋分别装好,用于提取挥发油。
1.2.2 挥发油提取
精确称取上述样品各200 g,采用水蒸汽蒸馏法提取其挥发油,收集挥发油,分别密封避光冷藏备用。
1.2.3 分析样品制备
把3 棵样株同一部位提取的挥发油,用移液器等量吸取并充分混合后,作为皇菊该部位挥发油成分分析测定的试验样品,用于GC-MS 检测。
1.2.4 GC-MS 分析
采用Perkin Elmer Clarus 680 型气相色谱-质谱联用仪,色谱柱为Elite-5 MS 石英毛细管柱(30 m× 0.25 mm × 0.25 μm);色谱条件:起始柱温50℃,保持5 min;以3 ℃/min 速度升温至140 ℃,再以10 ℃/ min 升至260 ℃保持10 min。载气为氦气,流量为1.0 mL/min,分流比10∶1,进样量:0.5 μL;质谱条件:EI 源,离子源温度180 ℃,接口温度:260 ℃,扫描范围(m/z)50~620。
2 结果与分析
2.1 皇菊不同部位挥发油平均得率
皇菊叶、茎、根和花4 个不同部位挥发油的得率(质量分数)有所差异,叶0.23%、茎0.17%、根0.31%和花0.53%。其中花的平均得油率最高,为0.53%,其次是根,最低的是茎,仅为0.17%。各部位平均得率的大小排序为:花、根、叶、茎。这一结果可为皇菊挥发油原料采集部位的选择和经营管理措施提供重要依据。
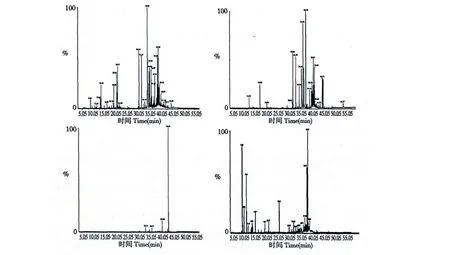
图1 皇菊叶(A)、茎(B)、根(C)及花(D)的挥发油总离子流图Fig.1 The total ion chromatogram of essential oils of leaf (A),stem (B),root (C)and flower (D)from Imperial Chrysanthemum
2.2 皇菊不同部位挥发油化学成分分析比较
皇菊 叶、茎、根和花4 个不同部位挥发油成分检测的总离子流图见图1。经检索、解析和文献查对,本实验从皇菊4 个不同部位挥发油中共鉴定出90 种化学成分(表1),包括烃类化合物48 种、醇类化合物29 种、酮类化合物4 种、酯类化合物3 种、氧化物类化合物3 种及醛类化合物2 种。通过分析比较,发现皇菊4 个不同部位挥发油化学成分组成差异显著,4 个不同部位挥发油中共同含有化学成分3种,这3 种成分只集中在烃类化合物中,其他类化合物没有共同成分。此外,还检测到一些特有的化学成分,如叶特有化学成分18 种,其中烃类7 种[β-侧柏烯、邻伞花烃、γ-松油烯、3-亚甲基-1,5,5-三甲基环己烯、水化梨松烯、可巴烯和(2)-氧化香橙烯];醇类5 种[(-)-反式一松香芹醇、龙脑、(-)-异长叶醇、α-毕橙茄醇和红没药醇];酮类2 种(樟脑和长叶松香芹酮);酯类1 种(新戊酸-6-酯);氧化物类1种[喇叭烯氧化物(II)];醛类2 种(水芹醛和十六醛)。茎特有化学成分7 种,其中烃类4 种{(+)-4-蒈烯、1,2,3,4,5,6,7,8-八氢-1,4-二甲基-7-(1-甲基乙烯基)-,[1s-(1á,4á,7á)]-甘菊环、顺-Z-α-环氧没药烯和α-愈创烯};醇类3 种(T-杜松醇、葎草烯-1,6-二烯醇和2-烯-十二醇)。根特有化学成分10种,其中烃类3 种(环氧化蛇麻烯II、1,10-十一二烯和顺式-α-香柑油烯);醇类5 种[β-桉叶油醇、1-(苯基乙炔基)-1-环己醇、甘桔环烯醇、反式-2-十一烯-1-醇和香叶基香叶醇];酮类1 种(2-羟基-3-丁烯基-1,4-萘二酮);酯类1 种(乙酸龙脑酯)。花特有化学成分20 种,其中烃类14 种[α-水芹烯、蒎烯、α-蒎烯、β-蒎烯、萜品油烯、(+)-柠檬烯、γ-萜品烯、紫罗烯、Di-epi-α-柏木烯、环氧异香橙烯、愈创木烯、1,12-十三碳二烯、1,2,3,6-四甲基双环[2.2.2]-2-辛烯和1,E 11,Z 13 十七碳三烯];醇类6 种(喇叭茶醇、桉油烯醇、兰桉醇、表蓝桉醇、反式长松香芹醇和长松香芹醇)。此外,各部位已鉴定成分的挥发油含量分别占各部位挥发油总含量的 86.49%、95.27%、84.4%、95.27% 和85.39%。
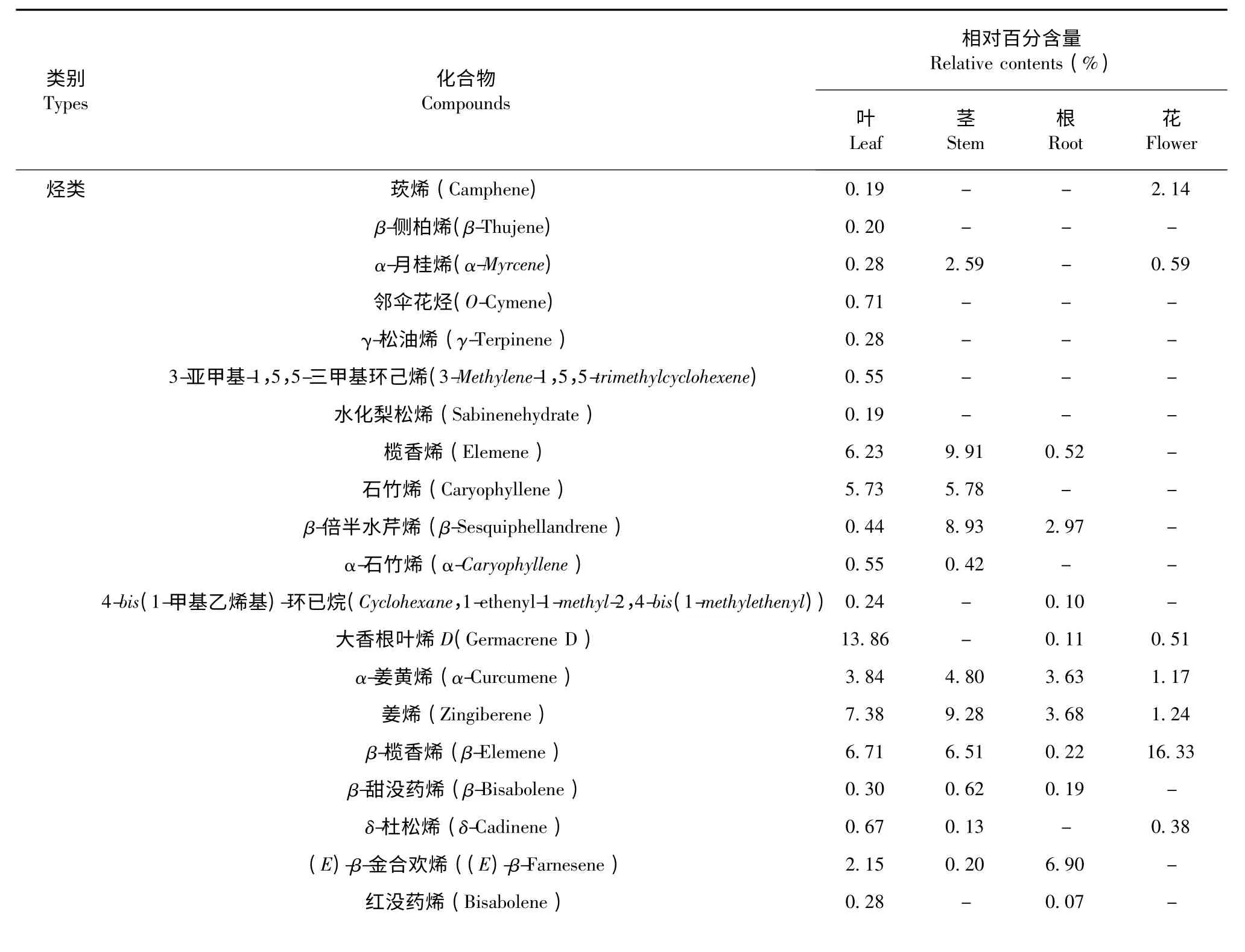
表1 皇菊不同部位挥发油成分及其相对含量Table 1 The components and their contents from essential oil of different parts of Imperial Chrysanthemum

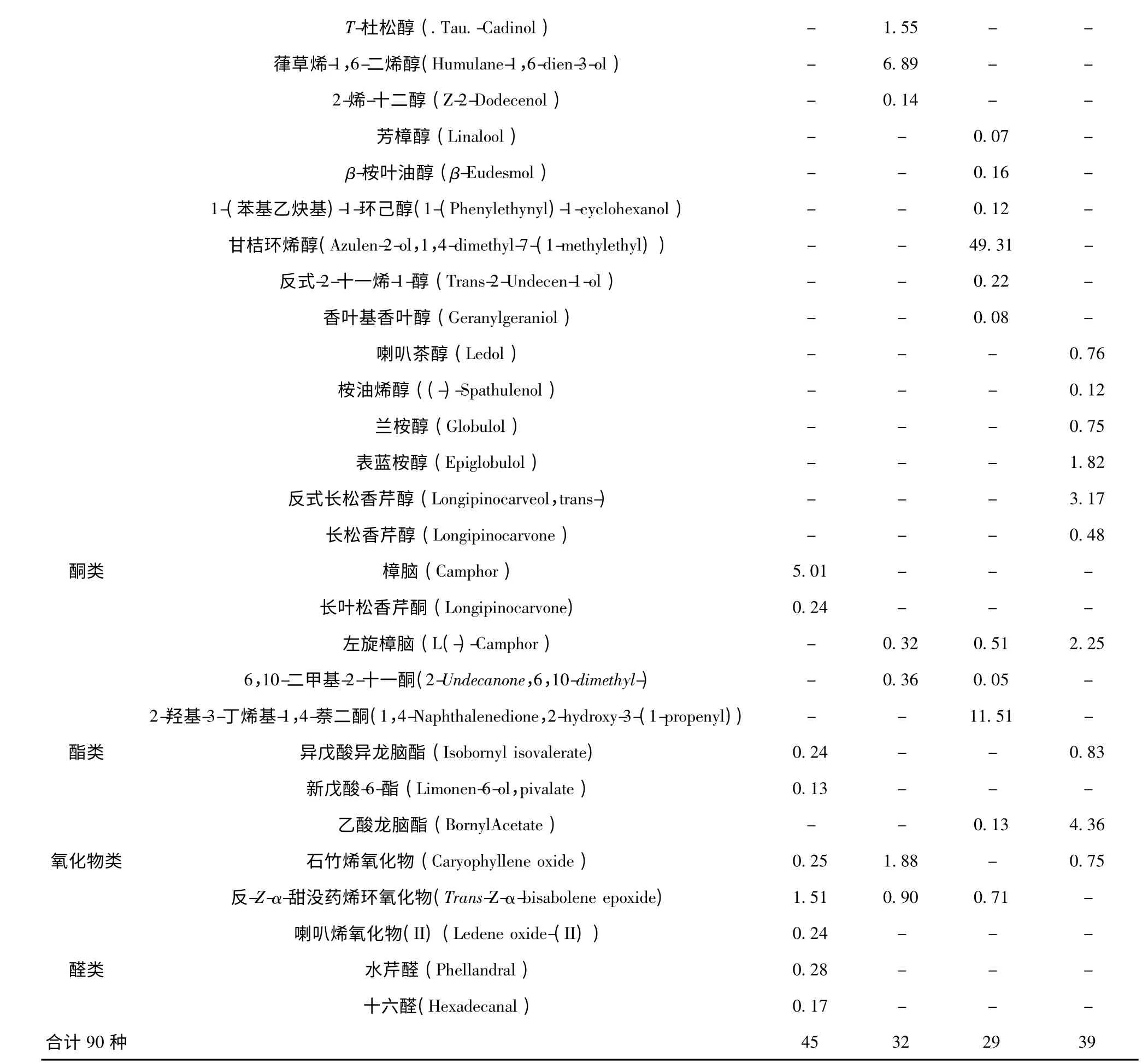
注:“-”表示未检测,下同。Note:“-”indicated not detected,same as below.
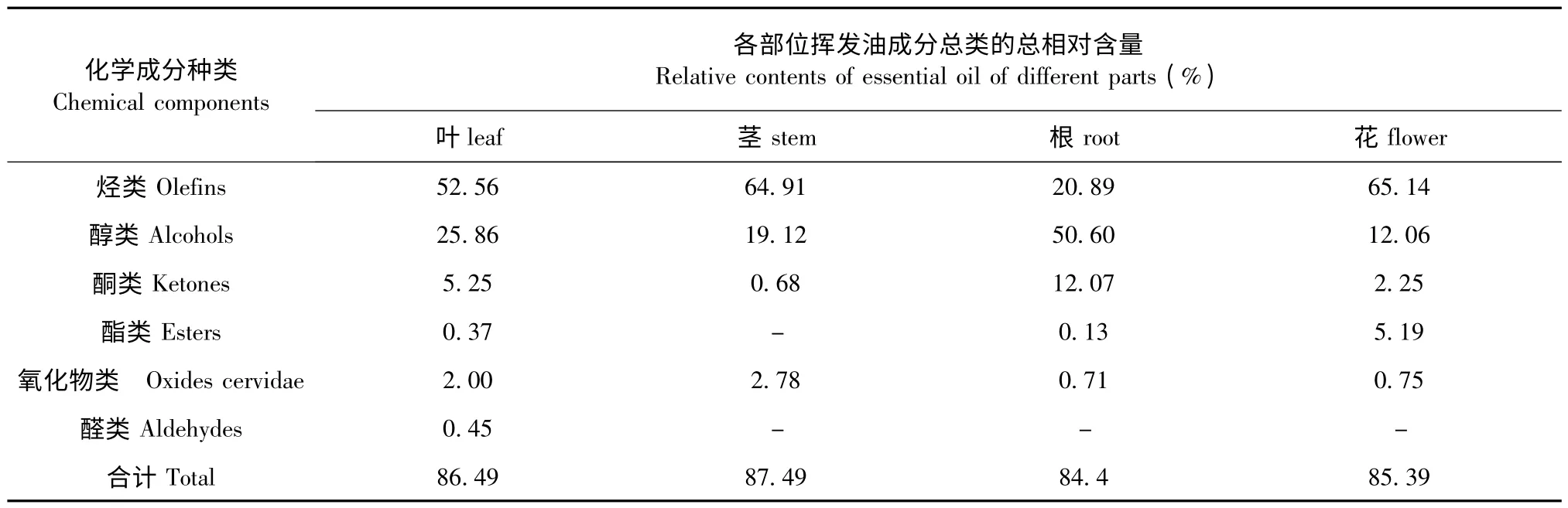
表2 皇菊不同部位挥发油化学成分种类及其总相对含量Table 2 Chemical components and their total contents from essential oil of different parts of Imperial Chrysanthemum
2.2.1 烃类化合物
皇菊4 个不同部位挥发油中烃类种类数和烃类物质总的相对含量差异较显著。从皇菊叶、茎、根和花4 个不同部位挥发油中各鉴定出烃类化合物24、18、14 和25 种。可知,叶和花的烃类化合物种类数量只相差1 种,与茎和根中烃类化合物种类数量相差较大。皇菊各部位挥发油中烃类物质总相对含量在20.89%~65.14%波动;花挥发油中的烃类化合物相对含量较高,为65.14%;茎次之,为64.91%;根最低,达20.89%,可见各部位间烃类化合物总相对含量差别较大。在烃类化合物中,β-榄香烯在皇菊4 个不同部位挥发油中总百分含量最高,达29.77%,其次是姜烯(21.58%),最低的是α-水芹烯(0.07%)。从这些化学成分的类别和结构上来看,皇菊4 个不同部位挥发油中烃类化学物多属于C10~C17的烃类。
2.2.2 醇类化合物
皇菊叶、茎、根和花4 个不同部位挥发油中的醇类化合物种类数量有差异。各部位挥发油中醇类化合物分别为12、10、10 和10 种。茎、根和花的醇类化合物种类数量相等,各为10 种;叶中最多,为12种。皇菊不同部位挥发油中醇类化合物总相对含量差异较显著。各部位挥发油中醇类物质总相对含量在12.06%~50.60%波动;其中叶和根的总相对含量均达到了25%以上。在醇类化合物中,甘桔环烯醇为绝对主导成分(49.31%),这种成分只在根挥发油中含有,而其他部位挥发油中尚未检测到。
2.2.3 酮类化合物
从皇菊叶、茎、根和花4 个不同部位挥发油中共鉴定出5 种酮类物质。各部位间的酮类化合物种类数量分别为2、2、3 和1 种,其中叶和茎酮类物质种类数量相等。皇菊叶、茎、根和花4 个不同部位挥发油中酮类化合物的含量分别为5.25%、0.68%、12.07%和2.25%。其中酮类化合物含量最高的部位是根(12.07%),其次是叶(5.25%),最低是在茎(0.68%)。根含有的酮类化合物含量是茎的17.75 倍。
2.2.4 酯类化合物
从皇菊叶、茎、根和花4 个不同部位挥发油中共鉴定出3 种酯类物质,分别为异戊酸异龙脑酯、新戊酸-6-酯和乙酸龙脑酯。不同部位的酯类化合物种类数量略有差异。各部位的酯类化合物种类数量分别为2、0、1 和2 种,其中叶和花相等,各为2 种,新戊酸-6-酯只在叶挥发油中检测到,而其他部位尚未检测到。茎挥发油中均未检测到异戊酸异龙脑酯、新戊酸-6-酯和乙酸龙脑酯3 种酯类物质。
2.2.5 氧化物类化合物
从皇菊叶、茎、根和花4 个不同部位挥发油中鉴定出3 种氧化物类化合物,分别为石竹烯氧化物、反-Z-α-甜没药烯环氧化物和喇叭烯氧化物(2)。各部位氧化物类化合物种类数量有所差异,分别为:3、2、1 和1 种,其中根和花的氧化物种类数量相等,各为1 种。叶挥发油中均检测到石竹烯氧化物、反-Z-α-甜没药烯环氧化物和喇叭烯氧化物(2)3 种化合物,但其含量有所差异,分别为0.25%、1.51%和0.24%。
2.2.6 醛类化合物
皇菊叶、茎、根和花4 个不同部位挥发油中醛类物质种类数有所差异。不同部位挥发油中醛类物质分别为:2、0、0 和0 种;叶中醛类化合物种类数最多,为2 种;茎、根和花中尚未检测到。皇菊不同部位挥发油中醛类化合物总相对百分含量差异显著。各部位挥发油中醛类物质总百分含量在0~0.45%波动。
3 讨论
按照花瓣颜色分类,皇菊属于黄菊的一种。本实验所检测到的皇菊花挥发油的化学成分与前人对产于浙江桐乡[10]的小黄菊鲜花挥发油的化学成分分析的结果有较大差异,仅有11 种共同成分,其中烃类6 种,分别为α-蒎烯、莰烯、α-水芹烯、γ-萜品烯、(+)-柠檬烯、α-姜黄烯;醇类3 种,分别为1,8-桉树脑、橙花叔醇、4-萜烯醇;酯类和氧化物类各有1 种,即乙酸龙脑酯和石竹烯氧化物。除此之外,本实验新分离出的化合物有28 种,其中烃类化合物有19 种,分别为α-月桂烯、大香根叶烯D、姜烯、β-榄香烯、δ-杜松烯、香树烯、反式-α-香柑油烯、顺式-β-金合欢烯、(-)-异丁香烯、蒎烯、β-蒎烯、萜品油烯、紫罗烯、Di-epi-α-柏木烯、环氧异香橙烯、愈创木烯、1,12-十三碳二烯、1,2,3,6-四甲基双环[2.2.2]-2-辛烯和1,E-11,Z-13-十七碳三烯;醇类化合物有7种,分别为α-松油醇、喇叭茶醇、桉油烯醇、兰桉醇、表蓝桉醇、反式长松香芹醇和长松香芹醇;酮类化合物1 种,仅为左旋樟脑;酯类化合物1 种,即异戊酸异龙脑酯。这些差异可能与皇菊的产地、气候、生长环境、采集时间以及提取条件有密切的关系,有待于进一步研究。
皇菊不同部位均含有挥发油,挥发油中的化学成分基本为单萜烯类、倍半萜烯类及其含氧衍生物等。这些成分可用于香精香料、保健和医药等,具有重要的开发利用价值,尤其是皇菊挥发油中含量较高的樟脑、β-榄香烯、姜烯和α-红没药醇等化合物,其用途非常广。如樟脑是世界上最早被使用的天然有机化学成分之一,应用广泛,有兴奋、强心、消炎、镇痛、抗菌、止咳、促渗、杀螨等药理作用[11,12];β-榄香烯对肝癌HePG2细胞[13]、胃癌[14]、乳腺癌[15]等有较好的抑制作用;姜烯具有抗病毒、杀虫剂等[16]多种活性,广泛用于化妆品等多种行业[17];α-红没药醇具有消炎、灭菌、愈合溃疡、溶解胆石等药效,故红没药醇在医药行业中的用途较广[18]。除此之外,皇菊挥发油中还有许多其他成分,这些成分的功效如何,有待于进一步研究。
4 结论
从皇菊叶、茎、根和花挥发油中分别鉴定出45、32、29 和39 种化合物,共鉴定出90 种化学成分,包括烃类(48 种)、醇类(29 种)、酮类(4 种)、酯类(3种)、氧化物类(3 种)及醛类(2 种)化合物,他们之间的共有成分有3 种,这3 种成分只集中在烃类化合物中,其他类化合物没有共同成分。此外,还检测到一些特有的化学成分,叶(18 种)、茎(7 种)、根(10 种)和花(20 种)。本研究可为皇菊的进一步开发利用提供了一定的参考依据。
1 Xu TN(徐娜婷).Researches on composition,antimicrobialactivity and-loquat's preservation of the volatile oil from Liquidambar formosana Hance leaves.Chongqing:Southwest University (西南大学),MSc.2013.
2 Zhang DF(张东峰).Mica powder in environmental protection anticorrosion coating application mechanism discussion.Hebei Chem Eng (河北化工),2008,31(2):10-12.
3 Saddi M,Sanna A,et al.Antiherpevirus activity of Artemisia arborescens essential oil and inhibition of lateral diffusion in Vero cells.Ann Clin Microbiol Antimicrob,2007,6:113-119.
4 Smith PA,Stewart J,Fyfe L,et al.The potential application of plant essential oils as natural food preservatives in soft cheese.Food Microbiol,2001,18:463-470.
5 Aysun O,Ayse E,Munevver S,et al.Antitumoral and antioxidant effect of essential oils and in vitro antioxidant properties of essential oils and aqueous extracts from Salvia pisidica.Biologia,2010,65:990-996.
6 Cao SF,Zheng YH,et al.Methyl jasmonate reduces chilling injury and enhances antioxidant enzyme activity in postharvest loquat fruit.Food Chem,2009,115:1458-1463.
7 Zhang Y(张辕).Studies on the identification and classification of Chinese traditional chrysanthemum cultivars based on three types of markers.Beijing:Beijing Forestry University(北京林业大学),PhD.2014.
8 Liu YS(刘玉珊),Xu ZH(许震寰),Liu J (刘静),et al.Analysis of the beneficial components and edibility of the Imperial Chrysanthemum.J Anhui Agric Sci (安徽农业科学),2014,42:10905-10906.
9 Wang Q (王琪),Zhang XQ (张旭庆),Wang HL(王红莉),et al.Imperial chrysanthemum factory nursery technology.Chin Horticul Abstr(中国园艺文摘),2013,9:161.
10 Wang MX (王梦馨),Shen XG (沈学根),Zhou JS (周建松),et al.Analysis on chemical components of essential oils from fresh flowers and manufactured goods of Chrysanthemum cultivar Dendrathem agrandiflorum ‘Xiao Huang’Ju in Tongxiang City of Zhejiang Province.Acta Agric Zhejiangensis(浙江农业学报),2014,26:900-907.
11 Smith AG,Margolis G.Camphor poisoning:anatomical and pharmacologic study;report of a fatal case;experimental investigation of protective action of barbiturate.Am J Pathol,1954,30:857-868.
12 Manoguera AS,Erdman AR,Wax PM,et al.A merican association of poison control centers.camphor poisoning:an evidence-based practice guideline for Out-of-Hospital management.Clini Toxicol,2006,44:357-370.
13 Zhang JL,Mao YQ,Li H,et al.The effect of beta-elemene on alpha-tubulin polymerrization in human hepatom a HepG2cells.Chin J Cancer Res,2013,25:770-776.
14 Yan B,Zhou Y,Feng S,et al.Beta-elemene-attenuated tumor angiogenesis by targeting notch-1 in gastric cancer stem-like cells.eCAM,2013,2013:1-12.
15 Zhang X,Li Y,Zhang Y,et al.Beta-elemene blocks epithelial mesenchym altran sition in human breast cancer cell line MCF-7 through Smad3-9 mediated down-regulation of nuclear tra nscription factors.PLoS One,2013,8(3):e58719.
16 Jocelyn GM.Rapid and simple isolation of zingiberene from ginger essential oil.J Nat Prod,1998,61:1025-1026.
17 Carter CD,Sacalis JN,Gianfagna TJ.Zingiberene and resistance to Colorado potato beetle in Lycopersicon hirsutum f.hirsutum.J Agric Food Chem,1989,37:206-210.
18 Huang R (黄瑞),Zhang JS (张建水),et al.Progress in synthesis of bisabolol and iso-bisabolol.J Shanghai Inst Tech(上海应用技术学学报),2012,12:141-146.
