牛粪中纤维素降解菌的分离鉴定及其产酶研究
2015-01-08汪学军闵长莉韩彭磊张丽君
汪学军,闵长莉,韩彭磊,张丽君
1皖西学院生物与制药工程学院;2 皖西学院大别山植物内生菌资源研究中心,六安 237012
近年来,随着我国畜牧业规模化和集约化的迅速发展,畜禽粪便的产生量也大大增加,已经成为农业固体有机废弃物的主要生产源。研究发现,畜禽粪便中富含有机质和氮、磷、钾等元素,可以成为再利用的资源[1],但是由于畜禽粪便中纤维素与木质素含量高且难以分解利用而被丢弃,从而成为污染源造成环境的污染及资源的浪费[2-4]。因此,如何合理的处理和利用这些畜禽粪便,在不造成环境污染的情况下,又将其转化为可再生性的资源已成为目前研究的热点,国内外学者对于微生物能分解转化纤维素的有关研究相当重视[5,6]。从蚯蚓养殖场泥土中分离筛选出一株纤维素酶高产菌株,研究发现氨化预处理可提高该菌株对玉米秸秆的降解率,经鉴定其属于枯草芽孢杆菌[7]。杨莹等从牛粪自然堆肥中分离筛选出2 株降解纤维素能力较强的菌株,初步鉴定其均为曲霉属真菌,实验结果表明,这两株真菌可作为降解畜禽粪便发酵剂的优良生产菌株,且棉粕是较为理想的固体发酵氮源[8]。许玉林等用刚果红染色法从甘蔗地土壤中分离得到一株具有较强纤维素降解能力的真菌,经鉴定该菌株属于草酸青霉,其对天然的滤纸降解率较高,在3 d 内对滤纸的降解率为32.95%[9]。高云航等从新鲜牛粪样品中筛选得到1 株产酶活较高的纤维素分解菌,经鉴定其为短小芽孢杆菌,产酶条件优化结果表明,该菌株以0.5%玉米粉为碳源、1%酵母粉为氮源、初始pH 3.0、42 ℃摇瓶培养54 h 产酶活最高[10]。由此可见,若将这些纤维素分解菌应用于畜禽废弃物进行无害化处理,可为解决环境污染与资源浪费等问题提供一条可行的途径。
目前,对于纤维素分解菌选育应用研究较多的是真菌与细菌,尤以曲霉、木霉和青霉为典型,而对放线菌的研究报道较少。本实验从新鲜牛粪样品中分离筛选出一株具有较强纤维素分解能力的菌株NF38,通过生理生化特征研究、形态学和16S rDNA生物学手段对其分类鉴定,并对菌株NF38 产酶条件进行了初步研究,以期为纤维素分解菌株的研究奠定一定的基础。
1 材料与方法
1.1 材料
1.1.1 牛粪样品
六安市亿牛乳业荷斯坦奶牛的新鲜粪便。
1.1.2 培养基
液体富集培养基(g/L):选择羧甲基纤维素钠为唯一碳源的培养基配方,即CMC-Na 10、FeSO4·7H2O 0.001、K2HPO41.0、MgSO4·7H2O 0.5、KCl 0.5、NaNO30.5、硫酸链霉素0.02;pH 7.2[11]。分离培养基(g/L):CMC-Na 10.0、FeSO4·7H2O 0.001、K2HPO41.0、MgSO4·7H2O 0.5、KCl 0.5、NaNO30.5、琼脂粉15.0;pH 7.2。纯化培养基:高氏Ⅰ号固体培养基。种子培养基:高氏Ⅰ号液体培养基。发酵培养基(g/L):CMC-Na 10、酵母浸出粉3.5、MgSO4·7H2O 0.5、轻质CaCO36.0、KH2PO40.1,pH 自然。
1.2 纤维素降解菌株的筛选
新鲜牛粪样品10 g 加入到装有90 mL 液体富集培养基的锥形瓶中进行富集培养,30 ℃震荡培养7 d。取富集后的培养液10 mL 接种至90 mL 液体富集培养基中,再次在同样的条件下进行富集培养。取后一次的富集培养液1 mL 按10 倍浓度梯度依次稀释至10-1、10-2、10-3、10-4、10-5;分别取稀释10-3、10-4、10-5富集液0.1 mL 至分离培养基平板上涂布均匀后,静置30 min 后,倒置于30 ℃恒温恒湿培养箱中培养10 d。采用划线法对分离平板上的放线菌菌株在纯化培养基平板上进行纯化至菌落纯的放线菌,对纯化得到菌株编号和保藏。
取上述纯化得到的放线菌菌株分别点种于分离培养基平板中央,30 ℃培养7 d 后,在每个培养平板中倒入0.1%的刚果红显色液15 mL,静置10 min倒去显色液,并用去离子水漂洗平板表面2~3 次,观察有无水解圈,并对菌落直径d 和水解圈直径D进行测量和记录。
1.3 菌株NF38 酶活力的测定
菌株NF38 接种到种子培养液中于30 ℃、150 rpm 震荡培养48 h 后,按5%的接种量转接于发酵培养基中继续培养7 d。收获的发酵液经10000 rpm离心5 min,所得到取上清即为粗酶液,保存备用。
在洁净的试管中加入1 mL 粗酶液和1.5 mL 的1% CMC-Na 磷酸缓冲液或者滤纸作为底物,在50℃水浴锅中保温30 min,然后迅速加入2.5 mL DNS并摇匀,使反应终止,沸水浴5 min,快速冷却后在波长为540 nm 下测定OD 值,分别测得测定纤维素酶酶活(CMCA)和滤纸酶酶活(FPA)[12]。酶活单位(IU)按国际单位定义为:1 mL 酶液1 min 产生1 mol 还原糖的酶量作为1 个酶活单位[12]。
1.4 菌株NF38 鉴定
1.4.1 菌株NF38 形态学特征和生理生化特征研究
在直径为90 mm 的培养平板上以划线法接种菌株NF38,培养后观察菌落大小、质地、颜色、色素有无等培养特征[13];而菌丝和孢子丝通过插片法加以培养后在显微镜下进行观察[14,15]。生理生化特征的研究方法参照文献进行研究并记录结果[16]。
1.4.2 菌株NF38 的16S rDNA 基因序列测定和系统发育分析
菌株NF38 的DNA 的提取和扩增参照文献方法进行[17,18]。16S rDNA 序列PCR 扩增采用保守引物27F (5'-AGTTTGATCMTGGCTCAG-3')和1492R(5'-GGTTACCTTGTTACGACTT-3')[19]。对 扩 增 产物进行测序,测序工作委托上海生工生物工程有限公司完成。测定后的序列进行基因登录号的申请、模式菌株的选取、相似性比较和统统发育树的构建[20]。
1.5 菌株NF38 产酶条件的研究
1.5.1 发酵温度对产酶的影响
接种有菌株NF38 的发酵培养基分别于10、20、25、30、35、40、50 ℃条件下进行震荡培养,摇床转速为150 rpm,培养7 d,测定CMCA 和FPA 酶活。
1.5.2 发酵初始pH 对产酶的影响
发酵培养基中加入数滴1 mol/L HCl 或1 mol/L NaOH,使其初始的pH 值分别为3.0、4.0、5.0、6.0、7.0、8.0、9.0 和10.0,接种菌株NF38 种子液后置于30 ℃,150 rpm 摇床震荡培养7 d,测定CMCA和FPA 酶活。
1.5.3 发酵时间对产酶的影响
接种菌株NF38 的发酵培培养基于30 ℃,150 rpm 摇床震荡培养,分别取3、4、5、6、7、8 d 和9 d 发酵液,测定CMCA 和FPA 酶活。
1.5.4 接种量对产酶的影响
发酵培养基中分别接种1%、5%、10%、15%、20%和30% 菌株NF38 种子液后置于30 ℃,150 rpm 摇床震荡培养7 d,测定CMCA 和FPA 酶活。
2 结果与分析
2.1 菌株的筛选
经过两次富集培养基的富集培养,淘汰了大部分不能利用CMC-Na 为唯一碳源的微生物,同时,在富集培养基中加入硫酸链霉素,又使得大部分细菌不能在其中生长筛选,使得筛选出具有纤维素降解放线菌的概率得到有效的提高。筛选得到放线菌NF38,显示出良好的纤维素降解能力,其水解圈直径D 和菌落直径d 分别为23.6 mm、1.3 mm,D/d值为18.1,测定酶活为32.4 U/mL,放线菌NF38 水解圈如图(图1)所示。根据以上的实验结果,选择NF38 为研究对象做进一步研究。
2.2 菌株NF38 鉴定
2.2.1 放线菌的形态特征
菌株NF38 在高氏Ⅰ号平板上培养7 d 后,菌落直径2~3 mm、白色隆起、边缘整齐光滑(图2)。气生菌丝白色、基内菌丝淡黄色;孢子丝为稍微的弯曲状,螺旋不明显,球形孢子链状排列在一起,孢子表面光滑、黄色。

图1 菌株NF38 刚果红水解圈Fig.1 Hydrolyzed circle of NF38 by Congo-red

图2 菌株NF38 菌落形态Fig.2 Colony morphology of strain NF38
2.2.2 菌株NF38 培养特征
菌株NF38 除了在营养琼脂上生长较差外,在其余培养平板上均生长良好,气生菌丝以乳白色为主,而基内菌丝的颜色多变,不同培养基表现出较大的差异性,在8 种不同培养基上具体培养特征见表1。

表1 菌株NF38 培养特征Table 1 The cultural characteristics of strain NF38
2.2.3 菌株NF38 生理生化特性
菌株NF38 特征中最为典型的是可以很好利用纤维素,革兰氏染色呈阳性;在10~45 ℃温度范围内生长正常,但最适生长温度为30~40 ℃之间,培养期间没有黑色素和H2S 的产生;菌株适宜生长pH为4.0~10.0 之间,最适生长pH 为7.4。
菌株NF38 对对碳源利用实验结果表明可以有效利用实验项目中多数碳源,显示出对碳源的利用谱较为广泛,但是,对肌醇和L-阿拉伯糖不能利用。菌株NF38 生理生化和碳源利用实验结果(表2)。

表2 菌株NF38 生理生化特征和碳源的利用情况Table 2 The physiological characteristics and carbon utilization of strain NF38
2.2.4 菌株NF38 16S rDNA 序列测定和系统发育树的构建
菌株NF38 的16S rDNA 扩增产物的长度为1443 bp,通过在Bankit 上在线提交菌株序列扩增方法、菌株来源等相关信息,获得的基因登录号为KF790691。菌株NF38 的16S rDNA 序列经Blastn比对结果表明,该菌株与GenBank 中浅紫链霉菌(Streptomyces violascens)(EU273550)序列同源性最高。核酸序列比对软件Clustal X(1.81)进行alignment,利用MEGA 6.02 软件包中的Kimura-2-Parameter Distance 模型计算进化距离,以Neighbor-Joining法构建系统发育树(图3),1000 次随机抽样计算自举支持率(Bootstrap),以评估系统发生树的置信度[21]。由图3 以看出菌株NF38 在进化树中与S.violascens(EU273550)亲缘关系最近,且处于同一分支上,同源性达到99%。
综合菌株NF38 形态学特征、碳源利用特征、生理生化特征和16S rDNA 序列的鉴定结果,将牛粪中获得将具有纤维素降解能力的菌株NF38 鉴定为浅紫链霉菌(S.violascens)。
2.3 菌株NF38 产酶条件的研究
2.3.1 发酵温度对产酶的影响
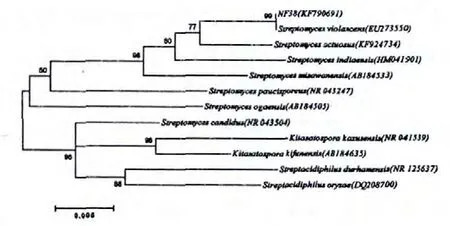
图3 菌株NF38 的系统发育树Fig.3 Phylogenetic tree of strain NF38
在不同温度发酵后收获的粗酶样品经测活后实验结果见图4A,纤维素酶酶活和滤纸酶酶活在30~40 ℃区间内酶的活性相对较高,其中,在35 ℃所产生CMCA 酶的活力最强32.4 U/mL,FPA 酶活为28.7 U/mL;但在40 ℃后急剧下降。这样的实验结果可能说明了该菌株长期生活在牛的肠道内,适应了肠道温度环境,属于体温微生物。
2.3.2 发酵初始pH 对产酶的影响
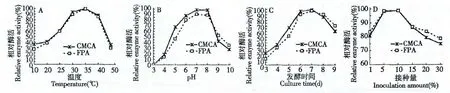
图4 温度(A)、pH(B)、发酵时间(C)及接种量(D)对菌株NF38 产酶活性的影响Fig.4 Effect of temperature (A),pH value (B),culture time (C)and inoculation amount (D)on cellulase production of strain NF38
在不同初始pH 值培养条件下收获的粗酶样品经测活后实验结果见图4B,纤维素酶酶活和滤纸酶酶活在pH 为7.0~8.0 范围内维持在一个较高水平上,酶活分别达到顶峰,但是pH >8.0 以后会出现酶的活性迅速下降的现象,这说明了菌株NF38在中性或者是偏碱性的条件下,最有利于酶的产生和保持较高的活性。
2.3.3 发酵时间对产酶的影响
在不同培养时间下收获的粗酶样品经测活后实验结果见图4C,菌株NF38 培养3 d 后,纤维素酶酶活和滤纸酶酶活分别仅为6.95、3.46 U/mL,酶的活性在第7 d 时,活性最高,随后逐渐降低。可能是因为放线菌生长较为缓慢,代谢产物积累是在菌体生长的基础之上,因此,需要较长的时间来才能达到最高;而之后会出现下降,是因为菌体生长进入衰亡期,一方面菌体衰老死亡,细胞裂解的副产物导致酶的活力下降,另一方面所产生的酶随着时间延长自身也会发生酶活下降现象。
2.3.4 接种量对产酶的影响
不同接种量经发酵后,所收获的粗酶样品经测活后实验结果见图4D,接种量在5%~10%范围内酶活基本保持在同一个较高水平。当接种量>10%时随接种量增加酶活相反呈下降趋势,可能是由于微生物的数量快速增加,发酵培养基中的营养成分被消耗并且已经不能满足酶的生物合成要求,导致酶还没有来得及合成或不是其合成最佳条件,因此出现酶活下降的现象。
3 讨论
随着我国集约化养殖业的扩大与人们环保意识的增强,将畜禽粪便进行堆肥化处理,是把这些废弃物变废为宝的有效途径[22]。传统的堆肥法是利用原料中的土著微生物来降解有机物质,但由于其耗时较长,易产生臭味,且堆肥成品具有肥效较低与养料价值不高等缺点[23]。故人们在发酵过程中往往接种一些功能微生物,以便解决上述问题。将纤维素降解菌添加到畜禽粪便中进行堆肥,使其有机物在功能微生物的作用下矿化与腐殖化,生产出生物有机肥[24,25]。这些生物有机肥施用农田后能起到改良土壤和增加肥效的作用[8],且能增加农作物的产量,对于自然生态环境的保护,推动生态农业的可持续发展具有非常重要的意义[26,27]。
本研究通过仅含有CMC-Na 为唯一碳源培养基进行筛选,根据透明圈的大小,从新鲜牛粪样品中筛选到1 株具有较强纤维素降解能力的放线菌菌株NF38,酶活测定结果表明其值为32.4 U/mL,酶活较高,可作为畜禽粪便无害化处理中的潜力菌株。此外,本研究还对菌株NF38 的产酶条件进行了研究,结果表明该菌株在温度范围为30~40 ℃区间内酶的活力相对较高(最适温度35 ℃);pH 范围为7.0~8.0 时其酶活维持在较高水平上(最适pH 为7.0);接种量在5%~10%区间时其酶活基本保持较高水平(最佳接种量为5%);发酵时间在第7 d时达到产酶高峰。
本研究结合生理生化特征研究、形态学和和16S rDNA 序列分析结果,鉴定菌株NF38 为浅紫链霉菌(Streptomyces violascens)。而已有的研究表明从放线菌中筛选到能产生纤维素酶的活性菌株还很少见有文献报道,目前仅有为数不多文献报道了放线菌能够产生纤维素酶的生物活性方面的研究,Waldron 等从土壤中分离得到一株产纤维素酶的放线菌Microbispora bispora,酶活为5.9 U/mL[28];冯海玮等等从水稻秸秆垛下土壤分离出一株能降解纤维素JSD-1 放线菌,产酶活性为59.19 U/mL[29]。这与本研究中发现的浅紫链霉菌可产纤维素酶的报道有所不同,从而为纤维素降解菌的来源提供了一个新的优良菌种。同时也有报道表明目前浅紫链霉菌主要用来提取L-谷氨酸氧化酶,而有关浅紫链霉菌产纤维素酶的报道还很鲜见,这也证明了微生物代谢产物的确具有多样性。
1 Ma HL(马怀良),Xu XH(许修宏).The technologies of aerobic compost of animal dung.J Northwest Agric Univ (东北农业大学学报),2006,36:536-540.
2 Deswal D,Khasa YP,Kukad RC.Optimization of cellulase production by a brown rot fungus Fomitopsis sp.RCK2010 under solid state fermentation.Biores Technol,2011,102:6065-6072.
3 Chang J,Cheng W,Yin Q,et al.Effect of steam explosion and microbial fermentation on cellulose and lignin degradation of corn stover.Biores Technol,2012,104:587-592.
4 Yu L,Chen ZX,Tong X,et al.Anaerobic degradation of microcrystalline cellulose:kinetics and micro-scale structure evolution.Chemosphere,2012,86:348-353.
5 Feng KK(冯克宽),Wang MY(王明谊).Studies on cellulase from Aspergillus niger Sta-122 strain.J Northwest Norm Univ,Nat Sci(西北师范大学学报,自科版),1991,27:61-65.
6 Gijzen HJ.Continuous cultivation of rumen microorganisms,a system with possible application to the anaerobic degradation of lignocellulosic waste.Appl Environ Microbiol,1986,8:246-250.
7 Wu WT(吴文韬),Ju MT(鞠美庭),Liu JP(刘金鹏),et al.Isolation,identification and corn stalk degradation characteristics of cellulose-degrading bacterial strain NH11.Microbiol China(微生物学通报),2013,40:712-719.
8 Yang Y(杨莹),Lai HX(来航线),Chen X(陈雄),et al.Selection of high efficient strains for decomposing cow manure and the optimization of fermentation formula.J Northwest Agric Forest Univ,Nat Sci(西北农林科技大学学报),2007,35:125-128.
9 Xu YL(许玉林),Zheng YX(郑月霞),Ye BY(叶冰莹),et al.Isolation and identification of a cellulose degrading fungi.Microbiol China(微生物学通报),2013,40:220-227.
10 Gao YH(高云航),Zhang XH(张喜宏),Wang W(王巍),et al.Study on isolation,identification and enzyme-producing conditions optimized of cellulolytic bacteriain Ox dung.China Anim Husband Veterin Med(中国畜牧兽医),2014,41:151-156.
11 Saratale GD,Saratale RG,Oh SE.Production and characterization of multiple cellulolytic enzymes by isolated Streptomyces sp.MDS.Biomass Bioener,2012,47:302-315.
12 Fan C(樊程),Li SJ(李双江),Li CL(李成磊),et al.Isolation,identification and cellulase production of a cellulolytic bacterium from intestines of giant panda.Acta Microbiol Sin(微生物学报),2012,52:1113-1121.
13 Shirling EB,Gottlieb D.Methods for characterization of Streptomyces species.Int J System Bacteriol,1966,16:313-340.
14 Wang XJ(汪学军),Min CL(闵长莉),Yin ZC(殷智超),et al.Isolation and identification of an antimicrobial endophytic actinomycete from Macleaya cordata.J Chin Med Mater(中药材),2014,37:1947-1950.
15 Group of Actinomycetes Taxonomy,Institute of Microbiology,Chinese Academy of Sciences (中国科学院微生物研究所放线菌分类组).Identifying Manual of Streptomycetes.Beijing:Science Press,1975.13-15.
16 Jiang Y(姜云),Huang LL(黄丽丽),Chen CQ(陈长卿),et al.Screen,identification and optimized fermentation conditions of an actinomycetes strain against pathogenic fungus Fulyia fulva.Acta Microbiol Sin(微生物学报),2007,47:622-627.
17 Chun J,Goodfellow M.A phylogenetic analysis of the genus Nocardia with 16S rRNA gene sequences.Int J System Bacteriol,1995,45:240-245.
18 Jiang SM(姜淑梅),Zhang L(张龙),Dai SK(戴世鲲),et al.A quick and efficient method for genomic DNA extraction from actionbacteria.Biotechnology(生物技术),2007,17:39-41.
19 Baker GC,Smith JJ,Cowan DA.Review and re-analysis of domain-specific 16S primers.J Microbiol Methods,2003,55:541-555.
20 Kumar S,Zhang QB(张庆波),Li SM(李苏梅),et al.Isolation and characterisation of enterocins from marine Streptomyces sp.SCSIO 11863 isolated from South China sea.Nat Prod Res Dev(天然产物研究与开发),2014,26:1216-1220.
21 Liu ZY(刘占英),Hou XZ(侯先志),Liu YC(刘玉承),et al.Isolation,identification and characterization of a cellulosedegrading bacterial strain from the rumen of sheep.Microbiol China(微生物学通报),2009,36:459-464.
22 Lu BL(卢秉林),Wang WL(王文丽),Li J(李娟),et al.Maturing process of cattle manure high temperature composting with mixing different ratio of wheat straw.Environ Pollution Control(环境污染与防治),2010,32:30-34.
23 Xie KZ(解开治),Xu PZ(徐培智),Zhang RZ(张仁陟),et al.Effects of one chemical composting promoter and microorganism composting preparations on fresh cow dung compost.J Agro-Environ Sci(农业环境科学学报),2007,26:1142-1146.
24 Shen GX(沈根祥),Yuan DW(袁大伟),Ling XF(凌霞芬),et al.Application of Hsp microorganism used for composting of cow dung.Agro-Environ Protect(农业环境保护),1999,18:62-64.
25 He LY(何琳燕),Cao GX(曹广祥),Sheng XF(盛下放),et al.Effects of decomposing microbial inoculums NMF on quick decomposition of cow dung.Chin J Soil Sci(土壤通报),2006,37:761-763.
26 Zhang WJ(张文君),Liu ZH(刘兆辉),Jiang LH(江丽华),et al.Effects of the organic-inorganic fertilizer on crop yield and quality.Shandong Agric Sci(山东农业科学),2005,3:57-58.
27 Li QK(李庆康),Wu L(吴雷).The status and outlook of treatment on excreta from intensive animal farming in china.Agro-Environ Protect(农业环境保护),2000,19:251-254.
28 Feng HW(冯海玮),Zhou P(周培),Mao L(毛亮),et al.Screening of microbes with high quality of cellulose-decomposing enzyme and optimization of the conditions for cellulose production.J Shanghai Jiaotong Univ,Agric Sci(上海交通大学学报,农科版),2013,31:24-29.
29 Waldron CR,Becker-Vallone CA,Eveleigh DE.Isolation and characterization of a cellulolytic actinomycete Microbispora bispora.Appl Microbiol Biotechnol,1986,24:477-486.
