慈竹竹叶抗氧化活性成分的提取工艺研究
2015-01-08罗国勇
罗国勇,周 容,戴 亚
1中国科学院成都生物研究所,成都 610041;2 川渝中烟工业有限责任公司,成都 610066
自由基是生物体内正常的代谢产物,并参与多种生命活动过程[1,2]。正常生理条件下,自由基的产生与消除存在一个动态平衡。一旦平衡被破坏,体内过量存在的自由基可损伤蛋白质、脂质、DNA等生物大分子,造成氧化应激,诱导诸如癌症、糖尿病、衰老等多种疾病的发生[3,4]。适当地利用外源性抗氧化剂,可有效地预防和治疗与氧化应激相关的疾病。
与常见的天然抗氧化剂茶多酚或银杏提取物等类似,竹叶提取物在体内或体外试验中均表现出较强的抗氧化活性,是一种潜在的植物抗氧化剂[5]。因其资源丰富,天然无毒[6],近年来备受关注,尤其在天然功能性食品添加剂和医药保健品等领域。四川栽竹用竹历史悠久,现有竹子140 种(含变种、变型),资源丰富。按功用可分为材用竹林、纸浆竹林、笋用竹林和生态公益竹林等,而竹叶却未得到充分利用[7]。慈竹(Neosinocalamus affinis)是四川分布最广的竹类品种之一,主要含有黄酮、木脂素、三萜等化学成分[8-11],其提取物具有钙拮抗作用[12],对心肌缺血的大鼠心脏亦有保护作用[13]。然而,与其竹叶相关的研究很少[14]。因此,本研究拟选取慈竹竹叶为研究对象,以抗氧化活性成分得率为指标,通过单因素试验以及正交试验优化其抗氧化活性成分的提取工艺。同时测定与其活性相关的总酚含量和总黄酮含量,为其进一步的开发和利用奠定一定理论基础。
1 材料与方法
1.1 实验材料
新鲜慈竹竹叶于2011 年9 月采自四川彭州,经中国科学院成都生物研究所傅发鼎研究员鉴定系慈竹(Neosinocalamus affinis)竹叶。室温下风干后粉碎,过筛,按粉末粗细将样品分成三份:10~20 目、20~28 目以及>28 目,室温保存备用。
1.2 实验仪器与药品
集热式恒温加热搅拌器(郑州长城科工贸有限公司);多功能读数仪(Thermo Fisher Scientific Inc.);FA1204B 电子天平(上海精科天美科学仪器有限公司);芦丁(成都曼斯特生物科技有限公司,MUST-130104510);没食子酸(成都曼斯特生物科技有限公司,MUST-130404302);Vitamin C(天津博迪化工股份有限公司);DPPH(Sigma-Aldrich Co.LLC.);96 孔细胞培养板(Nest Biotech.Co.,Ltd)。
2 实验方法
2.1 抗氧化活性成分的提取方法
以抗氧化活性为指标,通过预试验考察提取溶剂的种类:乙酸乙酯、丙酮、甲醇、95%乙醇和水。结果发现甲醇提取物和95%乙醇提取物抗氧化活性最高,且前者稍强于后者。综合考虑环境保护和所得慈竹叶抗氧化物的安全性及其应用等方面,最终选择了乙醇水溶液作为提取溶剂。
以乙醇水溶液按照相应条件提取慈竹竹叶的抗氧化活性成分。完毕,经滤纸过滤得提取液,竹叶残渣以提取溶剂荡洗三次。合并提取液,以提取溶剂稀释并定容至100 mL,即为抗氧化活性成分样品溶液。置于4 ℃下保存备用,24 h 内完成其抗氧化活性成分的含量测定,含量以Vitamin C(VC)为参照表示。
2.2 抗氧化活性成分得率的计算
VC 是公认的天然抗氧化剂,在溶液中可清除DPPH 自由基而使后者的吸光度降低,且在一定范围内其吸光度降低值与VC 的浓度之间存有线性关系。因此,本实验采用VC 当量抗氧化能力(VCEAC,Vitamin C Equivalent Antioxidant Capacity)分析法测定慈竹竹叶抗氧化活性成分的得率[15],具体操作如下:精密称取DPPH 粉末58.9 mg,以无水乙醇溶解并定容至100 mL,置-20 ℃保存备用。使用时将此液以无水乙醇稀释20 倍,即配即用。往96 孔板中加入不同浓度(0.02、0.04、0.06、0.08、0.10、0.12 mg/mL)的VC 溶液10 μL 后,再分别依次加入290 μL DPPH 溶液。完毕,将96 孔板置室温下避光反应30 min 后,于517 nm 处以多功能读数仪测定反应液的吸收值,即可建立DPPH 溶液吸光度降低值与VC 浓度之间的标准曲线(Y=kX+b)。
同理,测定慈竹竹叶抗氧化活性成分样品液相对应的DPPH 溶液吸光度降低值,即可得慈竹竹叶抗氧化活性成分的得率(mg VC/g 竹叶样品),计算公式如下:
慈竹竹叶抗氧化活性成分得率=(Y-b)/k×100
式中Y 为慈竹竹叶抗氧化活性成分样品液相对应的DPPH 溶液吸光度降低值;b 为标准曲线的截距;k 为标准曲线的斜率。
2.3 单因素试验
乙醇浓度:取20~28 目竹叶粉末1 g,60 ℃下,料液比(g/mL,下同)为1∶25,以不同浓度的乙醇水溶液(0%、30%、50%、70%、92%、100%;v/v,下同)静置提取2 h。通过比较抗氧化活性成分的得率确定最佳乙醇浓度。
样品粒度与提取方式:取不同目数的竹叶粉末(10~20 目;20~28 目;>28 目)各1 g,60 ℃下,料液比为1∶25,以70%乙醇静置或搅拌提取2 h。通过比较抗氧化活性成分的得率确定最佳样品粒度与提取方式。
提取时间:取20~28 目竹叶粉末1 g,60 ℃下,料液比为1 ∶25,以70% 乙醇静置提取不同时间(0.5、1、1.5、2、2.5、3 h)。通过比较抗氧化活性成分的得率确定最佳提取时间。
料液比:取20~28 目竹叶粉末1 g,60 ℃下,不同料液比(1∶10、1∶15、1∶20、1∶25、1∶30、1∶40),以70%乙醇静置提取2 h。通过比较抗氧化活性成分的得率确定最佳料液比。
提取温度:取20~28 目竹叶粉末1 g,不同温度(30、40、50、60、70、80 ℃)下,料液比为1 ∶25,以70%乙醇静置提取2 h。通过比较抗氧化活性成分的得率确定最佳提取温度。
提取次数:取20~28 目竹叶粉末1 g,70 ℃下,料液比为1∶25,以70%乙醇静置提取2 h。小心倒出提取液,相同条件下重复提取0~2 次。完毕,合并相应提取液。通过比较抗氧化活性成分的得率确定最佳提取次数。
2.4 正交试验
以单因素试验结果为依据,结合考虑工业成本与可操作性,确定以提取溶剂的乙醇浓度(A)、料液比(B)、提取温度(C)为考察因素,通过正交试验优化慈竹竹叶抗氧化活性成分的提取工艺,因素水平设计见表1。

表1 正交试验因素水平表Table 1 Factors and levels of the orthogonal test
2.5 化学成分含量测定
2.5.1 总酚含量测定
以没食子酸为对照品,通过福林酚法测定最佳工艺条件下所提取的总酚含量[16]。具体操作如下:精密称取没食子酸2.0 mg,以蒸馏水溶解并定容至10 mL,作为对照液储存备用。将不同体积(20、40、60、80、100 μL)的对照液分别加至750 μL 以水稀释了10 倍的Folin-Ciocalteau phenol 试剂中,混匀后室温下避光反应5 min,再加入60 g/L 的NaHCO3溶液750 μL,混匀,再加适量蒸馏水将反应液体积补至2 mL。此反应液置于30 ℃下避光反应90 min后,取200 μL 反应液加入96 孔板中,于725 nm 下以多功能读数仪测定吸收值,即可建立吸光度与没食子酸对照液的体积之间的标准曲线(Y=kX +b)。
取慈竹竹叶抗氧化活性成分样品液100 μL,按上述流程操作,于725 nm 下测定相应的吸收值,即可得最佳工艺条件下所提取的总酚含量(mg/g 竹叶样品),计算公式如下:

式中Y 为100 μL 慈竹竹叶抗氧化活性成分样品液相应的紫外吸收值;b 为标准曲线的截距;k 为标准曲线的斜率。
2.5.2 总黄酮含量测定
以芦丁为对照品,采用经典的亚硝酸钠-三氯化铝-氢氧化钠法测定最佳工艺条件下所提取的总黄酮含量[17]。具体操作如下:精密称取芦丁2.2 mg,以甲醇溶解并定容至10 mL,作为对照液储存备用。将不同体积(25、50、100、150、200 μL)对照液分别置于2 mL 离心管中,依次加入200 μL 蒸馏水和5%亚硝酸钠溶液30 μL,混匀,反应5 min 后,再加入10%三氯化铝溶液60 μL,混匀后反应6 min,再加入1 M 氢氧化钠溶液200 μL,并加入适量蒸馏水将反应液体积补至900 μL。此反应液混匀后静置15 min,取300 μL 反应液加入96 孔板中,于510 nm下以多功能读数仪测定吸收值,即可建立吸光度与芦丁对照液的体积之间的标准曲线(Y=kX+b)。
取慈竹竹叶抗氧化活性成分样品液250 μL,按上述流程操作,于510 nm 下测定相应的吸收值,即可得最佳工艺条件下所提取的总黄酮含量(mg/g 竹叶样品),计算公式如下:

式中Y 为250 μL 慈竹竹叶抗氧化活性成分样品液相应的紫外吸收值;b 为标准曲线的截距;k 为标准曲线的斜率。
3 结果与分析
3.1 VC 标准曲线
试验结果表明DPPH 溶液吸光度降低值Y517与VC 标准溶液的浓度X 在0.02~0.12 mg/mL 范围内线性关系良好,回归方程为:Y517=3.3994X-0.0062,R2=0.9975。
3.2 单因素试验结果
分别考察了提取溶剂的乙醇浓度、样品粒度与提取方式、提取时间、料液比、提取温度和提取次数对慈竹竹叶抗氧化活性成分得率的影响,结果如图1 所示。由此可以确定乙醇浓度、料液比和提取温度这三个因素对抗氧化活性成分的得率影响显著。
3.3 正交试验
根据单因素试验结果,结合考虑工业成本与操作简便性,选取20~28 目竹叶粉末静置提取1 次,提取时间1.5 h,以提取溶剂的乙醇浓度(A)、料液比(B)、提取温度(C)为考察因素,通过正交试验优化慈竹竹叶抗氧化活性成分的提取工艺,结果如表2 所示。极差分析结果(表2)表明,在所考察的水平范围内,各因素作用的主次顺序为C >A >B。同时,空白列D 的R 值最小,佐证了正交设计试验数据的可靠性。方差分析结果(表3)显示只有因素A和C 对抗氧化活性成分得率的影响具有显著性意义(P<0.05),由此可得出最佳提取工艺为A2B1-3C3。进一步成对比较因素各水平之间的差异性(表4),发现因素A 水平1 和水平2 之间并无显著差别;因素B 各水平间均无显著性差别;因素C 各水平之间差异显著。因此,综合考虑,确定慈竹竹叶抗氧化活性成分的最佳提取工艺为A1B1C3,即选取20~28 目竹叶粉末,70 ℃下,料液比为1∶10,以60%乙醇静置提取1.5 h。

图1 乙醇浓度(A)、样品粒度与提取方式(B)、提取时间(C)、料液比(D)、提取温度(E)及提取次数(F)对慈竹竹叶抗氧化活性成分得率的影响Fig.1 Effects of ethanol concentration (A),particle size and extraction methods (B),extraction duration (C),ratio of solid to liquid (D),extraction temperature (E),and times of extraction (F)on yields of antioxidants from N.affinis leaves

表2 正交试验结果Table 2 Results of orthogonal test
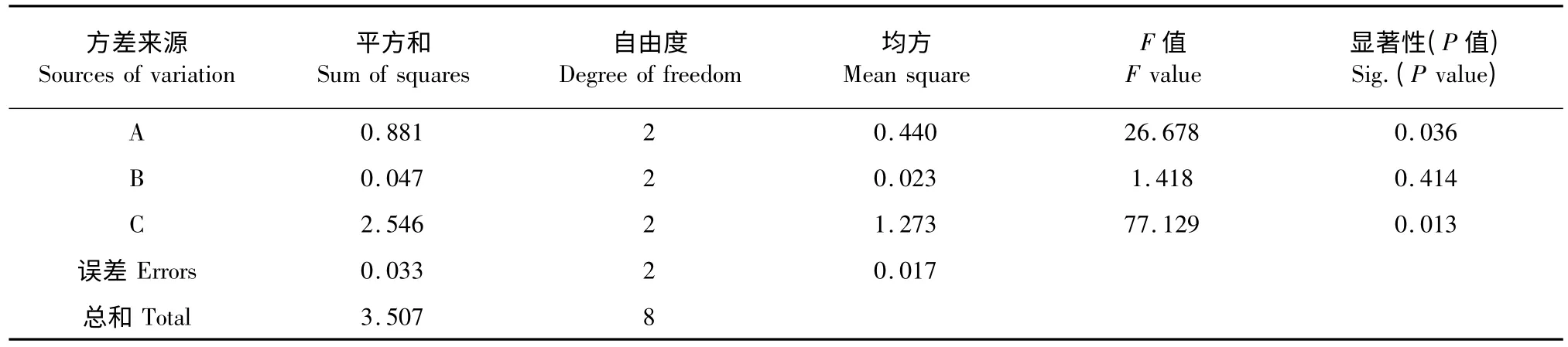
表3 方差分析Table 3 Analysis of variance
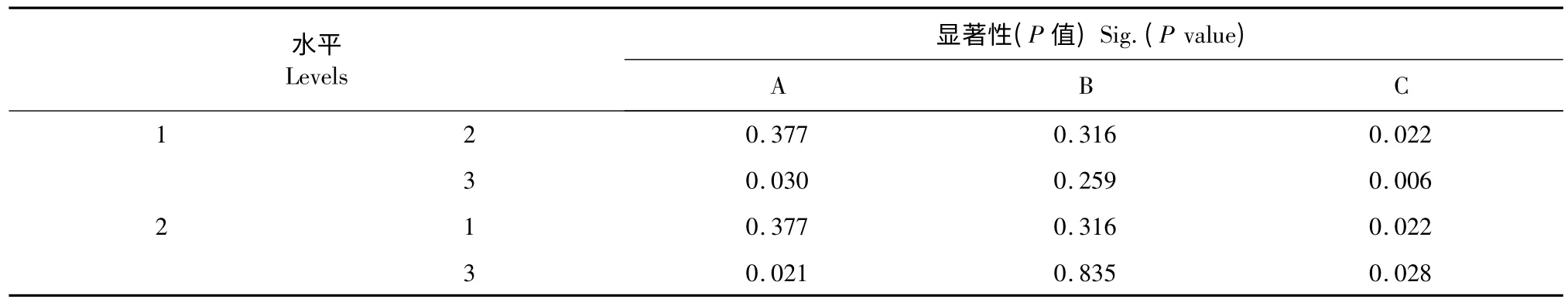
表4 因素各水平之间差异分析Table 4 Variation analysis between factor levels
3.4 验证试验
精密称取三份20~28 目竹叶样品各1 g,按确定的最佳提取工艺条件提取。结果显示,抗氧化活性成分的得率为7.44 mg/g,基本达到了正交试验中的最优水平,表明了最佳提取工艺的合理性。同时,RSD=3.61%,也证明了所得最佳提取工艺是稳定可靠的。
3.5 抗氧化活性成分含量测定
3.5.1 总酚含量测定
没食子酸标准溶液的吸收值Y725与其体积X 在20~100 μL 范围内线性关系良好,回归方程为:Y725=0.0078X-0.0285,R2=0.9996。由此,可知1 g 竹叶粉末提取的总酚含量为4.73 mg。
3.5.2 总黄酮含量测定
芦丁标准溶液的吸收值Y510与其体积X 在25~200 μL 范围内线性关系良好,回归方程为:Y510=0.0036X +0.0109,R2=0.9952。由此,可知1 g 竹叶粉末提取的总黄酮含量为5.52 mg。
4 结论
VCEAC 分析法的基本原理是以天然抗氧化剂Vitamin C 为对照品,测定提取物中抗氧化活性成分的含量。以慈竹竹叶抗氧化活性成分含量为指标,通过单因素试验以及正交试验,初步确定慈竹竹叶抗氧化活性成分的最佳提取工艺为:选取20~28 目竹叶粉末,70 ℃下,料液比为1/10,以60%乙醇静置提取1.5 h。此工艺条件下可由1 g 竹叶粉末中提取得到7.44 mg 抗氧化活性成分。总酚和总黄酮类成分是公认的抗氧化活性物质,故进一步测定此工艺条件下提取得到的总酚和总黄酮含量。结果表明从1 g 竹叶粉末中提取的总酚含量为4.73 mg,总黄酮含量为5.52 mg。以抗氧化活性为导向对竹叶提取物中的有效成分进行分离和鉴定[18],得到了竹叶中公认的抗氧化活性指标性成分之一异荭草素,和另一个与之活性相当的类似物farobin A,这从侧面反应了所得工艺条件的合理性。
1 Fang YZ,Yang S,Wu GY.Free radicals,antioxidants,and nutrition.Nutrition,2002,18:872-879.
2 Valko M,Leibfritz D,Moncol J,et al.Free radicals and antioxidants in normal physiological functions and human disease.Int J Biochem Cell Biol,2007,39:44-84.
3 Rahman K.Studies on free radicals,antioxidants,and co-factors.Clin Interv Aging,2007,2:219-236.
4 Aruoma OI.Free radicals,oxidative stress,and antioxidants in human health and disease.J Am Oil Chem Soc,1998,75:199-212.
5 Hu C,Zhang Y,Kitts DD.Evaluation of antioxidant and prooxidant activities of bamboo Phyllostachys nigra var.Henonis leaf extract in vitro.J Agric Food Chem,2000,48:3170-3176.
6 Lu BY,Wu XQ,Tie XW,et al.Toxicology and safety of antioxidant of bamboo leaves.Part 1:Acute and subchronic toxicity studies on anti-oxidant of bamboo leaves.Food Chem Toxicol,2005,43:783-792.
7 Wang J (王江),Xian KB (先开炳),Shen SH (沈淑红).Opportunities,challenges and strategies for bamboo industrial development in Sichuan.J Sichuan For Sci Tech (四川林业科技),2009,30:79-81.
8 Li H,Li YH,Li G,et al.Ultrasonically assisted simultaneous extraction of isoorientin,orientin,and vitexin from leaves of Neosinocalamus affinis (Rendle)Keng f.(N.affinis).Sep Sci Technol,2013,48:1987-1997.
9 Zhu M (朱梅),Xiong L (熊亮),Wang YL (王亚男),et al.Lignans from Sinocalamus affinis.China J Chin Mater Med (中国中药杂志),2012,37:1968-1972.
10 Xiong L,Zhu CG,Li YR,et al.Lignans and neolignans from Sinocalamus affinis and their absolute configurations.J Nat Prod,2011,74:1188-1200.
11 Xiong L,Zhu M,Zhu CG,et al.Structure and bioassay of triterpenoids and steroids from Sinocalamus affinis.J Nat Prod,2012,75:1160-1166.
12 Ye L (叶玲),Li L (李丽),Yang YY (杨远友),et al.Investigation on calcium antagonistic effects of Sinocalamus affinis by45Ca as tracer.Atom Energy Sci Technol (原子能科学技术),2007,41:678-682.
13 Guo Y (郭英),Xie JP (谢建平),Yun Y (云宇),et al.Effects of Sinocalamus affinis extract on acute myocardial ischemia in rats.Lishizhen Med Mater Med Res (时珍国医国药),2011,22:1824-1825.
14 Guo L (郭磊),Guan YQ (管雨晴),Li MY (李梅云).Study on antioxidative effects of polysaccharide from Neosinocalamus affinis leaves.Food Res Dev (食品研究与开发),2013,34:9-11.
15 Kim DO,Lee KW,Lee HJ,et al.Vitamin C equivalent antioxidant capacity (VCEAC)of phenolic phytochemicals.J Agric Food Chem,2002,50:3713-3717.
16 Lizcano LJ,Bakkali F,Ruiz-Larrea MB,et al.Antioxidant activity and polyphenol content of aqueous extracts from Colombian Amazonian plants with medicinal use.Food Chem,2010,119:1566-1570.
17 Jia Z,Tang M,Wu J.The determination of flavonoid contents in mulberry and their scavenging effects on superoxide radicals.Food Chem,1999,64:555-559.
18 Luo GY,Luo YG,Zhou R,et al.Antioxidant compounds from ethanol extracts of bamboo (Neosinocalamus affinis)leaves.J Asian Nat Prod Res,2015,17:248-255.
