枯草芽孢杆菌发酵大豆过程中水提物的ACE 抑制活性的变化
2015-01-08李风娟刘婉璐方元元王昌禄
李风娟,刘婉璐,方元元,赵 月,王昌禄
(食品营养与安全教育部重点实验室,天津科技大学食品工程与生物技术学院,天津 300457)
高血压是引发心脑血管疾病的主要风险因素之一,人体的肾素–血管紧张素系统是一种重要的体液调节机制,其中血管紧张素转换酶(angiotensin I-converting enzyme,ACE,EC 3.4.15.1)是该系统的一个关键酶,它可以通过催化无活性的血管紧张素Ⅰ转化为具有强血管收缩活性的血管紧张素Ⅱ,并降解具有血管舒张活性的血管舒缓激肽,从而致使血压升高[1].所以,对ACE 活性的抑制被认为是治疗高血压的一种有效手段.由于化学合成的ACE 抑制剂类降压药物存在咳嗽等副作用,具有ACE 抑制活性的食品或食源性成分受到广泛关注.
目前已发现的食源性ACE 抑制剂大多数为活性肽类物质[2–3],发酵大豆食品的ACE 抑制活性也与大豆蛋白质被微生物蛋白酶降解所生成的多肽密切相关,如从日本腐乳中分离得到的Trp-Leu 和Ile-Phe-Leu[4]、从高温快速发酵豆酱中得到的Leu-Val-Gln-Gly-Ser[5]等.另一方面,考察发酵过程中产品的ACE抑制活性的变化,进而有效地控制发酵过程,对于降血压功能性食品的生产具有重要的应用指导意义.本研究采用一株枯草芽孢杆菌制备发酵大豆,旨在研究发酵过程中ACE 抑制活性的变化规律,并从大豆蛋白质的降解及多肽的生成角度进行分析,以期为应用该菌株研发具有潜在降压活性的发酵大豆食品提供理论依据.
1 原料与方法
1.1 原料与试剂
枯草芽孢杆菌(Bacillus subtilis)SY 菌种从酱曲中分离得到.大豆购自吉林农科院大豆研究中心.
血管紧张素转换酶(ACE,0.1,U,源于兔肺)、马尿酰组氨酰亮氨酸(HHL)、邻苯二甲醛(OPA)、谷胱甘肽和 2,4,6–三硝基苯磺酸(TNBS)购自美国Sigma 公司,酵母提取物和胰蛋白胨购自英国Oxoid公司,其他试剂均为分析纯.
1.2 实验仪器
EYELA KCL–2000 型恒温恒湿培养箱,日本东京理化公司;ALPHA 2–4 LD plus 型真空冷冻干燥机,德国Christ 公司;Avanti J–26 XP 型冷冻离心机,美国Beckman Coulter 公司;RF–5300PC 型荧光分光光度计,日本岛津公司;Infinite M200 PRO 型酶标仪,瑞士Tecan 公司;Agilent 8453 型紫外-可见分光光度计,美国安捷伦公司.
1.3 样品的制备方法
1.3.1 发酵大豆的制备
将0.5,g 酵母提取物、1.0,g 胰蛋白胨和1.0,g NaCl 混匀,加100,mL 蒸馏水溶解,用HCl 调pH 至7.0,灭菌20,min,制备LB 液体培养基.
从保藏斜面上挑取枯草芽孢杆菌SY 接于LB 液体培养基(50,mL/250,mL 三角瓶),于 37,℃、150,r/min 摇床培养12,h,得到种子液,备用.
挑选颗粒饱满、无虫害的大豆,清洗干净,用3倍质量的水在室温下浸泡过夜,然后将水沥干后定量盛于竹屉中,于121,℃蒸40,min.蒸制大豆冷却后接种枯草芽孢杆菌SY 种子悬浮液,接种量为1,mL/100,g,搅拌均匀,移入恒温恒湿培养箱,于37,℃、相对湿度90%的条件下进行培养,并定时取样.
1.3.2 发酵大豆水提物的制备
将上述各发酵阶段所获取的发酵大豆样品置于真空冷冻干燥机中冷冻干燥,磨碎.准确称取0.5,g冻干粉,加入5,mL 蒸馏水,充分振荡混匀.超声波提取 5,min 后于室温下摇床提取 1,h,再沸水浴15,min.将所得样液6,500,r/min 离心10,min,上清液以0.45,μm 膜过滤,收集滤液,即为样品水提物,将其浓度标记为100,mg/mL.
1.4 ACE抑制活性的测定
对ACE 抑制活性的测定参照Li 等[6]的评价方法.将样品水提物适当稀释,以96 孔酶标板作为反应容器.将15,μL 样液(对照反应液中以蒸馏水代替)与30,μL 4.66,mmol/L 的HHL 溶液(溶于0.6,mol/L NaCl–0.4,mol/L 磷酸盐缓冲液,pH 8.5)混合,然后加入30,μL 12.5,mU/mL 的ACE 酶液(样品反应液和对照反应液的空白以蒸馏水代替),在微孔板混合器上混匀后于 37,℃反应 1,h.加入 120,μL 1.2,mol/L NaOH 溶液终止酶反应,接着加入30,μL 2%的OPA溶液(溶于甲醇),混匀,室温下静置20,min 后加入30,μL 6,mol/L 的HCl 溶液终止衍生反应.将反应液稀释30 倍后测定荧光吸收强度,条件如下:激发波长340,nm,发射波长455,nm,狭缝宽度5,nm.样液的ACE 抑制率计算公式为

式中:I1表示样品反应液即存在ACE 抑制剂时的荧光吸收强度;I2表示对照反应液即无ACE 抑制剂时的荧光吸收强度.
ACE 抑制率越大,说明抑制剂在该浓度条件下抑制ACE 活性的能力越强.以抑制剂浓度的对数值为横坐标,以抑制率为纵坐标,绘制回归曲线,抑制率为50%时抑制剂的浓度即为半抑制浓度(IC50),IC50越小,说明抑制剂对ACE 活性的抑制能力越强.
1.5 中性蛋白酶活性的测定
称取1.0,g 样品加入10,mL 蒸馏水,在150,r/min振荡提取1,h 后,于4,℃、6,500,r/min 离心10,min,转移上清液.在残渣中加入10,mL 蒸馏水,混匀后再次离心.将两次离心上清液合并作为酶提取液.
中性蛋白酶活性的测定参照 Yang 等[7]的方法.先取1,mL 酶液与1,mL 2%的酪蛋白溶液(溶于0.2,mol/L 磷酸盐缓冲液,pH,7.5)分别于40,℃保温,10,min 后将两者混合,再在40,℃精确反应30,min,然后加入2,mL 0.4,mol/L 三氯乙酸(TCA)溶液终止反应,6,500,r/min 离心10,min,过滤.另取1,mL 酶液,先加入TCA 溶液,然后加入酪蛋白溶液,于室温下6,500,r/min 离心10,min,过滤,滤液作为空白,于275,nm 测定滤液的吸光度.以吸光度为纵坐标,酪氨酸浓度为横坐标,绘制标准曲线,计算出当吸光度为1 时酪氨酸的质量(μg),即为吸光常数K 值.将上述条件下1,mL 酶液在1,min 内释放出相当于1,μg 酪氨酸的酶活定义为1 个酶活单位.
1.6 多肽含量的测定
多肽含量的测定参照Church 等[8]的方法.OPA试剂的配制如下:将50,mL 0.1,mol/L 的四硼酸钠溶液、5,mL 20%的SDS 溶液、0.5,mL β–巯基乙醇及2.5,mL 5%的OPA 溶液(溶于甲醇)混合后,用蒸馏水定容至100,mL.将样品水提物适当稀释,取15,μL 置于酶标板小孔中,加入300,µL OPA 试剂,混匀,室温下静置反应10,min,用酶标仪于340,nm 测定吸光度.以谷胱甘肽作标准曲线.
1.7 游离氨基含量的测定
游离氨基含量的测定参照 Haynes 等[9]的方法.将样品水提物适当稀释,取0.2,mL,加入1,mL 0.212,5,mol/L 磷酸缓冲液(pH 8.2),然后按一定时间间隔依次加入1.0,mL 0.1%的TNBS 溶液(对照组为蒸馏水),50,℃水浴中避光反应1,h.按相同时间间隔依次加入4,mL 0.1,mol/L 的HCl 溶液.静置30,min后取300,µL 置于酶标板小孔中,用酶标仪于340,nm处测定反应液的吸光度.以亮氨酸作标准曲线.
2 结果与讨论
2.1 发酵过程中样品的ACE抑制活性的变化
发酵过程中样品的ACE 抑制活性的变化如图1所示(ND 表示未检测出ACE 抑制活性),所测样品的质量浓度为0.667,mg/mL.在该浓度条件下,未发酵的样品没有表现出ACE 抑制活性,发酵12,h 的样品的ACE 抑制率达到70%,而发酵24,h 样品的ACE抑制率降至44%,在随后的发酵期间保持平稳.图2为发酵12,h 的样品在不同浓度下的ACE 抑制活性,呈现浓度依赖型,根据拟合曲线得到其IC50值为0.312,mg/mL.
在发酵初期样品中ACE 抑制剂大量快速生成,这也是所用枯草芽孢杆菌快速增殖的过程,而随着发酵的充分进行,已生成的ACE 抑制剂被最大程度地消耗或转变,导致活性降低并趋于稳定.在Zhang等[10]的研究中指出,用埃及曲霉(Aspergillus egypticus)发酵制备豆豉时,在15,d 的发酵过程中,样品的ACE 抑制活性先快速后持续缓慢增加;而用五通桥毛霉(Mucor wutungkiao)发酵制备豆豉[11]及用雅致放射毛霉(Actinomucor elegans)发酵制备腐乳[12]时发现,样品的ACE 抑制活性均呈现出初期升高而后降低的趋势,与本研究的结果相似.据此推断,对于这些不同类型的发酵大豆食品,其制备过程中ACE 抑制活性的变化会受到发酵原料及发酵菌种等的影响,而对于本研究所用的枯草芽孢杆菌SY 而言,为保持发酵大豆良好的ACE 抑制活性,应严格控制发酵进程.同时,这些研究[10–12]均指出多肽类物质对样品的ACE 抑制活性起着重要的作用,所以本研究也将重点从枯草芽孢杆菌SY 发酵大豆过程中蛋白质降解的角度对样品的ACE 抑制活性的变化进行分析.

图1 发酵过程中样品的ACE抑制活性的变化Fig.1 Changes of ACE inhibitory activity during fermentation

图2 发酵12 h的样品在不同浓度下的ACE抑制活性Fig.2 ACE inhibition versus concentration of the sample fermented 12 h
2.2 发酵过程中样品的中性蛋白酶活性的变化
发酵过程中样品的中性蛋白酶活性的变化见图3(ND 表示未检测出中性蛋白酶活性).发酵12,h 时枯草芽孢杆菌SY 分泌的中性蛋白酶活力(以干质量计)为294,U/g,36,h 时增至718,U/g,在随后的发酵期间变化不大.
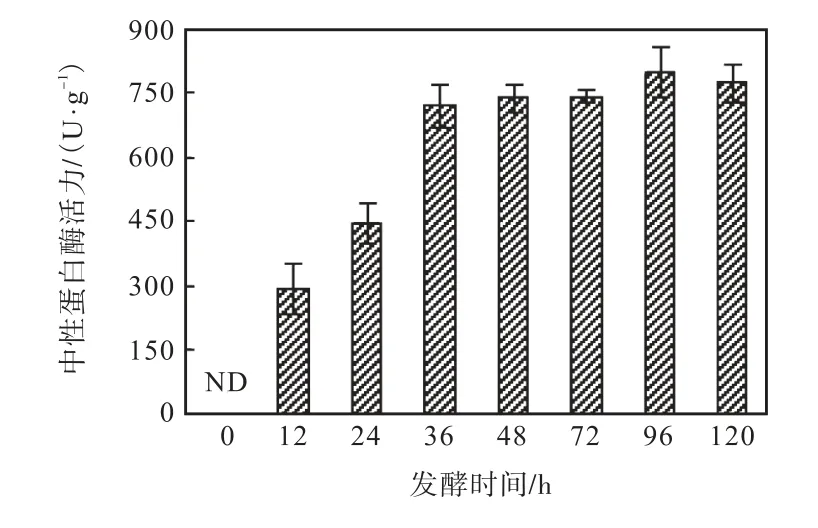
图3 发酵过程中样品的中性蛋白酶活性的变化Fig.3 Changes of neutral protease activity during fermentation
发酵大豆食品的ACE 抑制活性多归因于蛋白质被微生物蛋白酶降解所产生的多肽类物质[4–5],枯草芽孢杆菌SY 增殖过程中分泌的蛋白酶作用于大豆蛋白质使其降解为小分子多肽.在前36,h,蛋白酶活力持续增加,然而,样品的ACE 抑制活性已在此阶段由高值逐渐降低,说明蛋白质的适度降解对于产品保持较高的ACE 抑制活性具有积极的影响,而发酵后期蛋白质或多肽发生的进一步降解则会造成ACE抑制活性的损失.
2.3 发酵过程中样品的多肽及游离氨基含量的变化
发酵过程中样品的多肽及游离氨基含量的变化分别见图4 和图5.由此可见两者具有相似的变化趋势,至发酵48,h,多肽含量(以干质量计)持续升高至30.57,g/100,g,至发酵72,h,游离氨基含量(以干质量计)持续增至1.00,mmol/g,然后逐渐趋于稳定.结合中性蛋白酶活性的变化可以看出,在高活力的蛋白酶的作用下,大豆蛋白质逐渐被充分降解,这进一步说明了样品ACE 抑制活性的损失与蛋白质的过度降解有关.Chiang 等[13]在研究中用5 种不同的蛋白酶直接作用于大豆分离蛋白,发现用风味蛋白酶所得酶解物的水解度最高却表现出最低的ACE 抑制活性,指出了高蛋白水解程度不一定保证高ACE 抑制活性.

图4 发酵过程中样品的多肽含量的变化Fig.4 Changes of peptide content during fermentation

图5 发酵过程中样品的游离氨基含量的变化Fig.5 Changes of amount of free amino groups during fermentation
多肽与ACE 的结合能力取决于其结构特点,在发酵初期所生成的多肽的结构更有利于其与ACE 的活性位点结合进而发挥抑制作用,而随着发酵的进行,这些有利的结构特点可能随着多肽的进一步降解被逐渐打破,降低了其与ACE 活性位点的有效结合而减弱了对ACE 的抑制作用,从而导致样品整体ACE 抑制活性的下降.这种变化也同样发生在用M.,wutungkiao 发酵制备豆豉[11]及用A.elegans 发酵制备腐乳[12]的后酵过程中,样品中的多肽含量逐渐增加,而ACE 抑制活性却出现损失.所以,为获得具有良好ACE 抑制活性的产品,控制蛋白质的适度降解具有重要的意义.
3 结论
采用枯草芽孢杆菌SY 发酵大豆的过程中,样品的ACE 抑制活性在前期迅速增加,然后降低并保持平稳,发酵12,h 样品在质量浓度为0.667,mg/mL 时的ACE 抑制率为70%,其IC50值为0.312,mg/mL.中性蛋白酶活力在前36,h 迅速增加达到718,U/g,多肽及游离氨基的含量也逐渐增加并趋于稳定.蛋白质的适度降解有利于高ACE 抑制活性多肽的生成,而过度降解则造成产品活性的损失.在控制发酵进程的条件下,枯草芽孢杆菌SY 有望应用于发酵大豆食品的生产而获得具有潜在调节血压作用的产品,同时,还需对产品中的ACE 抑制肽进行结构及构效关系的深入分析.
[1]Ondetti M A,Cushman D W.Inhibition of the reninangiotensin system.A new approach to the therapy of hypertension[J].Journal of Medicinal Chemistry,1981,24(4):355–361.
[2]Miguel M,Contreras M M,Recio I,et al.ACE-inhibitory and antihypertensive properties of a bovine casein hydrolysate[J].Food Chemistry,2009,112(1):211–214.
[3]Quist E E,Phillips R D,Saalia F K.Angiotensin converting enzyme inhibitory activity of proteolytic digests of peanut(Arachis hypogaea L.)flour[J].LWT-Food Science and Technology,2009,42(3):694–699.
[4]Kuba M,Tanaka K,Tawata S,et al.Angiotensin Iconverting enzyme inhibitory peptides isolated from tofuyo fermented soybean food[J].Bioscience,Biotechnology,and Biochemistry,2003,67(6):1278–1283.
[5]Rho S J,Lee J S,Chung Y I,et al.Purification and identification of an angiotensin Ι-converting enzyme inhibitory peptide from fermented soybean extract[J].Process Biochemistry,2009,44(4):490–493.
[6]Li F J,Yin L J,Lu X,et al.Changes in angiotensin Iconverting enzyme inhibitory activities during the ripening of douchi(a Chinese traditional soybean product)fermented by various starter cultures[J].International Journal of Food Properties,2010,13(3):512–524.
[7]Yang J K,Shih I L,Tzeng Y M,et al.Production and purification of protease from a Bacillus subtilis that can deproteinize crustacean wastes[J].Enzyme and Microbial Technology,2000,26(5):406–413.
[8]Church F C,Swaisgood H E,Porter D H,et al.Spectrophotometric assay using o-phthaldialdehyde for determination of proteolysis in milk and isolated milk proteins[J].Journal of Dairy Science,1983,66(6):1219–1227.
[9]Haynes R,Osuga D T,Feeney R E.Modification of amino groups in inhibitors of proteolytic Enzymes[J].Biochemistry,1967,6:541–547.
[10]Zhang J H,Eizo T,Ding C H,et al.Angiotensin Iconverting enzyme inhibitory peptides in douchi,a Chinese traditional fermented soybean product[J].Food Chemistry,2006,98(3):551–557.
[11]Wang H,Li Y,Cheng Y,et al.Effect of the Maillard reaction on angiotensin I-converting enzyme(ACE)-inhibitory activity of douchi during fermentation[J].Food and Bioprocess Technology,2011,6(1):297–301.
[12]Ma Y,Cheng Y,Yin L,et al.Effects of processing and NaCl on angiotension I-converting enzyme inhibitory activity and γ-aminobutyric acid content during sufu manufacturing[J].Food and Bioprocess Technology,2013,6(7):1782–1789.
[13]Chiang W D,Tsou M J,Tsai Z Y,et al.Angiotensin Iconverting enzyme inhibitor derived from soy protein hydrolysate and produced by using membrane reactor[J].Food Chemistry,2006,98(4):725–732.
