五味子对H2O2诱导的HaCaT 细胞氧化应激损伤的保护作用
2015-01-08金银萍王玉帅王英平
金银萍,侯 微,高 薇,王玉帅,焉 石,王英平
中国农业科学院特产研究所,长春 130112
皮肤是维持人体生命和健康的重要部分,直接与外界接触,是机体的第一道屏障,极易受到环境因素的影响而导致损伤。人类皮肤的衰老是机体衰老最易观察到的外部显示,是整体衰老的局部表现。促使皮肤衰老的因素很多,除了先天与遗传因素外,还受外界环境中诸多因素的直接影响如污染、阳光、紫外线的照射、应激反应等。随着社会人口老龄化和生活环境的不断恶化,以及人们生活水平的提升,预防和延缓皮肤衰老越来越受到人们的重视。在“回归自然、崇尚天然”的潮流趋势下,以植物来源的天然功能性化妆品,备受消费者的青睐。
五味子Schisandra chinensis(Turcz.)Baill.是木兰科(Magnoliaceae)五味子属Schisandra多年生落叶藤本植物[1]。近年来有关五味子药理活性的研究表明,五味子提取物及其所含的木脂素、多糖类等成分,均具有抗氧化活性[2-10]。但是,五味子对皮肤衰老方面的研究报道相对较少[11-13]。本试验通过H2O2造成HaCaT 细胞(人皮肤角质形成细胞)自由基氧化损伤衰老模型,观察五味子各组分抗皮肤细胞衰老效果,以期筛选得到五味子抗衰老护肤活性功能因子,为北五味子抗皮肤衰老产品的开发奠定基础。
1 仪器与材料
1.1 材料与试剂
HaCaT 细胞购自上海川翔生物科技发展有限公司;五味子醇甲(批号110857)、五味子酯甲(批号111529)、五味子甲素(批号110764)、五味子乙素(批号110765)购自中国药品生物制品检定研究所,五味子醇乙(批号YY90208)购自上海源叶生物科技有限公司;RPMI 1640 培养基购自Gibco;胎牛血清购自Clack;胰蛋白酶购自HyClone;噻唑蓝(MTT)、DPPH 购自Sigma;微量丙二醛(MDA)、超氧化物歧化酶(SOD)测定试剂盒、微量还原型谷胱甘肽(GSH)测试盒购自南京建成生物工程研究所;总抗氧化能力检测试剂盒(ABTS 法)购自碧云天生物技术研究所;30% H2O2购自天津市百世化工有限公司。
五味子果实采自吉林市左家镇中国农业科学院特产研究所药用植物资源圃,经中国农业科学院特产研究所艾军研究员鉴定为木兰科(Magnoliaceae)五味子属Schisandra五味子Schisandra chinensis(Turcz.)Baill.四年生果实。
1.2 仪器与设备
ST-360 酶标仪(上海科华实验系统有限公司);IBE1000 倒置显微镜(重庆光电仪器有限公司);KDC-40 低速离心机(安徽中科中佳);HF151UV 二氧化碳培养箱(上海力申科学仪器有限公司);FDU-2100 冷冻干燥机(日本EYELA);10AvP 高效液相色谱仪(日本SHIMADZU)。
2 实验方法
2.1 HPLC 分析五味子各组分木脂素含量
2.1.1 样品制备
五味子果实提取物(SC),上大孔吸附树脂AB-8,静置过夜,依次用H2O、10%乙醇、30%乙醇、50%乙醇、70%乙醇、95%乙醇洗脱,每个梯度冲洗5 个保留体积,分别收集各梯度洗脱液,过滤,减压浓缩,浓缩液经冷冻至干,备用。样品组分依次命名为SC-0、SC-10、SC-30、SC-50、SC-70、SC-95。
2.1.2 色谱条件
Hypersil ODS2(250 mm × 4.6 mm,5 μm)色谱柱;流动相:乙腈(A),水(B)。梯度洗脱模式:0~30 min,45%~75% A;30~35 min,75%~99% A;35~40 min,99%~45%;40~45 min,45%A;流速1 mL/min;检测波长254 nm,进样量10 μL,柱温为室温。
2.1.3 样品测定
准确称取五味子各组分样品适量,按“2.1.2”条件进行测定,以下列公式计算五味子醇甲等5 种木脂素的含量(mg/g):木脂素的含量=(C×D)/W式中:C 为测试液中各木脂素浓度(g/L),D 为供试液的稀释因子,W 为样品的质量(g)。
2.2 DPPH 法测定五味子各组分抗氧化能力
精密称取DPPH 5.0 mg,用乙醇溶解并定容至100 mL 棕色容量瓶内,避光保存备用。将样品溶液配制成不同质量浓度梯度的待测液,混匀,备用。吸取待测样品溶液0.1 mL 及3.9 mL 的DPPH 溶液,加入到5.0 mL 具塞试管中,摇匀,室温避光放置90 min,取200 μL 加入96 孔酶标板中,于517 nm 处测定吸光值AbS1,每次重复3 次。根据下列公式计算样品自由基清除率,清除率(%)=[(AbS0-AbS1)/AbS0]×100,AbS0为空白对照0.1 mL 溶剂与3.9 mL DPPH 混合溶液的吸光值。清除DPPH 的能力用IC50值表示[14]。
2.3 ABTS 法测定五味子各组分总抗氧化能力
精密吸取待测样品10 μL 置96 孔酶标板上,加入工作液。空白溶液吸取50%乙醇10 μL,加入工作液,采用酶标仪在734 nm 进行测定。记录吸光值,代入回归方程计算[15]。
2.4 HaCaT 细胞培养
取HaCaT 细胞在含10% 胎牛血清的RPMI 1640 培养基,于37 ℃、5%CO2的细胞培养箱中培养。取对数生长期的HaCaT 细胞,以1 ×105个/mL细胞接种到96 孔细胞培养板内,每孔100 μL,培养24 h 备用。
2.5 细胞增殖检测
实验分为空白组、模型组、药物处理组和药物预处理后加H2O2组,每组至少3 个复孔。空白组给予完全培养基;模型组加入终浓度为1000 μmol/L H2O2的完全培养基,作用时间1 h;药物处理组根据各组分的实际情况分为4 个不同剂量组,预处理作用时间24 h;药物预处理后加H2O2组是加入受试药物作用24 h 后,加入终浓度为1000 μmol/L H2O2的完全培养基作用1 h。利用MTT 法判断各组细胞增殖情况。加入5 mg/mL MTT 20 μL,孵育4 h 后,弃上清,每孔加入150 μL DMSO 溶解沉淀物,振荡器混匀后,用酶标仪在490 nm 波长下检测OD 值。细胞存活率通过以下公式计算:细胞存活率(%)=(OD处理/OD空白)×100%[13]。
2.6 五味子组分对氧化损伤HaCaT 细胞MDA、SOD 和GSH 水平的影响
取空白对照组、H2O2损伤组、不同剂量活性组分处理组的HaCaT 细胞(处理方式同前),按照MDA、SOD 和GSH 检测试剂盒说明书进行操作。
2.7 统计学分析
广东省未来煤电发展主要受限于煤炭消费总量控制和环保容量约束。煤电行业污染物排放总量按照比2015年下降50%考虑,通过实施煤电机组超低排放改造,经测算,广东环保空间可支撑煤电装机约110 GW。按照等煤量控制测算,当电煤比例提高至75%时,广东省可支撑煤电装机约80 GW;当电煤比例提高至80%时,广东省可支撑煤电装机约85 GW。
3 实验结果
3.1 HPLC 分析五味子组分木脂素含量
五味子醇甲、五味子醇乙、五味子酯甲、五味子甲素、五味子乙素是五味子中5 种主要的木脂素。按上述色谱条件进行测定,计算其在各组分中的含量。从表1 结果可以得出,木脂素含量的大小顺序为:SC-70 >SC-50 >SC-95 >SC-30。SC-0 和SC-10 不含木脂素类成分。
表1 五味子各组分中木脂素含量(n=3, ± s)Table 1 Lignan contents of S.chinensis fractions (n=3,± s)

表1 五味子各组分中木脂素含量(n=3, ± s)Table 1 Lignan contents of S.chinensis fractions (n=3,± s)
3.2 五味子各组分清除DPPH 自由基能力的测定
五味子各组分清除DPPH 自由基能力的大小顺序依次为:VC(0.17) > SC-50 (1.08) > SC-30(1.06)>SC-95 (20.64)>SC-70 (27.18)>SC-10 (33.43)>SC-0。SC-0 在38.00 mg/mL 时其清除率只为7%,受样品溶解度的限制,无法进一步加大样品浓度,且没有实际意义,所以没有求得具体IC50值。
五味子总提取物SC 经大孔树脂分离纯化所得的各组分,与SC 相比均具有极显著性差异(P<0.01);除SC-30 和SC-50 外,SC 和其余组分与阳性对照(Vc)比较,均具有极显著性差异(P<0.01),DPPH 自由基清除能力均低于Vc。
SC-30 和SC-50 的抗氧化能力明显强于其它组分,且清除DPPH 自由基能力相当,与SC 及其它组分段相比较具有极显著性差异(P<0.01)。
3.3 ABTS 法测定五味子各组分总抗氧化能力
结果显示,五味子各组分总抗氧化能力的大小顺序 为:SC-50 (5.127) > VC(1.000)>SC-30(0.765)> SC-70 (0.476)> SC-95 (0.058)>SC-10 (0.012)>SC-0。SC-0 其TEAC 值无限接近于0,没有抗氧化活性;SC-50 的抗氧化能力与其它组分相比,具有极显著性差异(P<0.01),且效果强于VC。
3.4 细胞增殖检测
3.4.1 不同浓度五味子组分对细胞生长的影响
采用MTT 法检测不同浓度五味子各组分对HaCaT 细胞生长得到影响。结果显示,SC-0 和SC-10 在<1000 μg/mL 时,除SC-10 在1000 μg/mL 时有细胞毒性之外,均不影响细胞的增殖;而其他组分在>500 μg/mL 时,均对细胞产生明显的细胞毒性,减少细胞增殖在23%~97%左右;SC-50 在100~250 μg/mL 之间时,对细胞有明显的增殖作用,细胞活力提高12%~18%左右,与正常对照组比较具有极显著差异。具体如图1 所示。
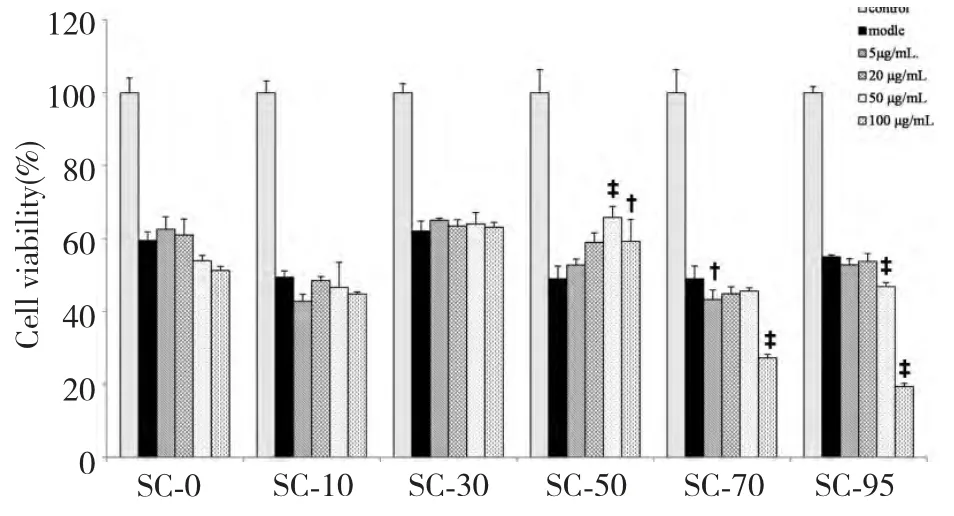
图1 五味子各组分对细胞生长的影响(n=6,± s)Fig.1 Effects of different fractions of S.chinensis on cell viability (n=6,± s)
3.4.2 五味子各组分对H2O2诱导细胞损伤的保护作用
根据筛选得到的五味子各组分的安全剂量范围,设定4 个不同剂量组,预处理时间为24 h,利用MTT 法判断各组细胞增值情况。结果显示,SC-0 在100~200 μg/mL、SC-30 在1~10 μg/mL 之间时,对H2O2诱导的细胞损伤具有一定的保护作用,但是与模型组比较差异无统计学意义(P<0.05);SC-10、SC-70 及SC-95 在安全剂量范围内,对细胞活力无明显变化;SC-50 处理组的细胞存活率较H2O2处理组明显提高(P<0.05,P<0.01),且呈剂量依赖性,但伴随浓度增加到一定程度,逐渐出现细胞凋亡甚至死亡,存活率开始下降。具体如图2 所示。
3.5 五味子组分对氧化损伤HaCaT 细胞MDA、SOD 和GSH 水平的影响

图2 五味子各组分对H2O2诱导HaCaT 细胞损伤的保护作用(n=6,± s)Fig.2 Protective effects of different fractions of S.chinensis against H2O2-induced oxidative stress injury in HaCaT cells (n=6,± s)
用1000 μmol/L H2O2处理HaCaT 细胞与空白相比,脂质氧化产物MDA 增加21%左右,抗氧化酶SOD 降低64%左右,GSH 降低49%左右;而用测试组分处理之后,明显降低了MDA 的生成,提高细胞内SOD 以及GSH 的活力(P<0.01)。150 μg/mL SC-50 能有效减少MDA 生成量在37%左右,有效增加SOD 量在2.7 倍左右,增加GSH 量在1.8 倍左右。具体见表2。
表2 SC-50 组分对HaCaT 细胞中MDA、SOD 和GSH 水平的影响(n=3, ± s)Table 2 Effects of SC-50 on cellular MDA,SOD and GSH in HaCaT cells (n=3,± s)
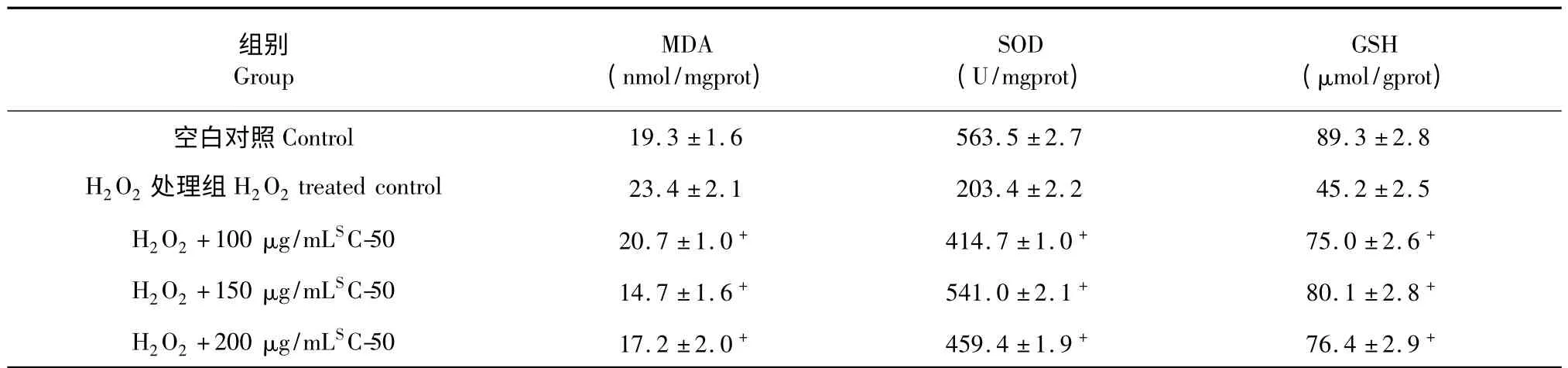
表2 SC-50 组分对HaCaT 细胞中MDA、SOD 和GSH 水平的影响(n=3, ± s)Table 2 Effects of SC-50 on cellular MDA,SOD and GSH in HaCaT cells (n=3,± s)
注:与H2O2处理组比较,+P <0.05;≠P <0.01。Note:Compared with H2O2treated control,+P <0.05;≠P <0.01.
4 讨论
中药“组分结构”理论认为,中药复方中各活性成分之间存在着一定的比例关系,组成物质基础的最基本单元为单体成分,具有稳定的结构;由同一化学类别的单体成分按照一定的比例构成组分,组分中各单体成分之间存在配伍配比关系;不同类别的组分按照一定的配伍比例组合构成中药复方的整体性物质基础[16]。因而本文以功能单位“组分”为基础进行五味子抗皮肤衰老方面的研究。
越来越多的研究表明,自由基可以从细胞水平、分子水平乃至组织器官水平上对机体造成各种不可逆性的氧化性损伤,加速生物体细胞乃至整个机体的衰老进程,诱发各种与衰老相关的各种疾病[17-19]。人体细胞各种来源的大量自由基当中,最引人关注、研究较多的是ROS。ROS 包括及HO2·、·OH 等。H2O2是细胞内一种重要的氧自由基,对人体皮肤细胞能造成直接的氧化应激反应和氧化应激所致的氧化性损伤。在体外利用H2O2能够诱导细胞并加速细胞因氧化应激所致的衰老进程,模拟体内氧化损伤的病理过程。
以DPPH 自由基清除能力和总抗氧化能力(ABTS 法)为考察指标,对五味子各组分的自由基清除能力进行评价,利用MTT 法筛选五味子各组分对H2O2诱导的HaCaT 细胞氧化应激损伤的保护作用,结果显示,50%乙醇洗脱组分有较强的自由基清除能力,并显著减少MDA 的生成,提高SOD 和GSH酶活性,这可能也是其对H2O2诱导的HaCaT 细胞损伤具有保护作用的重要机制之一。
在前人文献报道指出,联苯环辛烯类木脂素的抗氧化活性较好,本文检测分析的五味子甲素、乙素等5 种主要木脂素均报道具有抗氧化的活性。从木脂素含量分布来看,50%乙醇组分不是木脂素含量最高的组分,但是抗氧化活性最强的组分。这也使我们对中药“组分结构”理论有了进一步的理解和深思,进而开展进一步的试验研究。
1 Editorial Board of Flora of China (中国植物志编辑委员会).Flora of China (中国植物志).Beijing:Science Press,1996.252-252.
2 Lu H,Liu GT.Anti-oxidant activity of dibenzocyclooctene lignans isolated from Schisandraceae.Planta Med,1992,58:311-313.
3 Jang HI,Do GM,Lee HM,et al.Schisandra ChinensisBaillon regulates the gene expression of phase II antioxidant/detoxifying enzymes in hepatic damage induced rats.Nutr Res Pract,2014,8:272-277.
4 Sung M,Park SS,Kim SS,et al.Antioxidant activity and hepatoprotective effect ofSchizandra chinensisBaill.extracts containing active components in alcohol-induced HepG2 cells.Food Sci Biotechnol,2014,23:1615-1621.
5 Wang ZF (王征帆).Antioxidant activity of water extract of Chinese herbs used for protecting spleen and nourishing stomach.Nat Prod Res Dev(天然产物研究与开发),2013,25:1271-1273.
6 Jung CH,Hong MH,Kim JH,et al.Protective effect of a phenolic-rich fraction fromSchisandra chinensisagainst H2O2-induced apoptosis in SH-SY5Y cells.J Pharm Pharmacol,2007,59:455-462.
7 Cheng N,Ren NY,Gao H,et al.Antioxidant and hepatoprotective effects ofSchisandra chinensispollen extract on CCl4-induced acute liver damage in mice.Food Chem Toxicol,2013,55:234-240.
8 Mocan A,Crisan G,Vlase L,et al.Comparative studies on polyphenolic composition,antioxidant and antimicrobial activities ofSchisandra chinensisleaves and fruits.Molecules,2014,19:15162-15179.
9 Lu H,Liu GT.Effect of dibenzo[a,c]cyclootene lignans isolated from Fructus Schizandrae on lipid peroxidation and anti-oxidative enzyme activity.Chem Biol Interact,1991,78:77-84.
10 Cai J (蔡晶),Zhang Q (张庆),Xiao F(肖峰),et al.Schizandrin B protects human liver cells oxidized by peroxide.Nat Prod Res Dev(天然产物研究与开发),2014,26:766-769.
11 Hou W (侯微),Wei ZB (魏忠宝),Gao W (高薇),et al.Protective effects of schisandrin A,B and C on the oxidative damage of HaCaT cells.J Anhui Agri Sci(安徽农业科学),2013,41:1047-1049.
12 Lam PY,Yan CW,Chiu PY,et al.Schisandrin B protects against solar irradiation-induced oxidative stress in rat skin tissue.Fitoterapia,2011,82:393-400.
13 Chiu PY,Lam PY,Yan CW,et al.Schisandrin B protects against solar irradiation-induced oxidative injury in BJ human fibroblasts.Fitoterapia,2011,82:682-691.
14 Scherer R,Godoy HT.Antioxidant activity index (AAI)by the 2,2-diphenyl-1-picrylhydrazyl method.Food Chem,2009,112:654-658.
15 Hou W(侯微),Wei ZB (魏忠宝),Jiang YL (姜艳玲),et al.Estimation on external anti-oxygen activity in root,cane and stem ofschisandrafruit.Jilin Trad Chin Med(吉林中医药),2010,30:1086-1088.
16 Yan HM (严红梅),Chen XY (陈小云),Zhang ZH (张振海),et al.Discussion about research ideas of Chinese materia medica based on Chinese materia medica components and“composition structure”theory.Chin Tradit Herb Drugs(中草药),2015,46:1103-1110.
17 Schauen M,Hornig-Do HT,Schomberg S,et al.Mitochondrial electron transport chain activity is not involved in ultraviolet A (UVA)-induced cell death.Free Radic Biol Med,2007,42:499-509.
18 Ma W,Nunes I,Young CS,et al.Catalase enrichment using recombinant adenovirus protects alpha TN4-l cells from H2O2.Free Radic Biol Med,2006,40:335-340.
19 Kuro-o M,Matsumura Y,Aizawa H,et al.Mutation of the mouse klotho gene leads to a syndrome resembling ageing.Nature,1997,390:45-51.
