苦荞麦总黄酮对PA 诱导脐静脉内皮细胞DDAH2表达的影响
2015-01-08冯晓帆赵丹玉洪涌涛刘博通
冯晓帆,赵丹玉,柳 春,刘 恋,洪涌涛,刘博通
辽宁中医药大学基础医学院,沈阳 110847
苦荞麦[Fagopyrum tataricum(L.)Gaertn],又称乌麦、菠麦、花荞,属于双子叶蓼科荞麦属植物,在我国大面积种植,区域主要集中在我国西南部高海拔、高寒、高原地区[1]。《本草纲目》中曾记载其有降气宽肠健胃,行气化瘀的作用。
现代医学研究发现苦荞麦对控制Ⅱ型糖尿病血糖水平有积极作用。控制血糖水平的胰岛素分泌后经血液循环运输至毛细血管,在穿过血管内皮后作用于靶细胞,发挥其生物学效应。Ⅱ型糖尿病患者体内产生胰岛素的能力并没有彻底丧失,而是一种相对缺乏,正常水平的胰岛素不能充分产生生物学效应,此即胰岛素抵抗(insulin resistance,IR)。所以血管内皮对胰岛素的通透性是其最终能否充分发挥作用的关键。NO 是血管内皮细胞产生的重要血管舒张因子,其合成受胰岛素抵抗信号转导通路(ADMA/NO)的调控[2]。
本实验前期研究苦荞麦提取物苦荞麦总黄酮,发现其具有改善血管微循环的作用[3],在此基础上,进一步观察苦荞麦总黄酮对软脂酸(Palmitic Acid,PA)诱导的人脐静脉内皮细胞(EA.hy926)中二甲基精氨酸二甲胺水解酶Ⅱ(DDAH2)表达的影响以及对非对称二甲基精氨酸(ADMA)、NO 含量的影响,探讨苦荞麦总黄酮在Ⅱ型糖尿病发病过程中对胰岛素抵抗信号转导通路(ADMA/NO)的作用机制,为开发相关临床用药提供科研依据。
1 材料与仪器
1.1 实验用细胞株
EA.hy926 人脐静脉内皮细胞株(中科院上海生命科学研究院细胞资源中心)。
1.2 主要药品和试剂
苦荞麦总黄酮(日本三益制药株式会社,显色分光法测定药物样品中苦荞麦总黄酮浓度为991.65 mg/g),二甲双胍(上海生工生物工程有限公司,批号为XZ0630S4011Z),软脂酸(美国Sigma公司,批号为100M12021V)。
胎牛血清、DMEM 培养基、胰蛋白酶、双抗(美国Hyclone 公司),兔抗人DDAH2一抗、兔抗人ADMA 一抗、兔抗人NOX4一抗(美国Proteintech Group公司),羊抗兔IgG 二抗(Cell Signaling Technology公司),RT-PCR 引物、RT-PCR 试剂盒、DNA Marker(大连宝生物工程有限公司),NO 试剂盒(南京建成生物工程研究所),ADMA 试剂盒(上海酶联生物科技有限公司)。
1.3 主要仪器和设备
-80 ℃低温冰箱(德国西门子公司);生物安全柜(上海力申科学仪器有限公司);倒置显微镜(日本Olympus 公司);细胞培养箱(Thermo 公司);Anthos 2010 全自动酶标仪(奥地利CE 公司;台式冷冻高速离心机(湖南赫西仪器装备有限公司);Bio-Spec-nano 型紫外线可见分光光度计(日本岛津公司);梯度PCR 仪(Bio-Rad 公司);EPS300 型电泳仪(上海天能科技有限公司);G:BOX 系列凝胶成像系统(英国SYNGENE 公司);半干式转印仪(北京六一仪器厂);PVDF 膜(美国Millipore 公司)。
2 实验方法
2.1 细胞培养
在紫外灯灭菌后的超净工作台内进行操作,将EA.hy926 细胞株置于含10%胎牛血清的DMEM 完全培养基中,37 ℃的培养箱中常规培养、传代;取生长状态良好的细胞加入0.25%的胰酶400 mL/瓶对细胞消化;当镜下观察到有细胞脱落时,倒掉胰酶,加入DMEM 完全培养基终止反应;吹打细胞成单细胞悬液后,再分装置于37 ℃的培养箱中培养。
2.2 模型建立
取生长处于对数期且状态良好的细胞,先用胰酶消化后吹打均匀,用细胞计数板计数,将单细胞悬液的密度稀释到5 ×104后再接种到24 孔板上,200 μL/孔。为筛选出最适软脂酸造模浓度,设定正常对照组和4 个不同浓度梯度的软脂酸组,每组设6复孔,待细胞在37 ℃的培养箱中90%生长融合时,除正常对照组,其他各组分别加浓度为300、400、500、600 μmol/L 的软脂酸溶液,孵育1 h 后加入5 μL 浓度50 nmol/L 的胰岛素溶液;测定MTT,筛选出软脂酸造模的最佳浓度为600 μmol/L。
2.3 实验分组
分为对照组、模型组、苦荞麦总黄酮低、中、高剂量组和二甲双胍组共6 组,各加入含10% 胎牛血清的DMEM 完全培养基和浓度为50 nmol/L 的胰岛素,除对照组外其他各组加入浓度600 μmol/L 软脂酸;苦荞麦总黄酮组加入三种终浓度(31.25、62.5、125 μg/mL)的苦荞麦总黄酮分别1.25、2.5 μL 和5 μL;二甲双胍组加入终浓度2 mmol/L 二甲双胍4 μL。
2.4 生化指标测定
2.4.1 双抗体夹心法测定ADMA 含量
按照ADMA 检测试剂盒说明书操作:用ADMA抗体包被微孔板制固相抗体后,加入含有ADMA 的样本,再加入HRP 标记过的羊抗人抗体,构成抗体-抗原-酶标抗体复合物,洗涤后加底物TMB 显色,在酸的作用下由蓝色变为稳定的黄色,ADMA 含量与显色浅深正相关。于波长450 nm 测定各样本光密度。
2.4.2 硝酸还原酶法测定NO 含量
依照NO 试剂盒说明书操作,将紫外线可见分光光度计波长设为550 nm,测定各样本光密度,检测所有的硝酸盐和亚硝酸盐的含量。
2.4.3 RT-PCR 法测定DDAH2mRNA 表达
提取细胞的总RNA:将培养瓶里的细胞用预冷PBS 冲洗3 次后加入1 mL Trizol,转移到EP 管中吹打均匀,室温静置5 min 后加200 μL 氯仿,震荡15 s后室温静置5 min,4 ℃条件下12000 rpm,离心5 min,吸上清转移至新管并加入等体积异丙醇,混匀静置10 min 后4 ℃条件下12000 rpm,离心10 min,弃上清,加入75 %乙醇1 mL 用于沉淀洗涤,12000 rpm,4 ℃离心5 min,再次弃上清加DEPC 水溶解RNA 沉淀。
按试剂盒说明要求建立10 μL RT 反应体系,先用分光光度法测定细胞总RNA 浓度,加样量(μL)=0.5 μg/RNA 浓度(μg/μL),反应条件为30 ℃10 min,50 ℃30 min,95 ℃5 min,4 ℃∞;再建立25 μL PCR 反应体系,其中DDAH2上游引物序列5'-TTCTCCACCAACTCTGTCCTC-3',下游引物序列5'-CAACCGCTCGGATTTCTTA-3',扩增片段长度为949 bp,退火56 ℃;β-actin 上游引物序列5'-ACACGAAAGCAATGCTATCACCTC-3',下游引物序列5'-TGACAGCAGTCGGTTGGAGCGA-3',扩增片段长度为153 bp,退火60 ℃;反应条件设为94 ℃预变性2 min,94 ℃30 s,退火30 s,72 ℃45 s,40 个循环,72℃5 min,4 ℃∞。取PCR 扩增产物和marker 各5 μL 分别与含有核酸染料的1 μL 上样缓冲液混匀,经1.5%的琼脂糖凝胶电泳后,通过凝胶成像系统测定各组样本光密度值。计算目的基因条带与对应内参β-actin 条带光密度值的比值。
2.4.4 Western-blot 测定DDAH2蛋白表达
提取细胞的总蛋白:倒净培养瓶液体后加3 mL预冷PBS 清洗2 次,吸净PBS 后加200 μL 蛋白裂解液,转移至新EP 管中,冰上裂解30 min。4 ℃条件14000 rpm,离心10 min 后转移上清液至新管中。用BCA 试剂盒检测样本蛋白质浓度。
将各组样本与上样缓冲液混合,煮沸5 min,把上样量调整至55 μg 后进行10% SDS-PAGE 电泳,恒压进行90 min,再恒流转PVDF 膜90 min;5%脱脂奶粉封闭于37 ℃水浴中震荡1 h,加入一抗兔抗人(1/100 封闭液稀释),4 ℃过夜;TBST 冲洗3 次,加入HRP 标记的羊抗兔IgG(1/1000 封闭液稀释),37 ℃水浴中震荡2 h,TBST 冲洗4 次,DAB 显色。扫描条带分析,计算各组目的蛋白条带光密度值与对应内参GAPDH 蛋白条带光密度值的比值。
2.5 统计学处理
3 实验结果
3.1 人脐静脉内皮细胞中ADMA 含量的变化
模型组与对照组比较,ADMA 含量明显增加,有显著性差异(P<0.05);苦荞麦中、高剂量组与模型组比较,ADMA 含量明显减少,有显著性差异(P<0.05)(见表1)。
3.2 人脐静脉内皮细胞中NO 含量的变化
模型组与对照组比较,NO 含量明显减少,有显著性差异(P<0.05);苦荞麦中、高剂量组与模型组比较,NO 含量明显增加,有显著性差异(P<0.05)(见表1)。
表1 各组人脐静脉内皮细胞内ADMA 和NO 的含量(μmol/L,n=6,±s)Table 1 Contents of NO and ADMA in EA.hy926 cells of each group (μmol/L,n=6,± s)

表1 各组人脐静脉内皮细胞内ADMA 和NO 的含量(μmol/L,n=6,±s)Table 1 Contents of NO and ADMA in EA.hy926 cells of each group (μmol/L,n=6,± s)
注:与对照组比较,* P <0.05;与模型组比较,**P <0.05。Note:Compared with control group,* P <0.05;Compared with insulin resistance group,**P <0.05.
3.3 人脐静脉内皮细胞中DDAH2mRNA 表达情况
模型组与对照组比较,DDAH2mRNA 表达减少,有显著性差异(P<0.05);苦荞麦总黄酮组与模型组比较,DDAH2mRNA 表达增加,有显著性差异(P<0.05)(见图1、表2)。

图1 各组人脐静脉内皮细胞中DDAH2mRNA 和β-actin mRNA 表达Fig.1 Expression of β-actin mRNA and DDAH2mRNA in EA.hy926 cells of each group
表2 各组人脐静脉内皮细胞中DDAH2mRNA 相对表达(n=6, ± s)Table 2 Relative expression of β-actin mRNA and DDAH2mRNA in EA.hy926 cells of each group (n=6,± s)

表2 各组人脐静脉内皮细胞中DDAH2mRNA 相对表达(n=6, ± s)Table 2 Relative expression of β-actin mRNA and DDAH2mRNA in EA.hy926 cells of each group (n=6,± s)
注:与对照组比较,* P <0.05;与模型组比较,**P <0.05。Note:Compared with control group,* P <0.05;Compared with insulin resistance group,**P <0.05.
3.4 人脐静脉内皮细胞中DDAH2蛋白表达情况
模型组与对照组比较,DDAH2蛋白表达量减少,有显著性差异(P<0.05);苦荞麦总黄酮组与模型组比较,DDAH2蛋白表达量增加,有显著性差异(P<0.05)(见图2、表3)。
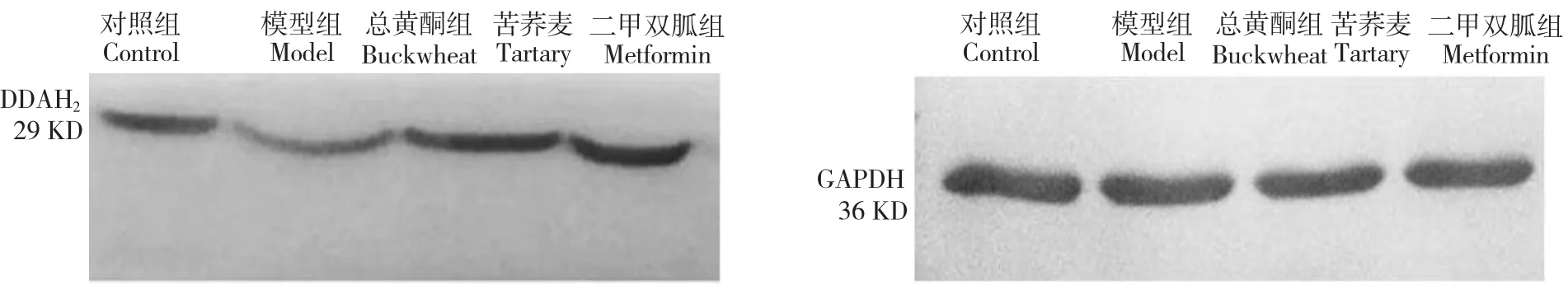
图2 各组人脐静脉内皮细胞中DDAH2蛋白和GAPDH 蛋白表达Fig.2 Expression of DDAH2protein and β-actin protein in EA.hy926 cells of each group
表3 各组人脐静脉内皮细胞中DDAH2蛋白相对表达(n=6,± s)Table 3 Relative expression of DDAH2protein and β-actin protein in EA.hy926 cells of each group (n=6, ± s)

表3 各组人脐静脉内皮细胞中DDAH2蛋白相对表达(n=6,± s)Table 3 Relative expression of DDAH2protein and β-actin protein in EA.hy926 cells of each group (n=6, ± s)
注:与对照组比较,* P <0.05;与模型组比较,**P <0.05。Note:Compared with control group,* P <0.05;Compared with insulin resistance group,**P <0.05.
4 讨论
本实验所检测的ADMA、NO、DDAH2为ADMA/NO 信号转导通路中的三项重要指标,该通路与Ⅱ型糖尿病的发生密切相关。其中ADMA 主要存在于血管内皮细胞中,超过90%的ADMA 可被甲基精氨酸二甲胺水解酶(DDAH)代谢[4]。DDAH 存在2种异构体:DDAH1和DDAH2,其中DDAH2主要在有eNOS 的组织中表达[5]。有资料显示,Ⅱ型糖尿病患者在内皮依赖性血管舒张功能减弱的同时会有ADMA 水平的升高,而且内皮功能失调的严重程度与血浆中ADMA 水平呈正相关[6-8];另有研究发现ADMA 血浆水平与NO 水平呈负相关:给予健康人高脂饮食,发现血浆中ADMA 浓度也升高,并且血流依赖的血管舒张作用减低,NO 血浆含量降低。NO 是内皮细胞产生的一种重要信号分子,NO 具有扩张血管、调节血压、抑制血管平滑肌细胞增殖等生物学作用,还可以使胰岛素信号转导通路中某些分子作用下降,进而影响胰岛素发挥正常的生物学效应,引起外周组织产生胰岛素抵抗(IR)[9]。IR 是指胰岛的β 细胞能分泌正常水平的胰岛素,但不能够使靶细胞产生正常的胰岛素效应,无法激活靶细胞内的相关信号转导途径,导致胰岛素相对不足[10]。IR引起对葡萄糖的利用能力降低,因为葡萄糖利用减少引起血糖水平升高,诱发Ⅱ型糖尿病,而代偿性胰岛素增加,可同时表现为高胰岛素血症。也有研究曾提示Ⅱ型糖尿病胰岛素敏感性与NO 之间的关系:当胰岛素敏感性降低出现IR 时,由于高血糖和高胰岛素血症的存在,能直接损伤血管内皮,引起NO 减少,进一步可降低相应受体对胰岛素的敏感性,加重IR[11]。
由上可知,ADMA/NO 信号转导通路中ADMA、DDAH2的基因及蛋白表达变化都会对NO 的含量产生影响,进而影响IR 及Ⅱ型糖尿病的发展。因此,无论是通过降低ADMA 水平来增加NO 合成;或者是通过提高DDAH2水平,增加对ADMA 的分解代谢来增加NO 合成,都能增加血管内皮细胞NO的释放量,提高血管通透性,使到达靶细胞的胰岛素增加,这对于缓解IR 十分重要。
根据文献中高浓度的PA 能够使血管内皮细胞受损引起IR[12],本实验以高浓度PA 作为造模条件,用于EA.hy926 细胞建立IR 细胞模型,成模后以不同浓度的苦荞麦总黄酮作为干予因素,检测各组ADMA 生成量、NO 释放量以及DDAH2基因和蛋白表达情况,探讨在IR 状态下,血管内皮受损伤的可能机制,进一步为苦荞麦总黄酮作为治疗Ⅱ型糖尿病的临床有效药物成分提供实验依据。模型组与对照组比较,ADMA 含量明显增加,DDAH2mRNA表达及蛋白表达减少,NO 含量明显减少,均有显著性差异(P<0.05),这一结果表明成功的建立了IR细胞模型;而苦荞麦中、高剂量组与模型组比较,ADMA 含量明显减少,DDAH2mRNA 表达及蛋白表达量增加,均有显著性差异(P<0.05),说明苦荞麦总黄酮能够降低血糖的机制可能是通过调节ADMA/NO 信号转导通路中ADMA、DDAH2的基因及蛋白表达变化来提高NO 的含量,进而抑制IR,控制Ⅱ型糖尿病的发展。
1 Wang W(王炜),Ou QM(欧巧明),Yang SZ(杨随庄).Research progress on chemical constituents and biological activity of Buckwheat.Rain Fed Crops(杂粮作物),2010,30:419-423.
2 Kubota T,Kubota N,Kumagai H,et al.Impaired insulin signaling in endothelial cells reduces insulin-induced glucose uptake by skeletal muscle.Cell Metab,2011,13:294-307.
3 Liu Y(刘洋),Liu C(柳春),Jin TLYL(近藤隆一郎),et al.Effect of buckwheat on blood glucose protein in diabetic rats.J Liaoning Univ Tradit Chin Med(辽宁中医药大学学报),2009,11:195-196.
4 Nijveldt RJ,Teerlink T,van Guldener C,et al.Handling of asymmetrical dimethylarginine and symmetrical dimethylarginine by the rat kidney under basal conditions and during endotoxaemia.Nephrol Dialysis Transplant,2003,18:2542-2550.
5 Achan V,Tran CT,Arriqoni F,et al.All-trans-retinoic acid increases nitric oxide synthesis by endothelial cells:a role for the induction of dimethylarginine dimethylaminohydrolase.Circ Res,2002,90:764-769.
6 Piatti P,Fragasso G,Monti I,et al.Acute intravenous L-arginine infusion in patients with angina pectoris and normal coronary arteriograms correlation with asymmetric dinethylarginine levels.Circμlation,2003,107:429-436.
7 Boger RH.The emerging role of asymmetric dinethylarginine as a novel cardiovascμlar risk factor.Cardiovase Res,2003,59:824-833.
8 Kielstein JF,Inprain R,Sinmel S,et al.Cardiovascμlar effects of system ic nitric oxide synthase inhibition with asymmetrical dinethylarginine in humans.Circμlation,2004,109:172-177.
9 Song CH(宋春红),Li RF(李瑞峰).Role of nitric oxide in the pathogenesis of type 2 diabetes mellitus.Chin J Endocrinol Metabol(中华内分泌代谢杂志),2005,226:409-419.
10 Zhao LJ(赵莉娟),Feng JL(冯俊俐).Traditional Chinese medicine treatment of type 2 diabetes insulin resistance.World J Integr Tradit Western Med(世界中西医结合杂志).2008,2:111-112.
11 Wang XY(汪晓云),Liao KL(廖昆灵),Lu W(卢薇),et al.Relationship between nitric oxide and insulin resistance in type 2 diabetes mellitus.Guizhou Med J(贵州医药),2001,25:18-19.
12 Kelsey MM,Forster JE,Van Pelt RE,et al.Adipose tissue insulin resistance in adolescents with and without type 2 diabetes.Pediatric Obesity,2014,9:373-382.
