异基因造血干细胞移植术后患者血CMV-DNA的定期监测及危险因素分析*
2015-01-07张三陵邓建川娄世锋
李 欢,张三陵,邓建川△,张 颖,娄世锋
(1.重庆医科大学附属第二医院血液内科 400010;2.重庆市涪陵区妇幼保健院保健科 408000)
论著·临床研究
异基因造血干细胞移植术后患者血CMV-DNA的定期监测及危险因素分析*
李 欢1,张三陵2,邓建川1△,张 颖1,娄世锋1
(1.重庆医科大学附属第二医院血液内科 400010;2.重庆市涪陵区妇幼保健院保健科 408000)
目的观察异基因干细胞移植术(allo-HSCT)后患者血液巨细胞病毒DNA(CMV-DNA)阳性率,探讨巨细胞病毒感染的危险因素。方法收集30例在2012年7月至2014年9月行allo-HSCT患者,用PCR方法定量检测患者移植术后第1个月(1次/周)、第2~3个月(1次/2周)、第4~6个月(1次/月)静脉血中CMV-DNA的拷贝数,统计各时期的阳性率。结果30例患者有13例感染巨细胞病毒,感染率为43.3%。第1个月内阳性患者有4例(13.3%),第2个月有11例(36.7%),第3个月有2例(6.7%),第4个月0例,第5个月有2例(6.7%),第6个月0例。异基因干细胞移植术后半年内第2个月患者CMV-DNA阳性率较高。相关分析提示CMV-DNA阳性率与兔抗人胸腺细胞免疫球蛋白(ATG)、巴利昔单抗(CD25单抗)的使用、急性移植物抗宿主病(GVHD)的发生程度有关,与性别、年龄、原发病危险分层、人类白细胞抗原(HLA)相合情况、预处理方案、中性粒细胞恢复时间等无关。结论定期监测allo-HSCT后患者血液CMV-DNA可及时干预,减少巨细胞病毒感染并发症。
造血干细胞移植;巨细胞病毒感染;风险分析
异基因造血干细胞移植(allogenic hematopoietic stem cell transplantation,allo-HSCT)为近年来恶性血液系统疾病治疗的重要方法,能有效缓解病情的进展甚至治愈某些恶性血液肿瘤,显著延长患者的生存时间。然而,allo-HSCT后巨细胞病毒(cytomegalovirus,CMV)感染可导致严重相关并发症,目前仍是移植后患者死亡的重要原因[1-2],因此allo-HSCT后定期监测血CMV-DNA水平对于CMV感染的早期发现和治疗具有重大意义。本文对30例行allo-HSCT的患者行回顾性分析,探讨异基因移植后CMV感染的定期监测情况,并分析相关危险因素。
1 资料与方法
1.1 一般资料 连续收集2012年6月至2014年9月30例在重庆医科大学附属第二医院行allo-HSCT患者,男18 例,女12例,中位年龄42岁(12~60岁),其中急性髓系白血病(AML)12例,慢性髓细胞白血病(CML)7例,慢性淋巴细胞白血病(CLL)3例,急性淋巴细胞白血病(ALL)3例,重型再生障碍性贫血(SAA)2例,MDS转AML-M2 2例,非霍奇金淋巴瘤(NHL)1例。13例单倍体相合造血干细胞移植,6例人类白细胞抗原(HLA)无关供者全相合造血干细胞移植,11例HLA亲缘全相合移植。外周血干细胞移植10例,外周血干细胞+骨髓混合移植5例,外周血干细胞+骨髓+脐带血间充质干细胞混合移植15例。移植前供、受者血清CMV PCR均阴性,25例移植前化疗1~2疗程后达到完全缓解,5例为未缓解。
1.2 方法
1.2.1 预处理方案 全相合造血干细胞移植患者预处理方案:采用改良Bu+Cy(移植前7~5 d,Bu 1 mg/kg,每6小时1次,口服;移植前4~3 d,Cy 50 mg·kg-1·d-1,静脉注射),3例ALL患者在此方案基础上均加用尼莫司汀(250 mg/m2,口服,移植前3 d);SAA亲缘全相合移植采用Flu+Cy(移植前10~5 d,Flu 25 mg·m-2·d-1,静脉注射;移植前4~3 d Cy 50 mg·kg-1·d-1,静脉注射)。单倍体造血干细胞移植患者采用Flu+Bu+Cy(移植前10~6 d,Flu 25 mg·m-2·d-1,静脉注射;移植前6~4 d,Bu 1 mg/kg,每6小时1次,口服;移植前3~2 d,Cy 50 mg·kg-1·d-1,静脉注射)。
1.2.2 移植物抗宿主病(GVHD)预防 GVHD预防常规采用短程MTX 加环孢菌素方案,13例单倍体移植患者移植前加用吗替麦考酚酯、移植前3~2 d加用抗胸腺细胞球蛋白(ATG) 2.5 mg·kg-1·d-1,移植0天予注射巴利昔单抗(抗CD25单抗)。移植后对发生GVHD患者可给予糖皮质激素、环孢素、他克莫司、吗替麦考酚酯治疗。GVHD的诊断标准符合美国西雅图Fred Hutchinson癌症研究中心关于GVHD的诊断分度[3]。发生GVHD 0~Ⅰ度14 例,Ⅱ度10 例,Ⅲ度 4例,Ⅳ度2例。
1.2.3 肝静脉阻塞综合征(VOD)预防 移植前10 d开始使用前列地尔、复方丹参、低分子肝素预防VOD,血小板小于20×109/L时停用复方丹参、低分子肝素。
1.2.4 病毒感染的预防 移植前1周亲缘全相合移植患者口服阿昔洛韦0.4 g 3次/天;无关供者及单倍体相合移植患者静滴更昔洛韦0.25 g 1次/天移植当天停药。移植后采用PCR方法定期检测血CMV-DNA水平,CMV-DNA>500 copy/mL为CMV阳性,若患者出现CMV阳性则给予更昔洛韦或膦甲酸钠抗病毒治疗直至CMV转阴,后续给予口服阿昔洛韦预防治疗至移植后6个月。
1.2.5 CMV感染诊断标准 CMV可在多部位引起感染,包括间质性肺炎、胃肠炎、肝炎、膀胱炎、视网膜炎等器官或组织损害。CMV病:病原学检测明确有CMV 感染,并出现发热或出现符合CMV感染的其他临床症状[4],本院采用PCR荧光定量方法检测患者异基因造血干细胞移植后第1个月(每周1次)、第2~3个月(每2周1次)、第4~6个月(每月1次)静脉血中CMV-DNA的拷贝数,血浆CMV-DNA>500 copy/mL为阳性。
1.3 统计学处理 采用SPSS17.0版统计软件分析数据,单因素分析采用χ2检验,多因素分析采用Logistic回归分析,以α=0.05作为检验水准,以P<0.05为差异有统计学意义。
2 结 果
2.1 CMV-DNA阳性情况 30例allo-HSCT后半年内,有13例出现CMV病毒感染临床症状及血浆中检测CMV-DNA>500 copy/mL,阳性率为43.3%。最早阳性时间为移植后13 d,最晚发生时间为移植后120 d,7例出现胃肠道感染(53.8%),5例出现CMV出血性膀胱炎(38.4%),1例出现CMV感染相关性肺炎(7.7%),13例经积极抗病毒治疗,12例临床感染症状好转,复查CMV-DNA指标转阴,其中1例治疗后感染复发,经调整环孢素浓度、应用阿昔韦抗病毒及膦甲酸钠治疗后转阴。1例CMV感染合并出血性膀胱炎患者积极抗病毒治疗后无效死亡。allo-HSCT后第1、2、3、4、5~6、7~8、9~10、11~12、13~16、17~20、21~24周,监测血CMV-DNA阳性情况为0、1(3.3%)、1(3.3%)、2(6.6%)、6(20.0%)、5(16.7%)、2(6.6%)、1(3.3%)、0、2(6.6%)、0。统计结果显示造血干细胞移植后半年内第5到第8周血CMV阳性率较高。
2.2 CMV感染单因素相关分析 从单因素相关分析看,allo-HSCT后CMV感染与性别、年龄、原发病危险分层、HLA相合情况、预处理方案、中性粒细胞植入时间等无明显相关,但与兔抗人胸腺细胞免疫球蛋白(ATG)使用、巴利昔单抗使用、GVHD发生程度等有相关性,具有统计学意义。CMV感染在ATG使用者、巴利昔单抗未使用者、Ⅱ~Ⅳ度GVHD患者更高,见表1。

表1 CMV感染单因素相关分析[n(%)]
2.3 CMV感染的多因素Logistic回归分析 对上述因素采用Logistic回归分析,显示CMV阳性与ATG使用、巴利昔单抗使用、GVHD发生程度等有相关性,差异有统计学意义(P<0.05),见表2。
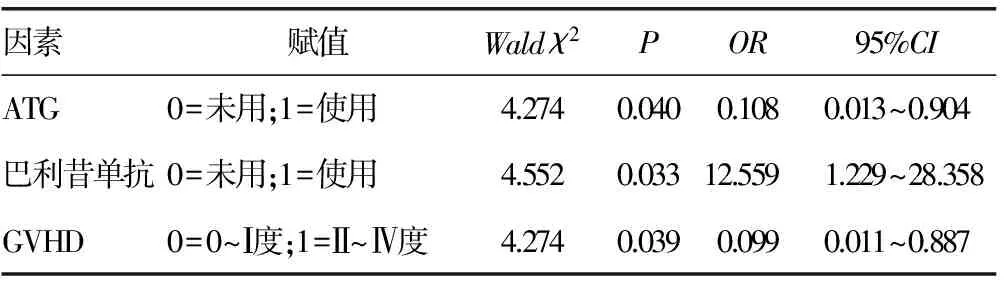
表2 CMV感染的多因素Logistic回归分析
3 讨 论
CMV感染是allo-HSCT后严重并发症,定期监测血CMV-DNA水平对及早处理并发症,提高移植成功率具有重要意义。本次分析显示造血干细胞移植后半年内第2个月CMV的感染率较高,这可能与该阶段造血功能已逐渐恢复、免疫抑制剂使用率高、GVHD发生率增加有关。本文进行的相关分析亦提示与免疫抑制剂ATG的使用、GVHD的发生程度呈正相关。
Zawilińska等[5]对35例allo-HSCT患者外周血病毒感染分析发现80.0%的患者出现混合性疱疹病毒感染,以2到3种病毒混合感染为主,尤其是CMV和EBV(65.0%),表明行allo-HSCT后出现严重的CMV感染不仅仅是因为CMV本身的致病特性,也包括其他病毒混合感染的累加效应。有研究显示造血干细胞移植后100 d内的血液病毒感染发生率达42.0%[6],可能与移植前大剂量的放化疗造成患者消化道黏膜损伤、中性粒细胞缺乏及免疫功能低下等原因导致早期感染有关。CMV急性或反复感染有多种临床表现,轻者可无明显症状或仅表现为巨细胞病毒血症,重者可引起全身多系统受累甚至危及生命,如果不治疗,CMV病死率为90.0%左右。因此,强调早期发现并及时治疗尤为关键。
造血干细胞移植术后CMV 感染与术后预防和治疗GVHD过程中免疫抑制剂的应用及机体免疫功能密切相关。ATG作为一种较强的免疫抑制剂,可对抗人T淋巴细胞,抑制细胞介导免疫。本研究中30例患者有13例患者在GVHD的预防中使用ATG,其中9例有CMV感染,感染率较高。巨细胞病毒是一种机会性感染病毒,对于体内潜伏CMV患者,体内免疫抑制药物浓度升高容易导致CMV 病[7],这可能是导致使用ATG患者CMV感染率较高的原因。相关文献显示CMV可以通过改变宿主细胞表面抗原引起GVHD[8]。而对于GVHD的免疫抑制治疗又会增加巨细胞病毒等其他机会性病毒的感染风险,两者可形成一个恶性循环,不利造血干细胞移植后免疫重建。虽然有报道allo-HSCT后CMV的复制可以诱导抗肿瘤效应,但ATG的使用增加CMV感染风险,最终并不带来益处[9]。故对于免疫功能抑制、功能低下及免疫功能未重建的allo-HSCT患者而言,需要在移植后定期监测CMV-DNA,及时早期发现并积极治疗才能有效降低CMV感染率[10]。
抗CD25单克隆抗体(巴利昔单抗)是一种人与鼠嵌合型单抗,它能在T细胞克隆增殖前抑制白介素-2介导的T淋巴细胞活化与增殖,具有选择性抑制T细胞功能,从而达到预防造血干细胞移植后GVHD的作用[11]。相关研究显示,在无关供者及单倍体造血干细胞移植中应用巴利昔单抗替代ATG预防GVHD取得了良好的效果[12-14],巴利昔单抗具有预防和治疗单倍型骨髓移植GVHD效应,临床显示对免疫功能重建无明显影响,应用巴利昔单抗没有增加骨髓移植患者白血病的复发和感染率。同时,本研究显示预防GVHD使用抗CD25单抗患者比未使用者CMV感染率低,考虑与使用巴利昔单抗后患者免疫重建未受到明显影响有关。因此,预防GVHD可考虑采用ATG联合巴利昔单抗,既增加抗GVHD效应,同时不增加CMV感染风险。
GVHD程度与CMV感染亦具相关性,GVHD Ⅱ~Ⅲ度患者具有较高的CMV感染风险。本研究结果GVHD 0~Ⅰ度患者CMV阳性率为21.4%,GVHD Ⅱ~Ⅳ度患者CMV阳性率为62.5%,与文献报道一致[15]。严重GVHD患者需要使用更多免疫抑制剂,这就可能增加CMV感染风险。因此,合理选择药物,适时预防GVHD可一定程度减少CMV感染率。
对于CMV感染的治疗,在预处理期间常规应用阿昔洛韦预防感染,临床治疗上首选更昔洛韦和膦甲酸钠,更昔洛韦较膦甲酸钠对巨细胞病毒的感染治疗更具特异性,然而其常见的不良反应为骨髓抑制,对于移植后粒缺或者血小板重度减少的感染患者不宜使用;膦甲酸钠的骨髓抑制作用少见,而且适用于免疫功能损害耐阿昔洛韦的巨细胞感染,其较为常见的不良反应为肾功能损伤及电解质紊乱,对肾功能异常的感染患者应慎用。郭智等[16]对140例allo-HSCT后巨细胞病毒感染患者使用阿昔洛韦或膦甲酸钠的近期疗效可靠,并未出现明显脏器损伤。本院移植的30例患者采用PCR方法对患者外周血CMV-DNA定期监测,及时给予阿昔洛韦、膦甲酸钠及丙种球蛋白抗病毒抢先治疗,获得了较好的效果,13例感染患者仅1例死于CMV相关出血性膀胱炎。
本研究例数较少,仅是对allo-HSCT后早期阶段CMV-DNA阳性情况分析,对移植后长期生存患者CMV感染情况,有待今后进一步分析。
[1]Mir MA,Battiwalla M.Immune deficits in allogeneic hematopoietic stem cell transplant(HSCT) recipients[J].Mycopathologia,2009,168(6):271-282.
[2]Rafailidis PI,Mourtzoukou EG,Varbobitis IC,et al.Severe cytomegalovirus infection in apparently immunocompetent patients:a systematic review[J].Virol J,2008,5:47.
[3]Shaukat A,Bakri F,Young P,et al.Invasive filamentous fungal infections in allogeneic hematopoietic stem cell transplant recipients after recovery from neutropenia:clinical,radiologic,and pathologic characteristics[J].Mycopathologia,2005,159(2):181-188.
[4]Joos L,Chhajed PN,Wallner J,et al.Pulmonary infections diagnosed by BAL:a 12-year experience in 1 066 immunocompromised patients[J].Respir Med,2007,101(1):93-97.
[5]Zawilińska B,Kosz-Vnenchak M,Piatkowska-Jakubas B,et al.Herpesviruses mixed infections in allogeneic steam cell recipients (allo-HSCT)[J].Przegl Epidemiol,2008,62(1):39-46.
[6]Bock AM,Cao Q,Ferrieri P,et al.Bacteremia in blood or marrow transplantation patients:clinical risk factors for infection and emerging antibiotic resistance[J].Biol Blood Marr Transpl,2013,19(1):102-108.
[7]Sarmiento J,Rodrigez-Molina J,Fernandez-Yanez J,et al.IgG monitoring to identify the risk for development of infection in heart transplant recipient[J].Transpl Infect Dis,2006,8(1):49-53.
[8]Appleton AL,Sviland L.Pathogenesis of GVHD:role of herpes viruses[J].Bone Marrow Transplant,1993,11(5):349-355.
[9]Busca A,Passera R,Pini M,et al.The use of ATG abrogates the antileukemic effect of cytomegalovirus reactivation in patients with acute myeloid leukemia receiving grafts from unrelated donors[J].Am J Hematol,2015,90(6):117-121.
[10]Gerna G,Baldanti F,Middeldorp J,et al.Use of CMV transcripts for monitoring of CMV infections in transplant recipients[J].Int J Antimicrob Agents,2000,16(4):455-460.
[11]Przepiorka D,Kernan NA,Ippoliti C,et al.Daclizumab,a humanized anti-interleukin-2 receptor alpha chain antibody,for treatment of acute graft-versus-host disease[J].Blood,2000,95(1):83-89.
[12]胡亮钉,陈虎,江岷,等.CD25单克隆抗体在无血缘关系供者造血干细胞移植中预防急性移植物抗宿主病的临床研究[J].中华血液学杂志,2006,27(7):495-496.
[13]纪树荃,陈惠仁,王恒湘,等.G-CSF预处理供者单倍体相合骨髓移植加用CD25 单克隆抗体预防急性GVHD的临床研究[J].中国实验血液学杂志,2002,10(5):447-451.
[14]孙丽华,孟庆祥,王钧,等.抗CD25单抗与抗胸腺细胞球蛋白在半相合造血干细胞移植中疗效分析[J].解放军医药杂志,2013,25(7):42-45.
[15]陈列光,罗依,胡永仙,等.异基因造血干细胞移植后长期生存患者CMV 感染的监测[J].中华医学杂志,2014,94(40):3145-3149.
[16]郭智,陈惠仁,刘晓东,等.异基因造血干细胞移植后发生巨细胞病毒感染的临床分析[J].中国实验血液学杂志,2012,20(4):971-974.
Regular monitoring plasma CMV-DNA level and risk factors analyzing after allogenic hematopoietic stem cell transplantation*
LiHuan1,ZhangSanling2,DengJianchuan1△,ZhangYing1,LouShifeng1
(1.DepartmentofHematology,SecondAffiliatedHospitalofChongqingMedicalUniversity,Chongqing400010,China; 2.DepartmentofHealth,MaternalandChildHealthHospitalofFulingDistrict,Chongqing408000,China)
ObjectiveTo observe the positive rate of plasma cytomegalovirus DNA(CMV-DNA) level after allogenic hematopoietic stem cell transplantation (allo-HSCT),analysis and explore the risk factors related to CMV infection.MethodsChoose 30 patients who had performed allo-HSCT in our department from July 2012 to September 2014.PCR were used regularly to detect the plasma CMV-DNA levels in these patients.The regular monitoring times were as follow:the first month(once a week),the second to third month(twice a week),the fourth to sixth month(once a month) after allo-HSCT respectively.The positive rates were counted in every period.ResultsThirteen patients had CMV infection,and the infection rate were 43.3%.In the first month,there were 4 cases (13.3%)whose plasma CMV-DNA levels were positive,however,the positive cases in the second month,the third month,the fourth month,the fifth month and the sixth month were 11(36.7%),2(6.7%),0,2(6.7%) and 0 respectively.Statistical data showed that it was in the second month after allo-HSCT that the CMV-DNA positive rate was higher than other periods.The analysis suggested that the positive rate of CMV-DNA related to the administration of rabbit anti-human thymocyte globulin(ATG),basiliximab,and the occurrence of acute graft versus host disease(GVHD),there were no relationship among gender,age,risk stratification of primary disease ,HLA condition,preparative project,recovery time of neutrophile granulocyte.ConclusionIt is necessary and beneficial to monitor blood CMV-DNA level regularly and take treatment early to avoid CMV related comobidity after allo-HSCT.
hematopoietic stem cell transplantation;cytomegalovirus infections;risk analysis
10.3969/j.issn.1671-8348.2015.29.002
重庆市科委自然科学基金资助项目(cstc2011jjA10064)。
:李欢(1991-),硕士,主要从事血液病方面的研究。△
,Tel:15902305571;E-mail:dengjccq@163.com。
R551.3
A
1671-8348(2015)29-4036-03
2015-04-18
2015-07-20)
