不同培养基对辣椒花药培养的影响
2015-01-06魏兵强陈灵芝王兰兰
张 茹,魏兵强,陈灵芝,王兰兰
(甘肃省农业科学院蔬菜研究所,甘肃 兰州 730070)
不同培养基对辣椒花药培养的影响
张 茹,魏兵强,陈灵芝,王兰兰
(甘肃省农业科学院蔬菜研究所,甘肃 兰州 730070)
以6个辣椒品种为试材,采用正交试验,研究不同培养基,添加不同浓度的NAA、6-BA,采取不同低温处理时间对辣椒花药培养愈伤组织诱导率的影响。结果表明,甜椒类型愈伤组织诱导率较辣椒类高,MS培养基添加0.50 mg/L NAA及0.50 mg/L 6-BA、低温处理48 h的诱导效果最为显著。
辣椒;花药培养;愈伤组织;培养基
相对于光皮辣椒类型,皱皮型辣椒(亦称螺丝椒)果皮角质薄、果实较长、果肉味道鲜香,符合西北市场消费习惯,深受消费者青睐。近年来,随着皱皮辣椒的推广,南方及东北地区种植面积也逐渐扩大。目前主栽的皱皮辣椒品种多为F1代杂交种,其产量高,适应性强,杂种优势明显。然而随着辣椒产业的发展,国内外市场竞争日益加重,对品种的要求越来越高,市场针对性越来越强。为了加快皱皮辣椒育种进程,提高育种效率,选育出强优势组合,利用花药和小孢子培养方法是优势育种最为理想的手段之一[1]。
不同培养基对不同材料花药培养效果的影响十分显著[2]。在辣椒单倍体诱导中,采用的培养基主要有Cp、MS、N、NLN、B5、MS等[3-4]。Lantos等采用W14、B5、MS和NLN培养基,对12个甜椒杂种一代的小孢子进行培养,发现B5和 W14培养基最优[5-6]。在相同的培养条件下,不同基因型辣椒的单倍体诱导率有很大差异[7-8],适于甜椒花药培养的培养基不一定适于辣椒的花药培养,适于光皮辣椒花药培养的培养基不一定适于皱皮辣椒的花药培养。我们采用4种常用培养基、6种不同基因型辣椒(甜椒、光皮辣椒、皱皮辣椒)作为供试材料进行花药培养试验,以期为辣椒花药培养寻找快捷便利的方法与再生培养体系。
1 材料与方法
1.1 供试材料
供试辣椒类型及来源见表1。
1.2 试验方法
试验于2012年在甘肃省农业科学院兰州试验地进行。1月25日播种,3月28日定植于塑料大棚,正常管理。5月于初花期开始时对各基因型材料混合取样。取样时间为7:00~8:00时或17:00时以后,采集萼瓣比接近为1的花蕾(小孢子处于单核靠边期)。将采集的样品带回实验室,于4℃低温预处理48 h。将样品用自来水冲洗20 min,再经70%酒精浸泡20 s后用1%的升汞浸泡10 min,无菌水冲洗3~4次。无菌条件下,将花药接种于培养基上。将接种好的培养皿放入35℃的恒温培养箱中黑暗培养8 d,以25℃的恒温培养箱中黑暗培养8 d为对照。再转入光照培养箱中暗培养至有胚状体长出,培养条件为温度白天(25±0.5)℃、夜晚(23±0.5)℃,光照度15 lx,光照16 h/d。当花药分化出幼小胚状体时,将胚状体接种到无激素培养基中,进一步分化成苗。

表1 供试辣椒类型及来源
采用正交试验L24(61×44)设计,试验因素及水平见表2,每组试验接种花药100枚。

表2 试验因素及水平
1.3 数据统计与分析
花药接种培养40 d后统计分析各处理辣椒花药形成的愈伤组织诱导率。
愈伤组织诱导率(%)=(愈伤组织产生数/接种花药总数)×100
2 结果与分析
2.1 不同处理下愈伤组织诱导率正交试验结果及极差分析
从表3可以看出,处理5、6、4、16、8组合的愈伤组织诱导率较高,极差分析结果(表4)表明,各因子对辣椒愈伤组织诱导率大小的影响顺序由大到小依次为是D、C、A、B、E,相对应的因子依次为NAA、6-BA、材料、培养基及低温处理。其中供试材料M2诱导率高。MS培养基有较强的普适性(图1),添加0.50 mg/L NAA及0.50 mg/L 6-BA的诱导效果最为显著。低温处理的时间为48 h为适宜。综合来看,A2B1C3D3E3为该愈伤组织诱导率最高的处理组合。

表3 不同处理辣椒花药愈伤组织诱导率的正交试验结果

图1 MS培养基上形成的花药愈伤组织

表4 不同处理辣椒花药愈伤组织诱导率的极差分析
2.2 不同处理下愈伤组织诱导率的方差分析
方差分析及新复极差测验多重比较结果(表5、6)表明,因子D与其余各因子之间差异达极显著水平;因子C与因子A差异显著,与因子B、因子E差异极显著;因子A与因子B差异显著,与因子E差异极显著;因子B与因子E差异显著。

表5 不同处理辣椒花药愈伤组织诱导率的方差分析
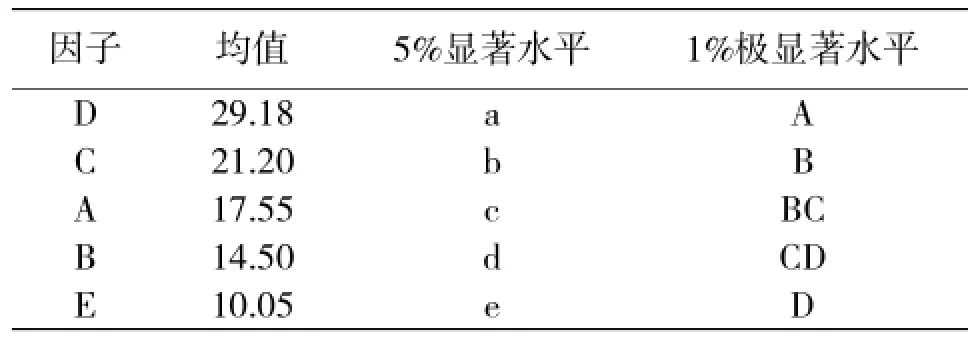
表6 辣椒花药愈伤组织诱导率新复极差测验多重比较
3 小结与讨论
1)研究结果表明,在辣椒花药培养中,影响愈伤组织诱导率的因子由大到小依次为NAA、6-BA、基因型、培养基及低温处理。其中,甜椒类型诱导率较辣椒类型高,MS培养基中添加0.50 mg/L NAA及0.50 mg/L 6-BA适合辣椒花药培养,有较强的普适性;低温处理48 h的诱导效果最为显著。2)辣椒花药培养因培养基的种类、辣椒基因型、激素的配比以及培养条件的不同,一直是众多学者研究的重点内容[9-10]。培养基的选择对于辣椒花药培养十分重要。现已报道的适宜辣椒花药培养的培养基有NTH、N6、Cp培养基等[11-12],但是这些培养基较MS、B5等培养基配方复杂,使用范围窄,因此,利用MS、B5等常用培养基摸索培养条件,对简化培养条件、提高培养效率,加速辣椒花药培养的步伐有着重要意义[13]。本研究中,MS培养基就表现出良好的效果,诱导率高于其他培养基,这可能与本试验中的操作、供试材料基因型的选择有关。
3)花药培养过程中在培养基中添加适当浓度的激素,能够促进愈伤组织和胚状体的形成。本研究采用的NAA对辣椒花药培养中愈伤的形成具有明显的作用,并且NAA与6-BA有着较好的协同作用,在二者的共同作用下,辣椒花药愈伤有着较高的发生频率。NAA与6-BA的浓度不宜太大,都为0.5 mg/L,这与其他研究人员结论一致[14]。激素对辣椒花药培养的影响为极显著,选择激素的种类及用量对辣椒花药培养中愈伤组织和胚状体的形成极为重要。
4)辣椒的基因型也是影响辣椒花药培养的因素之一。辣椒花药培养研究的初期,研究者认为甜椒类型较辣椒类型的培养率高,但随着研究方法的进步与深化,辣椒类型的诱导率有明显提高。低温处理可在一定程度上延缓小孢子退化,提早雄核发育,并增加参与雄核发育小孢子的比率,从而有利于愈伤组织的发生。将辣椒花蕾进行不同时间段的低温处理以便提高诱导率。本研究表明,经过48 h的低温处理,大大提高了花药愈伤组织的形成,这与他人研究结果相同[15]。
[1] 陈 斌,耿三省,张晓芬,等.辣椒单倍体培养研究进展[J].长江蔬菜,2007(12):36-41.
[2] 张树根,沈火林,蒋钟仁,等.辣椒花药培养单倍体育种技术研究进展[J].辣椒杂志,2006(3):1-6.
[3] 王立浩,张宝玺.辣椒花药培养研究进展[J].中国蔬菜,2001(3):52-53.
[4] 杨博智,周树栋,张竹青,等.不同培养基和激素对辣椒花药培养的影响[J].湖南农业大学学报,2009,35(1):61-64.
[5] LANTOS C,JUHÁSZ A G,VÁGI P,et al.Androgenesis induction in microspore culture of sweet pepper (Capsicum annuum L.)[J].Plant Biotechnology Report,2012(6):123-132.
[6] 张正海,毛胜利,王立浩,等.辣椒单倍体离体诱导及育种应用[J].园艺学报,2012,39(9):1 715-1 726.
[7] NOWACZYK P,NOWACZYK L,OLSZEWSKA D,et al.Androgenic response of genotypes selected from Capsicum annuum L.×C.chinense Jacq.Hybrids[J].Acta Physiol Plant,2009,31:877-879.
[8] NOWACZYK P,OLSZEWSKA D,KISIALA A.Individual reaction of Capsicum F2 hybrid genotypes in anther cultures[J].Euphytica,2009,168:225-233.
[9] 张 芳,李海涛,张馨宇.碳源组分及浓度对辣椒花药培养的影响[J].西北农业学报,2009,18(5):341-345.
[10] 刘广霞,张晓伟,蒋武生,等.温度及培养基中添加物对辣椒花药培养胚状体诱导的影响[J].河南农业科学,2009(5):97-100.
[11] 王立浩,张宝玺,郭家珍,等.辣椒花药培养中若干影响因素的研究[J].园艺学报,2004,31(2):199-204.
[12] 李春玲,佟曦然,朱至清,等.辣(甜)椒游离小孢子培养中的雄核发育和胚胎发生[J].园艺学报,2008,35(11):1 613-1 620.
[13] JIYEON KIM,YOUNG SOON KIM,GIBUM YI,et al.Anther culture of transgenic pepper(Capsicum annuum L.)[J].Korean Journal of Breed,2005,37(4):241-246.
[14] ZHAO JI,ZOU XUEXIAO,ZHANG ZHUQING,et al.Influences of carbon sources and plant growth regulators on anther culture efficiency of pepper[J].Agricultural Science and Technology,2010,11(4):102-105.
[15] 刘晓荣,陶承光,吕书文,等.番茄花药培养的影响因素研究[J].河南农业科学,2008(7):94-97.
(本文责编:陈 伟)
Effects of Different Media on Cultured Anther of Pepper (Capsicum annuum L.)
ZHANG Ru,WEI Bingqiang,CHEN Linzhi,WANG Lanlan
(Institude of Vegetable,Gansu Academy of Agricultural Science,Lanzhou Gansu 730070,China)
Using orthogonal experiment,six pepper varieties(Capsicum annuum L.)are selected as materials,the effects of different media on cultured anther of pepper are studied,which pepper varieties,culture medium,two kind of plant growth regulator NAA,6-BA and treatment time in low temperature.The result shows that the effect of NAA is better than others among the five factors,the effects of sweet pepper are better than others pepper varieties,MS medium is fit for anther culture,the processing time is 48 hours in 4℃.
Pepper;Anther culture;Callus;Medium
S641.3
A
1001-1463(2015)07-0025-04
10.3969/j.issn.1001-1463.2015.07.009
2015-04-23
农业部园艺作物学与种质创制学科群西北地区蔬菜科学观测实验站项目(2015-A2621-620321-G1203-066);兰州市科技计划项目(2011-1-152);甘肃省农业科学院农业科技创新专项(2013GAAS32)
张 茹(1978—),女,甘肃兰州人,副研究员,博士,主要研究生物技术在蔬菜育种中的应用。联系电话:(0)13609395567。E-mail:chouruer@163.com
