流式细胞仪测定百合花粉倍性的研究
2015-01-06吴青青胡小京杨雪莲夏景风
吴青青,胡小京,黄 伟*,杨雪莲,夏景风,鲁 周
(1.贵州省园艺研究所,贵州贵阳 550006;2.贵州大学农学院,贵州贵阳 550006)
流式细胞仪测定百合花粉倍性的研究
吴青青1,胡小京2,黄 伟1*,杨雪莲2,夏景风2,鲁 周1
(1.贵州省园艺研究所,贵州贵阳 550006;2.贵州大学农学院,贵州贵阳 550006)
[目的]为利用百合未减数花粉进行有性多倍化育种。[方法] 利用流式细胞仪测定百合花粉的倍性,以Marlon、Viviana的花粉为材料,以叶片为对照,比较两种不同细胞核提取液的效果差异。[结果] CyStain UV Precise T提取液明显优于WPB提取液;Marlon、Vivian叶片测定结果显示其为二倍体,花粉测定的图像显示两个品种都能自发产生2n花粉。[结论] 流式细胞仪可以快速地测定百合花粉的倍性。
流式细胞仪;百合;花粉;倍性
百合为百合科百合属多年生球根花卉,性喜高原山地冷凉气候。野生种在我国云贵高原等海拔2 000 m左右地区广泛分布,其切花商业品种也多种植于海拔2 300 m左右的地区。
百合商业品种是全球花卉市场主流切花之一,受到欧美、亚洲消费者的广泛喜爱,具有广阔的市场。百合商业品种有高度杂合性,染色体同源性较差。这些杂交种通常都会自发地产生未减数花粉。这些花粉很多能够正常萌发,可以作为有性多倍化育种的材料,用于杂交授粉[1-5]。
流式细胞技术(Flow cytometry)是20世纪80年代兴起的新技术,有快速、简单、通量大的特点,被广泛地用于基础研究。流式细胞仪常被用于鉴定植物的倍性,通过检测植株G0/G1峰的核酸含量可以判断出植物的倍性[6-13]。将流式细胞仪用于百合花粉倍性的检测,可以快速地知道某一品种是否能产生未减数花粉,之后则可以通过一些技术手段对花粉进行分离,筛选出未减数花粉用于杂交授粉。百合花粉一般为椭圆形,长径在100 μm左右,体积微小,花粉壁较厚,将之破碎后释放出足够量的游离细胞核用于流式细胞仪检测较困难。笔者借鉴了同行经验,总结出适合的方法,能够较方便地制备百合花粉细胞核悬浮液,操作简单,重复性好。
1 材料与方法
1.1 试验材料供试材料为2个百合商业品种Marlon、Viviana花粉,以各自叶片为对照。所有材料均种植于贵州省园艺研究所花卉大棚。流式细胞仪为Partec公司生产CyFlow Space,染色液为Partec公司生产的CyStain UV Ploidy DAPI Staining Solution。
1.2 试验方法
1.2.1样品采集。采集叶片,放入冰盒中带回试验室,清洗干净后晾干,备用;在百合花朵完全绽放后,用小塑料袋收集已成熟的花粉,做好标记,并带回试验室,然后将花粉平铺在培养皿中,放在30 ℃培养箱内保存,备用。
1.2.2细胞核的提取和染色。使用WPB(Woody Plant Buffer)和CyStanin UV Precise T两种提取液制备Marlon叶片细胞核悬浮液,比较试验效果。CyStain UV Precise T购自于Partec公司;WPB含浓度1% PVP-10、0.2 mol/L Tris-HCl、2 mmol/L Na2EDTA、4 mmol/L MgCl2、10 mmol/L Sodium metabisulfite、86 mmol/L NaCl、1%(V/V)Triton X-100,pH 7.5[14]。
1.2.3叶片细胞核悬浮液制备方法。在6 cm玻璃培养皿中加入0.5 cm*0.5 cm大小鲜嫩叶片,滴加400 μl细胞核提取液浸没样品,用锋利刀片切碎叶片至糊状加入2 ml染色液染色后,30 μm筛网过滤,上机测定。
1.2.4花粉细胞核悬浮液制备方法。在6 cm玻璃培养皿中加入大量花粉,最好为干燥过的花朵,滴加400 μl的CyStanin UV Precise T细胞核提取液浸没样品,搅拌均匀后静置5~20 min,待成糊状后用锋利刀片反复砍切20 min,加入2 ml染色液染色后,30 μm筛网过滤,上机测定。同时,可斟量添加染色液以保证细胞核浓度。
1.2.5流式细胞仪倍性测定。DAPI染色的双链核酸在365 nm的激光下激发放出蓝色荧光,设置增益电压为268,上样测定。
2 结果与分析
2.1 细胞核提取液对倍性测定的影响利用两种不同的提取液处理Marlon叶片,得到细胞核悬浮液。加入染色液染色后,用流式细胞仪检测。由图1、2可知,在由WPB提取液得到的图像上能够看到G0/G1峰,但并不明显,细胞碎片较多,对G0/G1峰的下部有所掩盖;在用CyStain UV Precise T提取液得到的图像上G0/G1峰清晰,细胞碎片相对较少,试验效果明显优于WPB提取液。
2.2 叶片倍性的测定Marlon、Viviana叶片利用CyStain UV Precise T提取液制备细胞核悬浮液,上机测定,以此作为花粉倍性测定的对照。由图1、3可知,两个百合品种都是二倍体,GO/G1峰在横坐标100左侧,Marlon GO/G1峰的横坐标平均数为84.65,CV值为9.88%,Viviana为80.51,CV值为11.13%。Marlon为OT远缘杂交种,Viviana为O杂交种,都是近几年刚培育出的新品种。
2.3 花粉倍性的测定利用CyStain UV Precise T提取液制备花粉细胞核悬浮液,上机检测。由图4、5可知,除了单倍体峰,在两份花粉中都检测出二倍体峰。百合为二细胞花粉,包含一个大的单倍体营养细胞和一个小的单倍体生殖细胞,在经过花粉破碎、细胞核提取液的裂解以及30 μm筛网过滤之后基本得到的悬浮液都应该是单一的细胞核和较小的细胞碎片,此时出现的二倍体峰应该为2n花粉细胞核所产生的信号,也就是说,这两个品种都可以自发地产生2n配子。据图像,发现Marlon花粉单倍体峰的横坐标平均数为49.52,CV值为7.83%,二倍体峰为92.03,CV值为12.29%;Viviana为单倍体峰为38.90,CV值为8.51%,二倍体峰为72.46,CV值为8.17%。CV值表示取样的异质性,CV值越高则表示取样同质性差。
Marlon花粉二倍体峰底部向横坐标右侧有延伸。这部分可能是杂质信号,也可能是其他倍性的花粉细胞核信号,影响二倍体峰的分析数据,使得平均值大于二倍体叶片的数值,但从主峰的位置上来看与叶片的GO/G1峰是吻合的。
Viviana的二倍体峰平均值则略小于叶片数值。这是由二倍体峰和单倍体峰之间的细胞核信号较多造成的。这些信号可能是由非整倍体花粉造成的。单独取出Viviana的二倍体主峰进行分析,发现平均值为82.89,CV值为24.02%,其数值基本与二倍体叶片相当。
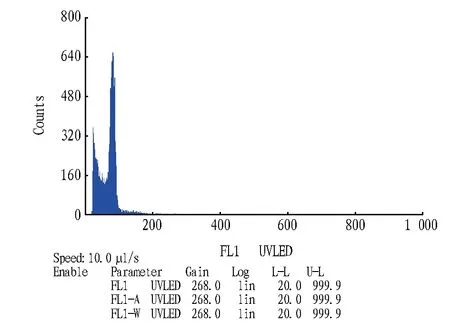
图1 CyStain UV Precise T 处理Marlon叶片
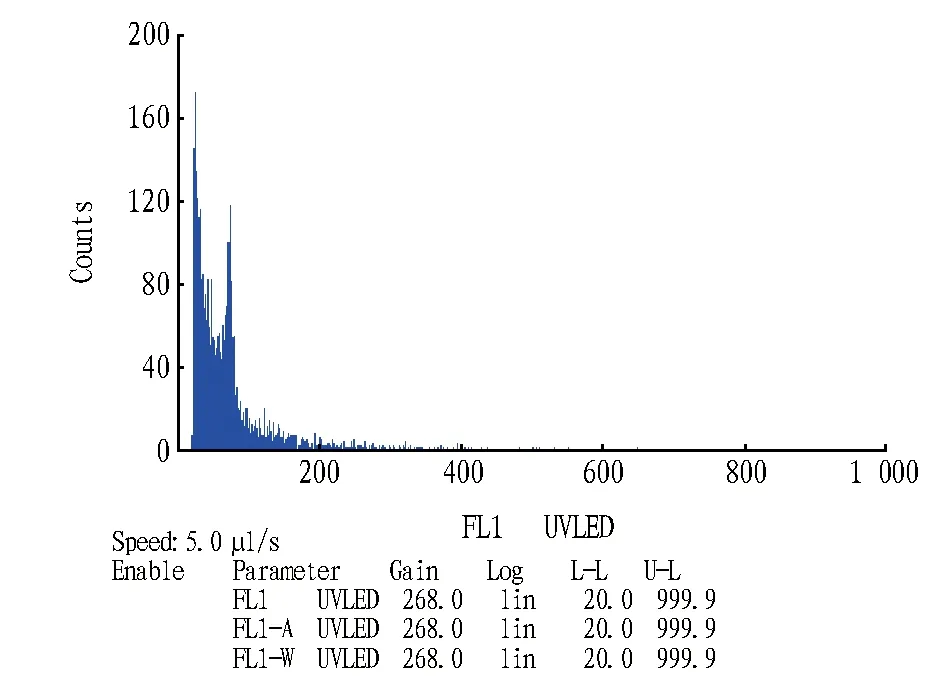
图2 WPB处理Marlon叶片
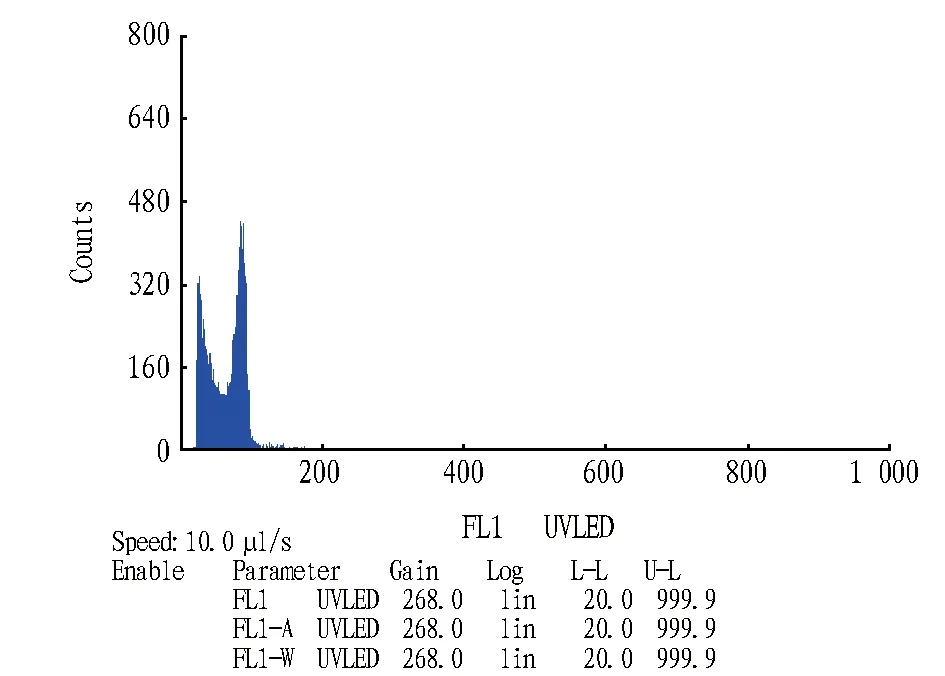
图3 CyStain UV Precise T 处理Viviana叶片
3 讨论
百合花粉较难破碎。如何有效地破碎花粉壁是保证试验结果的关键问题。在试验初期阶段,笔者尝试了液氮、砂纸、离心等手段,但效果都不好,最后还是采用刀片砍切的办法,操作简单,但是比较费力,需连续20 min才能保证较好的破碎量,花粉需求量也较大。
对于叶片杂质问题,在制备叶片细胞核悬浮液的过程中,需要将叶片破碎至糊状,才能保证悬浮液有合适的细胞核浓度,造成悬浮液中细胞碎片较多。研究表明,在GO/G1峰左侧能够看到大量明显的杂质信号。这些杂质信号在进行分析时会影响数据的准确性,需要对其进行遮挡。
对于流速与密度问题,在试验中发现流式细胞仪的检测能力是有限的,在每秒通过信号数超过一定值的情况下,检测到的信号会被削弱。比如,在相同上样流速的情况下,信号密度为30个/s,峰所在的位置横坐标值为85,如果信号密度达到350个/s,那么峰所在的位置横坐标值会降低到55。考虑到这种情况,笔者对样品浓度和上样流速都提出要求。如果样品浓度过高,则很可能影响结果的准确性,同理在高流速下,单位时间经过的样品数量过高,就等同于提高检测样品的浓度,必然也会影响荧光信号的数值。这个问题根源还是由于流式细胞仪的检测能力有限。
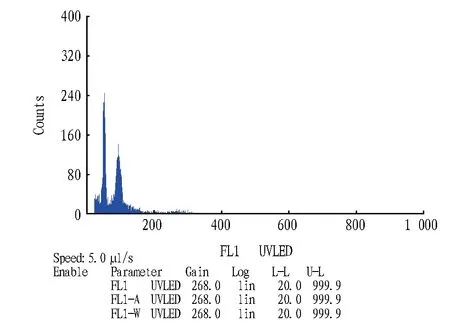
图4 Marlon花粉图像
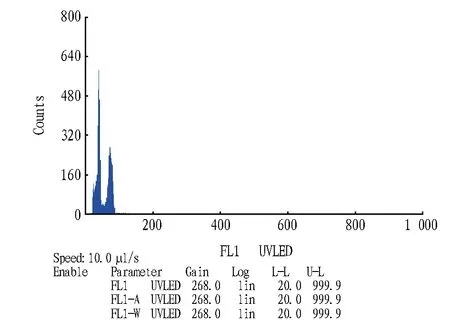
图5 Viviana花粉图像
[1] 李克虎,周桂雪,任贵玲.百合品种染色体倍性观察[J].园艺学报,2011(5):970-976.
[2] 周桂雪,李克虎,张线线.亚洲百合品种倍性、花粉育性及其杂交研究[J].园艺学报,2011(4):733-739.
[3] 徐顺超,管洁,曹荷艳.百合杂交育种亲和性与染色体倍性相关性研究[J].分子植物育种,2014(2):316-322.
[4] 周桂雪.亚洲百合品种倍性调查与倍性间杂交分析[D].杭州:浙江大学,2011.
[5] 向仕华,郑思乡,赵雁.不同倍性东方百合杂交后代染色体数目观察[J].云南农业大学学报,2007(5):631-634.
[6] 李靖,李成斌,顿文涛.流式细胞术(FCM)在生物学研究中的应用[J].中国农学通报,2008(6):107-111.
[7] 耿波,孙效文.流式细胞术在水生生物DNA含量和倍性分析中的应用[J].水产学杂志,2008(2):21-24.
[8] 柳青慕,王赟文,王小山.流式细胞仪快速检测鸭茅与多花黑麦草染色体倍性的研究[J].草业科学,2012(3):403-410.
[9] 施春晖,徐兰兰,王晓庆.流式细胞仪鉴定猕猴桃倍性技术研究[J].植物研究,2014(6):845-849.
[10] 杜凤.芒属植物的染色体倍性及核型研究[D].长沙:湖南农业大学,2009.
[11] 黄少玲.春石斛兰品种的倍性鉴定及RAPD分子遗传图谱的构建[D].武汉:华中农业大学,2007.
[12] 王丽花,杨秀梅,吴学尉.非洲菊大孢子再生植株倍性的快速鉴定方法[J].西北农业学报,2013(1):155-161.
[13] 于红梅,王静,赵密珍,等. 利用流式细胞仪检测草莓倍性方法的优化[J]. 南方农业学报,2012,43(10):1530-1533.
[14] LOUREIRO J,RODRIGUEZ E,DOLEZEL J,et al.Two new nuclear isolation buffers for plant DNA flow cytometry:A test with 37 species[J].Ann Bot,2007,100(4):875-888.
Study on Determination of Lilium Pollen Ploidy by Flow Cytometry
WU Qing-qing1, HU Xiao-jing2, HUANG Wei1*et al
(1.Horticulture Research Institute of Guizhou, Guiyang, Guizhou 550006; 2. College of Horticulture,Guizhou University, Guiyang, Guizhou 550006)
[Objective]For the use of lihium unreduced pollen to sexual polyploidization breeding.[Method] We made use of flow cytometry to determine lilium pollen ploidy by taking the pollen of Marlon and Viviana as materials and leaves for comparison. [Result] By comparing the effect difference of two different cell nuclear extracts, the extract of CyStain UV Precise T was significantly better than that of WPB. Marlon and Viviana leaves measurement results showed that they were diploids and the pollen measurement image showed the two varieties could produce 2npollen on their own. [Conclusion] Flow cytometry can be used to quickly measure lilium pollen ploidy.
Flow cytometry; Lily; Pollen; Ploidy
国家自然科学
(31160176);贵州省科技厅项目(黔科合J字[2010]2090号;黔科合NY字[2011]3074号;黔科合成转字[2014]5027号;黔科合NY字[2015]3012-1号);贵州省农科院院专项(黔农科院院专项[2008]032号)。
吴青青(1982- ),男,山东平度人,助理研究员,硕士,从事百合育种与种球繁育方面的研究。*通讯作者,助理研究员,硕士,从事植物遗传育种方面的研究。
2015-08-22
S 603
A
0517-6611(2015)28-004-03
