孕期炎症暴露致子代大鼠肾脏组织中甲基化转移酶表达异常的研究
2015-01-06崔竞红邓有才魏艳玲李晓辉
崔竞红,王 婧,廖 茜,邓有才,魏艳玲,李晓辉,易 萍△
(1.第三军医大学大坪医院野战外科研究所妇产科,重庆 400042;2.第三军医大学药学院药剂学教研室,重庆 400038)
·论 著·
孕期炎症暴露致子代大鼠肾脏组织中甲基化转移酶表达异常的研究
崔竞红1,王 婧1,廖 茜1,邓有才2,魏艳玲2,李晓辉2,易 萍1△
(1.第三军医大学大坪医院野战外科研究所妇产科,重庆 400042;2.第三军医大学药学院药剂学教研室,重庆 400038)
目的 探讨肾脏DNA甲基转移酶(DNMTs)在孕期脂多糖(LPS)刺激仔鼠高血压发生的作用。方法将孕鼠分为4组,分别为对照组(孕期的8~14 d注射生理盐水)、LPS组(孕期第8、10、12天注射LPS,在9、11、13、14天注射生理盐水)、核转录因子κB(NF-κB)抑制剂PDTC组(孕期的8~14 d每天注射PDTC)、LPS+PDTC组(LPS在孕期第8、10、12天注射,PDTC注射时间及剂量同PDTC组)。用尾动脉无创血压测定仪测仔鼠血压,电子天平称体质量,RT-PCR检测仔鼠肾皮质白细胞介素-6(IL-6)、Fli-1及DNMTs的表达水平。结果LPS组仔鼠血压明显高于对照组(P<0.05),体质量较对照组高,肾皮质IL-6、Fli-1、DNMT1、DNMT3b表达较对照组升高(P<0.05)。而LPS+PDTC组仔鼠体质量、血压及IL-6、Fli-1、DNMT1、DNMT3b表达均较LPS组降低。结论孕期LPS刺激会引起仔鼠肾皮质DNA甲基酶变化,提示一些关键基因的甲基化可能是孕期LPS刺激引起子代高血压的原因之一。
炎症;脂多糖类;高血压;甲基化
高血压的患病率持续升高,是引起心脑血管疾病最主要危险因素之一。高血压主要由遗传因素和环境因素相互作用引起,但其发病机制尚不清楚。本课题组已经证明脂多糖(LPS)在孕期进行刺激,引起仔鼠血压增高及炎性反应性增高[1-3]。研究发现大鼠孕期LPS刺激后仔鼠体内细胞因子会发生变化[4],炎症因子可引起DNA 甲基转移酶(DNA cytosine-5-methyltransferases,DNMT)表达及活性的变化。孕期不良刺激可能改变子代疾病关键基因表观遗传修饰模式,使基因产生印迹效应致其表达发生了终生改变,诱发成年心血管和代谢性疾病的发生[5]。基于前期实验结合最新研究进展,作者提出假设:孕期炎症刺激可能升高子代炎症因子表达水平,影响DNA甲基转移酶水平改变,引起目的DNA表观遗传修饰模式改变,造成了关键基因时空特异性表达异常,从而导致慢性成年高血压的发生。本实验在已建立的动物模型基础上,进一步检测仔鼠肾皮质白细胞介素-6(IL-6)、Fli-1、DNMTs水平,探讨DNA甲基化否参与DNA表观遗传修饰模式改变以及可能参与的高血压的发生机制。
1 材料与方法
1.1 实验动物分组 将实验大鼠分为4组,每组6只:对照组(孕期的8~14 d注射生理盐水)、LPS组(孕期第8、10、12天注射LPS,在9、11、13、14天注射生理盐水)、PDTC组(孕期的8~14 d每天注射PDTC)、LPS+PDTC组(LPS在孕期第8、10、12天注射,PDTC注射时间及剂量同PDTC组)。
1.2 仪器与试剂 实验选用SD孕鼠,体质量250~320 g,由第三军医大学大坪医院野战外科研究所实验动物中心提供,LPS购自美国Sigma公司,大鼠尾动脉无创血压测量仪购自成都仪器厂。
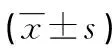
表1 各组子代大鼠体质量及血压的变化
*:P<0.05,**:P<0.01,与对照组比较;△:P<0.05,△△:P<0.01,与LPS组比较。
1.3 仔鼠体质量测定 仔鼠出生后即用电子天平仔细称取质量,每只称3次,取平均值,以后从6~12周龄,每2周称取1次体质量。
1.4 鼠尾无创血压测定 仔鼠每2周测量1次血压。在25 ℃室温下进行血压测量,先在40 ℃将大鼠预热10 min,将仔鼠放入固定器中,待仔鼠安静后用尾动脉无创血压测量仪检测仔鼠尾动脉收缩压,每只仔鼠测3次血压,取平均值,每2次测压间隔3 min。
1.5 肾皮质IL-6、Fli-1、DNMT1、DNMT3的mRNA水平 用Real-time PCR方法检测仔鼠肾皮质IL-6、Fli-1、DNMT1、DNMT3a、DNMT3b的mRNA水平。分别取6、12周龄仔鼠皮质提取总RNA(Tiangen Biotech,北京),检测总RNA浓度。取1 μg总RNA用PrimeScript RT reagent Kit with gDNA Eraser (TaKaRa 公司,大连)反转录获得cDNA。用Premier 5.0软件(Premier Biosoft International,Palo Alto,CA,USA)设计引物。大鼠IL-6引物序列(正义链5′-CTT CCA GCC AGT TGC CTT CTT G-3′;反义链5′-GTC TGT TGT GGG TGG TAT CCT C-3′),Fli-1引物序列(正义链5′-TAT GGC TTG ATG GAG ATT GAC ACT-3′;反义链5′-CCT GAG GTA ACT GAG GTG CGA C-3′),DNMT1序列(正义链5′-CGT CAT AAC CAA TAA ACT TCG CT-3′;反义链5′-TTG TCT GGA AGC AGG GTC G-3′),DNMT2引物序列(正义链5′-CAC ACT TAC TGG CAA AGA CAA TCG-3′;反义链5′-TGG CTG ACA TGG AGG GCT C-3′),DNMT3A引物序列(正义链5′-TGT GAA TGA TAA GCT GGA GTT GC-3′,反义链5′-GGT GGT AAT GGT CCT CAC TTT G-3′),DNMT3B引物序列(正义链5′-GTG CGT CGT TCA GGC AGT AG-3′,反义链5′-AAG CGG CAA AGT CAA TGG TT-3′)。Real_timePCR采用25 μL体系用SYBR Premix Ex TaqⅡ (Tli RNaseH Plus) (TaKaRa Biotechnology,大连)。进行荧光定量聚合酶链反应,反应条件:95 ℃ 30 s,95 ℃ 15 s、60 ℃ 15 s循环40次,最后72 ℃ 20 s。
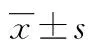
2 结 果
2.1 LPS促进仔鼠体质量及血压增长 在仔鼠周龄6~12周时,每2周检测1次体质量,子代大鼠LPS组体质量高于对照组,在12周龄时LPS组明显高于对照组(P<0.01),且LPS+PDTC组与对照组差异无统计学意义(P>0.05);孕期LPS刺激的仔鼠血压升高,LPS组的子代大鼠血压明显高于对照组和PDTC组(P<0.05),而LPS+PDTC组与对照组差异无统计学意义(P>0.05),见表1。
2.2 LPS组子代大鼠肾脏皮质中IL-6、Fli-1、DNMTs 的mRNA水平表达增加 LPS组的大鼠肾脏皮质组织中IL-6、Fli-1、DNMT1、DNMT3b的mRNA的表达水平在第6、12周明显高于对照组(P<0.05),并且PDTC组和LPS+PDTC组的IL-6、Fli-1、DNMT1、DNMT3b的mRNA水平明显低于LPS组(P<0.05)。DNMT3a各组之间差异无统计学意义。
3 讨 论
高血压是心脑血管疾病最主要危险因素之一,严重威胁人类健康[6]。母体孕期不良刺激会引发子代慢性疾病[7]。Barker发现出生体质量偏小伴大胎盘的新生儿,成年后糖尿病、高血压、心脑血管疾病发病率比普通人群明显增高[8],提出 “胎儿起源的成年疾病(fetal origin of adult diseases)”理论。
本课题组用LPS为炎症刺激剂对孕期大鼠进行刺激,成功地观察到子代大鼠血压升高[1],并发现LPS组仔鼠肾素及血管紧张素酶的表达与对照组差异显著,核转录因子κB(NF-κB)抑制剂PDTC逆转LPS对肾素mRNA的影响并阻止仔鼠发生高血压[3]。既往研究发现低蛋白饮食可导致仔鼠发生高血压[9-10],仔鼠肾上腺组织中AT1b 基因低甲基化及其蛋白水平表达增加[11],提示宫内不良环境可通过甲基化方式导致基因表观遗传学改变,影响其表达。孕期低蛋白饮食的仔鼠出生后用血管紧张素Ⅱ阻断剂和过氧化物抑制剂可阻止其发生高血压[12],中枢性使用血管紧张素Ⅱ阻断剂也可阻止发生高血压[13],提示宫内不良环境可通过甲基化致AT1b基因表观遗传学改变,影响其表达水平[11],并提示产后生活环境可改变宫内环境对子代的印迹效应。因此,孕期不良刺激可能通过改变子代疾病关键基因表观遗传修饰模式使这些基因产生印迹效应,致其表达发生了终生改变,诱发成年心血管和代谢性疾病。
Urakubo发现大鼠孕期用LPS刺激后,在胎盘、羊水及子代大鼠大脑中的一些细胞因子(如IL-6、 肿瘤坏死因子-α)发生变化[4]。炎症因子可引起DNA 甲基转移酶表达及活性的变化。IL-6使结肠癌细胞DNMT1表达增加,升高一些抑癌基因甲基化程度降低这些基因表达[14]。IL-6还可改变DNMT1的细胞亚定位,促进其转位入核[15]。研究发现,IL-6通过转录因子Fli-1通路增加DNMT1表达下调,导致赖氨酰氧化酶(lysyloxidase,LOX)表达水平下降[16]。肿瘤坏死因子-α刺激DNMT3致组蛋白甲基化沉默Notch-1基因抑制骨骼肌细胞再生潜力[17]。DNMT的活性对胚胎的正常发育起重要作用[18]。为了探讨孕期炎症刺激引起子代高血压是否与甲基化有关,本研究用LPS刺激孕鼠,检测仔鼠体质量、血压,用RT-PCR 方法检测仔鼠肾皮质IL-6、Fli-1、DNMTs水平。
仔鼠LPS组较对照组血压显著升高,PDTC可以阻止LPS引起高血压的发生。LPS组仔鼠体质量显著高于对照组。肾皮质IL-6、Fli-1、DNMT1、DNMT3b的mRNA表达在LPS组较对照组显著增高。DNMT1、DNMT3b的主要作用分别是维持细胞的甲基化和从头合成甲基化,LPS组的DNMT1、DNMT3b在6周时即显著升高,说明LPS刺激使子代大鼠某个关键基因甲基化水平增高并维持高水平,抑制这种基因的表达并维持低表达水平,从而引起并维持子代高血压。另外,LPS+PDTC组中子代大鼠的IL-6、Fli-1、DNMT1、DNMT3b的mRNA的表达水平较LPS组子代大鼠明显降低,说明PDTC可以逆转孕期炎症刺激引起的高甲基化现象,阻止了子代大鼠高血压的发生。因此,作者认为孕期LPS刺激可能通过免疫刺激增加IL-6/Fli-1的表达,上调DNMT1、DNMT3b,从而上调表观遗传甲基化,使某些基因表达降低,从而引起仔鼠高血压的发生。
综上所述,孕期暴露于LPS诱导的炎症导致仔鼠体内IL-6增加,从而上调Fli-1,引起DNMT1、DNMT3b表达升高,导致某关键基因甲基化水平增高,从而抑制了此关键基因的表达,致仔鼠发生高血压。因此,作者认为仔鼠高血压的发生可能与IL-6/Fli-1通路有关。下一步可以通过引入Fli-1抑制剂,观察仔鼠肾皮质甲基化转移酶的表达及仔鼠血压水平,寻找肾皮质中甲基化转移酶作用的基因,进一步研究其致仔鼠发生高血压的作用机制。
[1]Wei YL,Li XH,Zhou JZ.Prenatal exposure to lipopolysaccharide results in increases in blood pressure and body weight in rats[J].Acta Pharmacol Sin,2007,28(5):651-656.
[2]Hao XQ,Zhang HG,Li SH,et al.Prenatal exposure to inflammation induced by zymosan results in activation of intrarenal renin-angiotensin system in adult off spring rats[J].Inflammation,2010,33(6):408-414.
[3]Hao XQ,Zhang HG,Yuan ZB,et al.Prenatal exposure to lipopolysaccharide alters the intrarenal renin-angiotensin system and renal damage in offspring rats[J].Hypertens Res,2010,33(1):76-82.
[4]Urakubo A,Jarskog LF,Lieberman JA,et al.Prenatal exposure to maternal infection alters cytokine expression in the placenta,amniotic fluid,and fetal brain[J].Schizophr Res,2001,47(1):27-36.
[5]McMillen IC,Robinson JS.Developmental origins of the metabolic syndrome:prediction,plasticity,and programming[J].Physiol Rev,2005,85(2):571-633.
[6]Hao XQ,Du JX,Li Y,et al.Prenatal exposure to lipopolysaccharide combined with pre-and postnatal high-fat diet result in lowered blood pressure and insulin resistance in offspring rats[J].PLoS One,2014,9(2):e88127.
[7]Barker DJ.The fetal and infant origins of adult disease[J].BMJ,1990,301(6761):1111.
[8]Barker DJ,Bull AR,Osmond C,et al.Fetal and placental size and risk of hypertension in adult life[J].BMJ,1990,301(6746):259-262.
[9]Woodall SM,Johnston BM,Breier BH,et al.Chronic maternal undernutrition in the rat leads to delayed postnatal growth and elevated blood pressure of offspring[J].Pediatr Res,1996,40(3):438-443.
[10]Vickers MH,Breier BH,Cutfield WS,et al.Fetal origins of hyperphagia,obesity,and hypertension and postnatal amplification by hypercaloric nutrition[J].Am J Physiol Endocrinol Metab,2000,279(1):E83-87.
[11]Bogdarina I,Welham S,King PJ,et al.Epigenetic modification of the renin-angiotensin system in the fetal programming of hypertension[J].Circ Res,2007,100(4):520-526.
[12]Vehaskari VM,Woods LL.Prenatal programming of hypertension:lessons from experimental models[J].J Am Soc Nephrol,2005,16(9):2545-2556.
[13]Pladys P,Lahaie I,Cambonie G,et al.Role of brain and peripheral angiotensin Ⅱ in hypertension and altered arterial baroreflex programmed during fetal life in rat[J].Pediatr Res,2004,55(6):1042-1049.
[14]Foran E,Garrity-Park MM,Mureau C,et al.Upregulation of DNA methyltransferase-mediated gene silencing,anchorage-independent growth,and migration of colon cancer cells by interleukin-6[J].Mol Cancer Res,2010,8(4):471-481.
[15]Hodge DR,Cho E,Copeland TD,et al.IL-6 enhances the nuclear translocation of DNA cytosine-5-methyltransferase 1 (DNMT1) via phosphorylation of the nuclear localization sequence by the AKT kinase[J].Cancer Genomics Proteomics,2007,4(6):387-398.
[16]Thaler R,Agsten M,Spitzer S,et al.Homocysteine suppresses the expression of the collagen cross-linker lysyl oxidase involving IL-6,Fli1,and epigenetic DNA methylation[J].J Biol Chem,2011,286(7):5578-5588.
[17]Acharyya S,Sharma SM,Cheng AS,et al.TNF inhibits Notch-1 in skeletal muscle cells by Ezh2 and DNA methylation mediated repression:implications in duchenne muscular dystrophy[J].PLoS One,2010,5(8):e12479.
[18]Chung YG,Ratnam S,Chaillet JR,et al.Abnormal regulation of DNA methyltransferase expression in cloned mouse embryos[J].Biol Reprod,2003,69(1):146-153.
Study on gestational inflammation exposure causing methyltransferase abnormal expression in offspring rat renal tissue*
CuiJinghong1,WangJing1,LiaoXi1,DengYoucai2,WeiYanling2,LiXiaohui2,YiPing1△
(1.DepartmentofGynecologyandObstetrics,ResearchInstituteofFieldSurgery,DapingHospital,ThirdMilitaryMedicalUniversity,Chongqing400042,China;2.TeachingandResearchSectionofPharmaceutics,CollegeofPharmacy,ThirdMilitaryMedicalUniversity,Chongqing400038,China)
Objective To investigate the role of renal DNA methyltransferases (DNMTs) stimulated by lipopolysaccharide(LPS) during gestational period in the hypertension occurrence in offspring rat.Methods Pregnant rats were randomly divided into four group (n=8 each):control group (injection of normal saline on 8-14 d of gestation);LPS group (injection of LPS on 8,10,12 d of pregnancy and injection of normal saline on 9,11,13,14 d),NF-κB inhibitor PDTC group (injection of PDTC on 8 -14 d of gestation),LPS+PDTC group (injection of LPS on 8,10,12 d of gestation,PDTC dose and injection time same to PDTC group).The tail noninvasive blood pressure determinator was adopted to detect the offspring blood pressure.The body weight was weighed by the electronic balance.The expression levels of IL-6,Fli-1and DNMTs in offspring renal cortex were detected by RT-PCR.Results The blood pressure in the LPS group was significantly higher than that in the control group and the body weight was higher than that in the control group(P<0.05).The expression levels of IL-6,Fli-1,DNMT1 and DNMT3b in the renal cortex were increased compared with the control group(P<0.05).But the body weight,blood pressure and expression levels of IL-6,Fli-1,DNMT1 and DNMT3b in the LPS+PDTC group were decreased compared with the LPS group.Conclusion The LPS stimulation during gestational period could resulted in the change of intrarenal DNMTs in offspring rats,prompting that the methylation of some key genes could be one of the reasons for LPS stimulation during gestational period causing hypertension in offspring.
inflammation;lipopolysaccharide;hypertension;methylation
:10.3969/j.issn.1671-8348.2015.13.002
国家自然科学基金资助项目(81170580)。
崔竞红(1989-),硕士研究生,主要从事产前诊断方面研究。
△通讯作者,E-mail:yp_yiping@foxmail.com。
R544.1
A
1671-8348(2015)13-1732-03
2014-10-08
2015-02-16)
