杨梅全基因组测序结果初报
2015-01-06戚行江任海英梁森苗郑锡良吴阳春
戚行江,任海英,梁森苗,郑锡良,吴阳春
(浙江省农业科学院园艺研究所,浙江杭州 310021)
杨梅全基因组测序结果初报
戚行江,任海英,梁森苗,郑锡良,吴阳春
(浙江省农业科学院园艺研究所,浙江杭州 310021)
杨梅(Myrica rubra Sieb.et Zucc.)是我国南方著名的特产珍果,为促进杨梅分子育种及功能基因研究,对杨梅进行了全基因组测序。采用Illum ina Hiseq 2500双端测序策略,构建了200 bp文库,进行双端125 bp(PE 125)测序,得到约13.70 Gb的原始数据。数据评估得知杨梅基因组大小约为304.38 Mb,重复序列含量约为45.82%,杂合率约为0.58%,基因组的GC含量约37.99%。利用SOAPdenovo软件进行了拼接组装。这一结果有助于开展杨梅后续的分子育种及基因功能研究。
杨梅;全基因组测序;基因组特征评估
杨梅(Myrica rubra Sieb.et Zucc.)是我国南方著名的特产珍果,果实色泽鲜艳,酸甜适口,风味独特,营养丰富,深受人们喜爱。浙江省杨梅种植历史悠久,是世界上最早对杨梅进行人工栽培的地区。2015年浙江省杨梅实际栽培面积近8.67万hm2,产量近50万t,栽培面积和产量均居全国第一,是浙江省仅次于柑橘的第二大果树。目前,浙江省已成为中国乃至世界杨梅产业中心,杨梅产业在浙江省特色农业生产中有着特殊的地位和作用,现已成为浙江省“三农”经济发展以及农民脱贫致富的重要产业。
杨梅产业在浙江省还在不断发展之中,但随着面积的不断发展与产量的持续上升,杨梅生产问题也在日益突现,在品种方面表现尤为明显,四大良种东魁、荸荠种、丁岙杨梅、晚稻杨梅等,这些品种的育成均采用系统优选获得,虽然性状上存在差异,但类型仍然较为相似,不同品种的熟期间隔不大,且均存在树形高大、始果期迟、果实不耐贮藏、抗病性不足等问题。为了培育更优良的品种,更新杨梅育种技术与育种手段成为产业的迫切需求,杨梅的雌雄种质及不同品种在分子标记上存在重要差异[1-2],这为分子育种提供了重要信息,但是尚不能满足更深入的产业需求。
随着科学技术的快速发展,转录组测序、基因组全测序已经成为研究动物[3-4]、植物[5-6]、病原生物[7]等的重要技术手段,这大大加速了人类对于研究目标的认知速度,有利于更好更快的利用分子技术改良物种。目前已经对十几种果树进行了全基因组测序,这大大促进了果树科学的发展[8]。为了更好地从分子水平深入了解杨梅的生长性能、品质和抗病性等种质特性,促进杨梅分子育种及功能基因研究,本文对杨梅进行了全基因组测序。
1 材料与方法
1.1 文库的构建及测序
杨梅嫩叶送北京百迈客生物科技有限公司进行检测。CTAB方法提取杨梅嫩叶基因组DNA,进行小片段文库建库测序。用Qubit dsDNA HS Assay Kit(Life technologies)对基因组DNA进行精确定量。
小文库构建。取500 ng基因组DNA用1×TE稀释至50μL,用超声法进行机械打断,用QIAquick PCR purification Kit(QIAGEN)对片段化DNA进行纯化;在T4 polynucleotide kinase、T4 DNA polymerase、Klenow Large Fragment和dNTP(New England Biolabs,NEB)的反应体系催化下对片段化的DNA进行修复,形成5'端带有磷酸基团的平末端序列,并用QIAquick PCR purification Kit(QIAGEN)进行纯化;在Klenow Fragment(exo-)(NEB)的催化下,在上述DNA的3'端添加连接反应所需的A碱基,并用M inElute PCR purification Kit(QIAGEN)进行纯化;将不含barcode的Illumina paired-end adapters连接到待测DNA片段两端,并用MinElute PCR purification Kit(QIAGEN)进行纯化;用2%的低分子量琼脂糖(BioRad)凝胶电泳对纯化连接产物进行分离,切胶选择300 bp(插入片段200 bp),用QIAquick Gel Extraction Kit(QIAGEN)对分离胶块进行纯化;用带有可以区分文库的index引物对胶回收片段进行扩增富集,并对PCR产物再次进行琼脂糖凝胶电泳切胶纯化,最终获得可用于测序的文库。用7500 DNA LabChip芯片在Agilent Technologies 2100生物分析仪上对所得文库片段大小进行质检,用qPCR定量方式对文库进行精确定量。根据qPCR定量结果对不同文库进行混样,在Illumina HiSeq 2500测序仪上按照双端125 bp进行测序。
1.2 信息分析流程
双端测序数据通过评估(GC分布统计、质量值Q20、Q30评估)、过滤后得到高质量的数据(clean reads),用于基因组特征评估。
1.3 基因组特征评估
利用基因组调研图进行基因组特征的评估,评估基因组大小、杂合情况及GC含量情况。
2 结果与分析
2.1 测序结果统计
使用杨梅样品的基因组DNA构建200 bp的文库,在Illumina Hiseq 2500测序平台测序得到13.70 Gb原始数据,总测序深度约为45.01X,测序质量值在20以上的碱基比例在93.25%以上,测序质量值在30以上的碱基比例在88.32%以上。
2.2 基因组大小、重复序列比例和杂合率评估
利用200 bp文库数据构建Kmer长度为17的Kmer分布图(图1),进行基因组大小、重复序列比率和杂合率的评估。由图1可知,平均Kmer深度即主峰对应的Kmer深度为37.56X。Kmer深度出现在主峰对应深度2倍以上的序列为重复序列,即深度大于75.12X(主峰右侧的小峰)的Kmer序列为重复序列。Kmer深度出现在主峰对应深度18.78X处(主峰左侧的小峰)的序列即为杂合序列。
根据Kmer深度信息,总Kmer数目/平均Kmer深度即为基因组大小,估计基因组大小约304.38 Mb。依据Kmer分布情况,估计重复序列含量约45.82%,没有明显杂合峰,评估出的杂合率约为0.58%,物种杂合率较低。因此该物种不属于高杂合、高重复、大基因组等基因组结构特征复杂的物种。
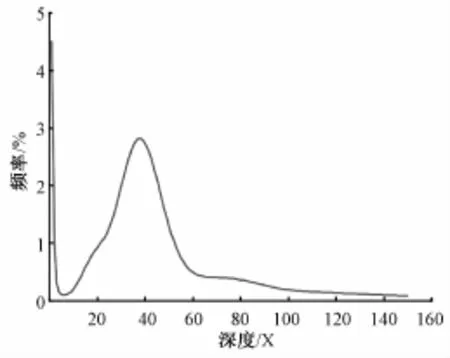
图1 Kmer的分布
2.3 评估GC含量
基因组GC含量对基因组测序的随机性有较大影响。过高GC含量(>65%),过低GC含量(<25%)会导致测序偏向性,严重影响基因组组装效果。物种GC含量是评估后续基因组组装难度重要指标之一。通过对调研图文库测序数据分析,该物种基因组的GC含量约37.99%。
3 讨论
杨梅全基因组大小约304.38 Mb,与其他已完成全基因组测序的果树相比,比苹果(基因组大小742 Mb)[9]、梨(基因组大小527 Mb)[10]、猕猴桃(基因组大小616.1 Mb)[5]、香蕉(基因组大小523 Mb)[11]、葡萄(基因组大小490 Mb)[12]、杨树(基因组大小480 Mb)都小的多,但是与番木瓜(基因组大小370 Mb)[13]、桃树(基因组大小265 Mb)[14]、甜橙(基因组大小367 Mb)[15]较接近。与其他已完成全基因组测序的作物和蔬菜相比,比大麦(全基因组大小5.1 Gb)、小麦(全基因组大小17 Gb)、大豆(全基因组大小1.1 Gb)、玉米(全基因组大小2.3 Gb)、马铃薯(全基因组大小844 Mb)、棉花(全基因组大小775 Mb)、高粱(全基因组大小730 Mb)、水稻(全基因组大小466 Mb)、番茄(全基因组大小760 Mb)、白菜(全基因组大小485 Mb)和西瓜(全基因组大小425 Mb)等小很多,与甜瓜(全基因组大小375 Mb)和黄瓜(全基因组大小350 Mb)等接近,但是比拟南芥(全基因组大小125 Mb)要大得多。
杨梅的基因重复序列(重复序列45.82%)与葡萄(重复序列41%)、番木瓜(重复序列43%)和香蕉(重复序列44%)相近,在41%~46%,比苹果(重复序列67%)和梨(重复序列53.1%)低,比草莓(重复序列23%)、甜橙(重复序列20%)和桃(重复序列37.14%)要高[8],这说明杨梅的基因组属于中等复杂程度。
如何破解并利用全基因组测序得到的大量数据是研究者面临的巨大挑战。目前基于全基因组测序挖掘了很多与糖、挥发性物质等相关的基因,并在开发SNP芯片、构建高精度图谱及QTL定位等方面都取得了重要进展[8]。以后的科学研究重点将从表现型依赖型研究转入基因型依赖型研究,从对单一基因的研究转入对整个基因组的研究[8]。本文研究成果对于揭示杨梅生长特性的遗传基础提供重要的科学价值。
[1] 谢小波,求盈盈,戚行江,等.杨梅雌、雄种质遗传关系的RAPD和ISSR分析[J].果树学报,2008,25(2):198-202.
[2] 谢小波,求盈盈,戚行江,等.浙江杨梅品种遗传差异的RAPD和ISSR分析[J].浙江农业学报,2008,20(1):1-5.
[3] Zhou X M,Wang B S,Pan Q,et al.Whole-genome sequencing of the snub-nosed monkey provides insights into folivory and evolutionary history[J].Nature Genetics,2014,46(12):1303-1310.
[4] Lu L Z,Chen Y,Wang Z,et al.The goose genome sequence leads to insights into the evolution of waterfow l and susceptibility to fatty liver[J].Genome Biology,2015,16:89.
[5] Huang S X,Ding J,Deng D J,et al.Draft genome of the kiwifruit Actinidia chinensis[J].Nature Communications,2013(4):2640-3640.
[6] Zhang T Z,Hu Y,Jiang W K,et al.Sequencing of allotetraploid cotton(Gossypium hirsu tum L.acc.TM-1)provides a resource for fiber improvement[J].Nature Biotechnology,2015,33(5):531-540.
[7] Wu J,Kou Y J,Bao J D,et al.Comparative genomics identifies the Magnaporthe oryzae avirulence effector AvrPi9 that triggers Pi9-med iated blast resistance in rice[J].New Phytologist,2015,206(4):1463–1475.
[8] 乔鑫,李梦,殷豪,等.果树全基因组测序研究进展[J].园艺学报,2014,41(1):165-177.
[9] Velasco R,Zharkikh A,A ffourtit J,et al.The genome of the domesticated apple(Ma lus×domestica Borkh.)[J].Nature Genetics,2010,42(10):833-839.
[10] W u J,Wang Z,Shi Z,et al.The genome of the pear(Pyrus bretschneideri Rehd.)[J].Genome Research,2012,23:396-408.
[11] D′Hont A,Denoeud F,Aury JM,et al.The banana(Musa acuminata)genome and the evolution of monocotyledonous plants[J].Nature,2012,488:213-217.
[12] Jaillon O,Aury J M,Noel B,et al.The grapevine genome sequence suggests ancestral hexaploidization in major angiosperm phyla[J].Nature,2007,449:463-467.
[13] M ing R,Hou S,Feng Y,et al.The draft genome of the transgenic tropical fruit tree papaya(Carica papaya Linnaeus)[J].Nature,2008,452:991-996.
[14] International Peach Genome Initiative,Verde I,Abbott A G,et al.The high-quality draft genome of peach(Prunus persica)identifies unique patterns of genetic diversity,domestication and genome evolution[J].Natu re Genetics,2013,45(5):487-494.
[15] Xu Q,Chen L L,Ruan X,et al.The draft genome of sweet orange(Citrus sinensis)[J].Natu re Genetics,2012,45:59.
(责任编辑:张 韵)
S 667.6
:A
:0528-9017(2015)10-1564-03
文献著录格式:戚行江,任海英,梁森苗,等.杨梅全基因组测序结果初报[J].浙江农业科学,2015,56(10):1564-1566.
10.16178/j.issn.0528-9017.20151011
2015-08-24
国家公益性行业(农业)科研专项经费(201203089);浙江省果品农业新品种选育重大科技专项(2012C12904-3);浙江省农业科学院杨梅工程中心基金
戚行江(1963-),浙江诸暨人,研究员,硕士生导师,研究方向为果树学。E-mail:qixj@mail.zaas.ac.cn。
