适于转录组测序的枣不同器官总RNA提取方法筛选
2015-01-05魏琦琦冯延芝贾宝光
魏琦琦,冯延芝 ,林 青,贾宝光 ,张 琳
(1.中南林业科技大学a.经济林育种与栽培国家林业局重点实验室;b.经济林培育与保护省部共建教育部重点实验室;c.经济林培育与利用湖南省2011协同创新中心,湖南 长沙 410004;2.中国林业科学研究院 经济林研究开发中心,河南 郑州 450003)
适于转录组测序的枣不同器官总RNA提取方法筛选
魏琦琦1a-c,冯延芝2,林 青1a-c,贾宝光1a-c,张 琳1a-c
(1.中南林业科技大学a.经济林育种与栽培国家林业局重点实验室;b.经济林培育与保护省部共建教育部重点实验室;c.经济林培育与利用湖南省2011协同创新中心,湖南 长沙 410004;2.中国林业科学研究院 经济林研究开发中心,河南 郑州 450003)
为获得适用于转录组测序的枣花、结果枝和果实的总RNA提取方法,以中秋酥脆枣为材料,比较分析了Ambiogen和Autolab 2种总RNA提取试剂盒和基于Autolab试剂盒改良的CTAB法的总RNA的提取效果。结果表明:3种方法提取RNA的OD260/OD280差别不大,但用2种试剂盒提取的RNA有降解,其中Ambiogen试剂盒提取的花、结果枝和果实3个器官的RNA质量浓度分别为126、284和222 ng/μL;Autolab试剂盒提取的RNA质量浓度分别为307、402和266 ng/μL;基于Autolab试剂盒改良的CTAB法提取的RNA质量浓度分别为401、417和296 ng/μL。与2种试剂盒相比,基于Autolab试剂盒改良的CTAB法提取出来的RNA完整性好、纯度和浓度高,能够满足转录组测序的要求。
中秋酥脆枣;转录组测序;RNA提取;RNA完整性
转录组测序是近年兴起的一种高通量测序技术,其测序对象为特定细胞在某一功能状态下所能转录出来的所有RNA的总和,主要包括mRNA和非编码RNA。转录组测序技术(RNA-seq)具有成本低、定量准确、可重复性高、检测范围广和不受遗传背景限制等优点,这在转录组学的应用上具有革命性意义[1-3]。转录组测序在cDNA文库构建时对RNA的浓度、纯度和完整性等均有较高的要求[4]。
枣Ziziphus jujuba为鼠李科Rhamnaceae枣属Ziziphus落叶灌木,是原产于我国的重要经济树种和木本粮食作物[5]。枣树栽培历史悠久,具有重要的生态和经济价值,是当前我国果树和生态经济林产业重点发展的树种之一[6-7]。近年来,有关枣树的研究多集中在枣的光合特性、果实性状评价以及高效栽培技术等方面[8-12],关于其分子生物学方面的研究报道较少。
有关植物总RNA提取方法的报道较多,但不同物种或同一物种的不同品种,甚至同一品种的不同器官(组织)组成成分差别较大,同一方法未必具有通用性,因此需要根据具体的品种或器官(组织)探索适宜的RNA提取方法[13-15]。枣不同器官(组织)中组分不同,如枣花和枣果实中含有大量的多酚、多糖和醌类等次生代谢物质,并且富含RNase,RNA极易被分离降解,给枣RNA的分离纯化带来许多困难[16]。目前已有一些枣RNA提取方法的研究报道[17-19],但针对适用于枣不同器官转录组测序的RNA提取方法尚未见报道。基于此,本研究中使用了3种方法对枣花、结果枝和果实进行总RNA提取,比较了RNA的质量,为用于转录组测序的枣不同器官总RNA提取方法的建立提供了科学依据。
1 材料与方法
1.1 植物材料
试验品种为5年生的中秋酥脆枣,栽植于湖南衡阳中南林业科技大学枣试验基地,分别采集枣花、结果枝和果实,取样品后迅速装入灭菌的RNase-free离心管中,置于液氮中保存。
1.2 总RNA提取方法
选取Ambiogen试剂盒法(方法1)、Autolab试剂盒法(方法2)、基于Autolab试剂盒改良的CTAB法(方法3)3种方法分别对枣花、结果枝和果实进行总RNA的提取。方法1与方法2严格按该试剂盒操作说明提取即可。方法3在使用该试剂盒的基础上,进行如下处理:(1)研磨好的样品首先加入65 ℃预热好的CTAB裂解缓冲液,在65 ℃水浴中温浴10 min,在此期间涡旋振荡5次;(2)加入 200 μL 的 KAc(5 mol/L)、600 μL 的氯仿/异戊醇(24∶1),涡旋振荡5 min,然后冰浴10 min;(3)使用标准离心机13 000~14 000 r/min离心2 min,取450 μL上清液置于新的离心管中,加入450 μL该试剂盒中的RLT溶液,再次以同样转速离心2 min,以后步骤按试剂盒说明操作即可。
1.3 RNA质量检测
用1%琼脂糖凝胶电泳初步检测RNA的质量,然后用Agilent 2100检测RNA的完整性、纯度和浓度。
1.4 mRNA纯化及文库构建、测序
用NEBNext Poly(A) mRNA Magnetic Isolation Module(NEB, E7490) 富 集 mRNA。 以 mRNA为模板,用NEBNext mRNA Library Prep Master Mix Set for Illumina(NEB, E6110) 和 NEBNext Multiplex Oligos for Illumina(NEB, E7500) 构建上机文库。制备好的文库用1.8%琼脂糖凝胶电泳检测文库插入片段的大小,然后用Library Quantification Kit-Illumina GA Universal(Kapa,KK4824)进行QPCR定量。检测合格的文库在Illumina cbot上进行簇的生成,最后用Illumina HiSeqTM 2000进行测序。
2 结果与分析
2.1 枣不同器官总RNA质量
转录组测序对样本RNA质量有较高要求,一般要求RNA总量≥20 ng,质量浓度≥400 ng/µL,OD260/OD280为 1.8 ~ 2.2,OD260/OD230> 1.8,RNA完整性值≥8,28S/18S>1.0。本试验中分别用3种方法提取枣花、结果枝和果实的总RNA,用1%琼脂糖凝胶电泳初步检测后,通过Agilent 2100进行总RNA质量分析,包括RNA完整性、浓度和纯度等。
2.1.1 RNA完整性
使用方法1提取枣花、结果枝和枣果实的RNA的完整性值分别为5.1、5.2和2.4;方法2提取的RNA的完整性值分别为7.1、6.3和5.9;通过方法3获得RNA的完整性值分别为8.3、9.5和8.6,使用方法1提取的枣的3个器官RNA的28S/18S分别为0.0、2.7和0.1;方法2提取RNA的28S/18S分别为1.9、2.3和0.0;而方法3提取RNA的28S/18S分别为2.5、1.7和2.4(见表1)。从Agilent 2100检测图上也可看出方法1和方法2提取的RNA明显有降解(见图1和图2),RNA完整性差,方法3提取的RNA完整性最好(见图3)。

表 1 不同提取方法对中秋酥脆枣各器官总RNA提取结果比较Table 1 Comparison of the total RNAs extracted from different organs in Z. jujuba cv. ‘Zhongqiusucui’ with different methods

图 1 Agilent 2100 RNA芯片对方法1提取中秋酥脆枣的总RNA电泳结果质量Fig. 1 The electrophoresis result of total RNAs extracted from Z. jujuba cv. ‘Zhongqiusucui’ with method 1 and Agilent 2100 RNA chip

图 2 Agilent 2100 RNA芯片对方法2提取中秋酥脆枣的总RNA电泳结果质量Fig. 2 The electrophoresis result of total RNAs extracted from Z. jujuba cv. ‘Zhongqiusucui’ with method 2 and Agilent 2100 RNA chip
2.1.2 RNA质量浓度
方法1提取的RNA质量浓度分别为126、284和222 ng/μL;方法 2提取的 RNA质量浓度分别为307、402和266 ng/μL;方法3提取的RNA质量浓度分别为401、417和296 ng/μL,由此可看出方法3提取的RNA质量浓度最高。
2.1.3 RNA纯度
3种方法提取的RNA的OD260/OD280值没有显著差异,均在1.8~2.0,但方法3提取花、结果枝和果实RNA的OD260/OD280分别为1.93、1.98和1.83。使用方法1提取的RNA的OD260/OD230值分别为0.97、2.09和1.38,可见枣花和果实RNA的OD260/OD230值低于1.8;方法2提取RNA的OD260/OD230值分别为2.01、2.11和1.89;方法3提取RNA的OD260/OD230值分别为2.05、2.12和1.98。由此可见方法3提取的RNA的OD260/OD280值和OD260/OD230值高于2种试剂盒法,说明方法3提取的RNA纯度高,没有被污染。
综上所述,在3种提取枣花、结果枝和果实的总RNA方法中,方法3效果最好。即基于Autolab试剂盒改良的CTAB法获得的总RNA浓度高、纯度高、完整性好,满足转录组测序和cDNA文库构建的需求。
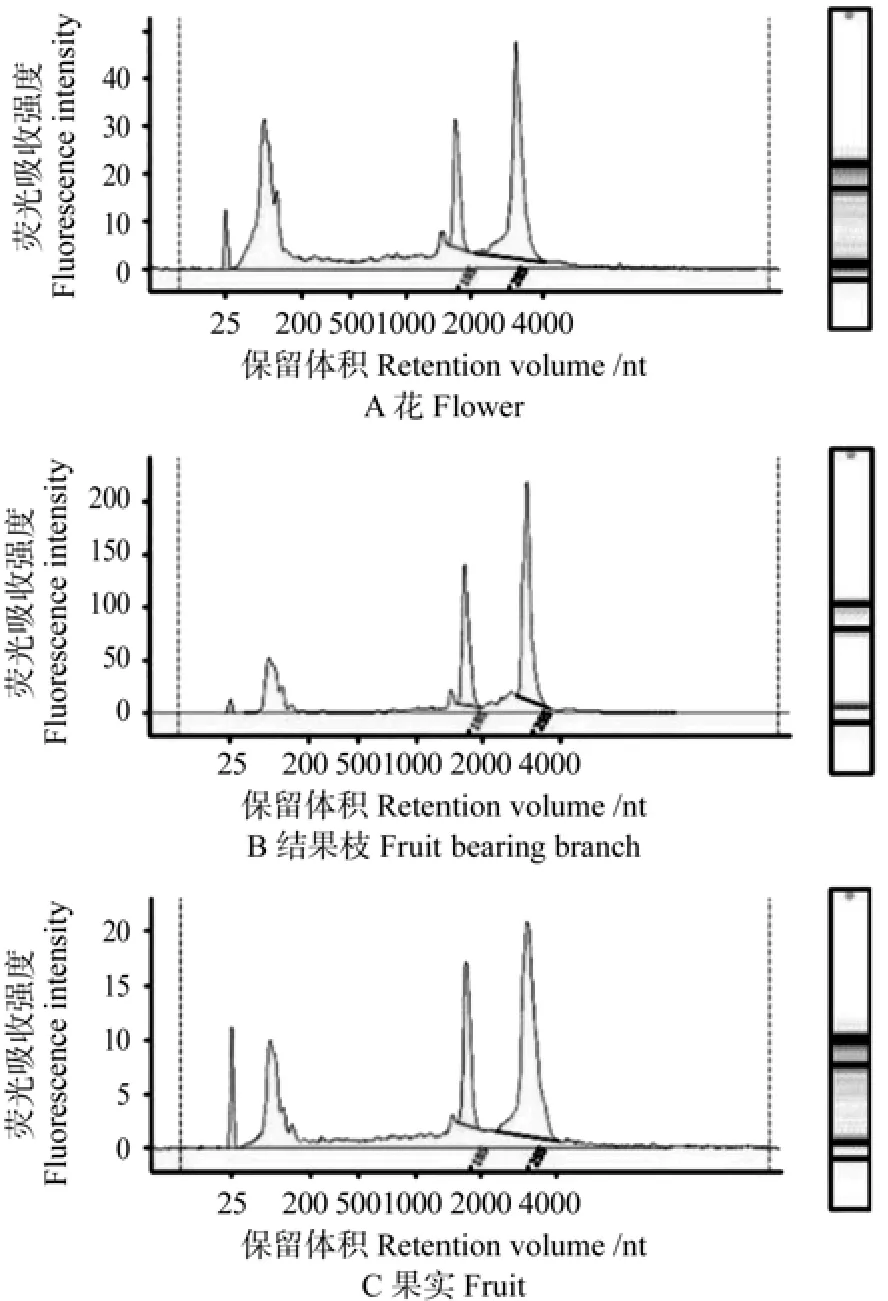
图 3 Agilent 2100 RNA芯片对方法3提取中秋酥脆枣的总RNA电泳结果质量Fig. 3 The electrophoresis result of total RNAs extracted from Z. jujuba cv. ‘Zhongqiusucui’ with method 3 and Agilent 2100 RNA chip

图 4 分离纯化后的mRNA琼脂糖电泳图Fig. 4 Agarose gel electrophoresis of puri fi ed mRNAs
2.2 mRNA的分离纯化
mRNA质量直接关系到文库的质量,在本研究中,分离纯化后的mRNA经电泳检测,其覆盖范围集中于250~2 000 bp之间(见图4),表明纯化的mRNA中应该包含大量该时期表达的基因。经核酸蛋白检测仪检测,枣花mRNA的OD260/OD280为1.98,OD260/OD230为 2.01,质量浓度为 310 ng/μL;枣结果枝mRNA的OD260/OD280和OD260/OD230分别是1.99和2.12,质量浓度为325 ng/μL;枣果实mRNA的OD260/OD280和OD260/OD230分别是1.93和1.98,质量浓度为287 ng/μL,说明mRNA样品中没有蛋白质、其它有机和无机离子的污染或被污染程度极低,能满足转录组测序和文库构建的需要。
2.3 cDNA文库构建及测序
将mRNA等量混合后,进行cDNA文库构建,然后进行转录组测序,最终获得34 587条Unigene。进一步表明,方法3即基于Autolab试剂盒改良的CTAB法可以成功提取高质量的RNA,能够满足栆花、结果枝、果实等器官转录组测序的质量标准。
3 结论与讨论
目前,已有较多关于植物RNA提取方法的报道,但各RNA提取方法有其优点和缺点,不同植物适用的提取方法也不同[20-23]。转录组测序等分子生物学研究对RNA的质量要求较高,因此找到一种适用于转录组测序的RNA提取方法尤为重要。但在枣组织中含有使RNA极易被降解的次生代谢物质以及RNase,增加了提取高质量RNA的难度,所以在试验过程中所有的仪器设备都要经过严格处理,防止RNA被降解,从而选择适宜的方法提取RNA,才能更好地进行转录组测序和cDNA文库建立等研究工作。
该研究中以中秋酥脆枣为材料,采用Ambiogen试剂盒、Autolab试剂盒和基于Autolab试剂盒改良的CTAB法分别提取枣花、结果枝和果实总RNA,并对其提取效果进行了比较分析。其中Ambiogen试剂盒提取的RNA浓度和纯度较低,而且枣花和枣果实的OD260/OD280值<1.8,枣果实的OD260/OD280值<1.8,枣花和枣果实的RNA 28S/18S值<1.0,其RIN值分别为5.1、5.2和2.4,可见其RNA有降解,完整性不好,故该方法提取的RNA没有达到试验标准;Autolab试剂盒提取的RNA浓度和纯度虽达到要求,但其RNA的28S/18S值<1.0,RIN值<8,完整性略差,不能很好地满足试验要求;基于Autolab试剂盒改良CTAB法提取的RNA质量浓度分别为401、417和296 ng/μL,其OD260/OD280值为1.8~2.2、OD260/OD230值>1.8,RIN 值分别为 8.3、9.5和8.6,由此可见该方法提取的RNA各方面均达试验要求。因此基于Autolab试剂盒改良CTAB法提取的RNA不论是浓度、纯度还是完整性均是最好的,Autolab试剂盒法次之,再次是Ambiogen试剂盒法。
获得高质量的总RNA是进行转录组测序的前提,本研究结果表明:基于Autolab试剂盒改良CTAB法提取的枣花、枣结果枝和枣果实的RNA浓度高、纯度和完整性最好,满足转录组测序、cDNA文库构建及RT-PCR等需要高质量RNA的试验需求,是提取枣总RNA的首选方法。
[1]林 燕,李 菲,张淑江,等.适用于转录组测序的大白菜小孢子总RNA提取方法筛选[J].中国蔬菜,2014,1(11):15-19.
[2]井赵斌,魏 琳,俞 靓,等.转录组测序及其在牧草基因资源发掘中的应用前景[J].草业科学,2011,28(7):1364-1369.
[3]Wang Z, Gerstein M, Snyder M. RNA-Seq: a revolutionary tool for transcriptomics [J]. Nature Research Genetics, 2009, 10(1):57-63.
[4]李 宏,王新力.植物组织RNA提取的难点及对策[J].生物技术通报,1999,(1):36-39.
[5]刘青柏,刘明国,刘明忠,等.朝阳地区不同品种枣树光合及水分利用特征研究[J].经济林研究,2013,31(3):16-20.
[6]赵 锦,刘中成,代 丽,等.枣不同器官和组织RNA提取方法的研究[J].植物遗传资源学报,2009,10(1):111-117.
[7]原勤勤,文亚峰,刘 儒,等.枣优良品种亲缘关系的ISSR分析[J].经济林研究,2012,30(1):56-61.
[8]张 舟,吕芳德,王 森.不同枣品种光合特性的比较研究[J].中南林业科技大学学报,2014,34(8):78-81.
[9]谢建秋,袁德义,陈文涛.浙西南引种鲜食枣果实性状综合评价[J].浙江林业科技,2013,33(6):19-23.
[10]王志伟,吕芳德,王 森.根外施肥对中秋酥脆枣幼树营养生长的影响[J].经济林研究,2013,31(2):96-99.
[11]周俊义.枣高效栽培教材[M].北京:金盾出版社,2009:1-10.
[12]张 萍,史彦江,宋锋惠,等.南疆灰枣主要营养品质性状的变异及相关性研究[J].果树学报,2011,28(1):77-81.
[13]Ainsworth C. Isolation of RNA from floral tissue of Rum exacetosa (sorrel) [J]. Plant Moleculer Biology Reporter, 1994,12(3): 198-203.
[14]Lewin sohn E, Steele C L, Croteau R. Simple isolation of functional RNA from woody stems of gym nosperms [J]. Plant Moleculer Biology Reporter, 1994, 12(1): 20-25.
[15]Su X, Gibor A. A method for RNA isolation from marine macroalgae [J]. Anal Biochem,1988,174:650-657.
[16]李继东,武应霞,冯建灿,等.枣RNA提取方法的比较[J].经济林研究,2010,28(4):15.
[17]冯延芝,袁德义,张 琳,等.枣花蕾总RNA提取方法的比较[J].经济林研究,2012,30(2):88-90.
[18]刘中成.枣总RNA提取及mRNA差异显示技术体系的建立[D].保定:河北农业大学,2012.
[19]韩 斌.枣果实总RNA的提取及其反转录技术体系的建立[D].保定:河北农业大学,2006.
[20]Chang S J, Puryear J, Cainey J. A simple and ef fi cient method for RNA isolating from pine trees [J]. Plant Molecular Biology Reporter, 1993, 11(2): 113-116.
[21]Liu Y Z, Liu Q, Tao N G,et al.Ef fi cient Isolation of RNA from Fruit Peel and Pulp of Ripening Navel Orange (Citrus sinensisOsbeck) [J]. Journal of Huazhong Agricultural University, 2006,25(3): 300-304.
[22]徐昌杰,陈昆松,张 波.柑橘组织RNA提取方法研究[J].果树学报,2004,21(2):136-140.
[23]李晓颖,曹 雪,房经贵.杏叶片与果实总RNA提取方法研究[J].中国农学通报,2010,26(2):152-156.
Screening of total RNA extraction methods for RNA-sequences from different organs inZiziphus jujuba
WEI Qi-qi1a-c, FENG Yan-zhi2, LIN Qing1a-c, JIA Bao-guang1a-c, ZHANG Lin1a-c
(1. a. The Key Lab of Non-wood Forest Products of State Forestry Administration; b. The Key Lab of Cultivation and Protection for Non-Wood Forest Trees of Education Ministry; c. 2011 Cooperative Innovation Center of Cultivation and Utilization for Non-Wood Forest Trees of Hunan Province, Central South University of Forestry & Technology, Changsha 410004, Hunan, China; 2. The Center of Research and Development for Non-wood Forest Tree, Chinese Academy of Forestry, Zhengzhou 450003, Henan, China)
In order to obtain the methods for high-quality total RNA extraction from fl ower, fruit bearing branch and fruit inZiziphus jujuba, takingZ. jujubacv. ‘Zhongqiusucui’ as materials, and the RNA extraction effects were compared using two kinds of total RNA extraction kits (Ambiogen and Autolab) and modi fi ed CTAB method based on the Autolab RNA extraction kit. The results showed thatOD260/OD280values of the RNA extracted by using the three RNA extraction methods had no signi fi cant differences, but a part of RNAs obtained by the two RNA extraction kits were degraded. The RNA mass concentrations from fl ower, fruit bearing branch and fruit were 126, 284 and 222 ng/μL by using the RNA extraction kit of Ambiogen; the RNA mass concentrations were 307, 402 and 266 ng/μL by using the RNA extraction kit of Autolab; and the RNA mass concentrations were 401, 417 and 296 ng/μL by using the modi fi ed CTAB method based on the Autolab RNA extraction kit, respectively. The modi fi ed CTAB method could generate high-integrity, high-concentration and high-purity RNA that could meet the request of transcriptome sequencing, compared with the two extraction kits.
Ziziphus jujubacv. ‘Zhongqiusucui’; transcriptome sequencing; RNA extraction; RNA integrity
S665.1
A
1003—8981(2015)02—0063—05
2014-12-20
国家“十二五”农村领域科技计划课题(2013BAD14B03)。
魏琦琦,硕士研究生。
张 琳,副教授,博士。E-mail:triwoodtim918@126.com
魏琦琦,冯延芝,林 青,等.适于转录组测序的枣不同器官总RNA提取方法筛选[J].经济林研究,2015,33(2):63-67.
10.14067/j.cnki.1003-8981.2015.02.011
http: //qks.csuft.edu.cn
[本文编校:闻 丽]
