新疆核桃根际土壤中解磷菌的分离筛选及鉴定
2015-01-05张晶晶李建贵郭艺鹏秦韵婷
张晶晶,李建贵,郭艺鹏,韩 超,秦韵婷
(新疆农业大学 林业研究所,新疆 乌鲁木齐 830052)
新疆核桃根际土壤中解磷菌的分离筛选及鉴定
张晶晶,李建贵,郭艺鹏,韩 超,秦韵婷
(新疆农业大学 林业研究所,新疆 乌鲁木齐 830052)
为给核桃专用微生物肥的研制提供菌株材料,通过对新疆核桃根际土壤中解磷菌的分离纯化,筛选出对核桃树具有促生作用且能在其根际稳定定殖的优质高效解磷菌株。从阿克苏、和田、喀什等新疆核桃主产区的根际土壤中分离出解磷菌54株,采用溶磷圈初筛法和液体摇瓶复筛法对其解磷能力进行测定,筛选出解磷能力强的菌株14株。经耐利福平诱导后剩余13株,再进行大田定殖试验,最终筛选出11株解磷菌。经16S rDNA鉴定,得出这11株解磷菌归属于5个属,分别为假单胞菌属Pseudomonas,葡萄球菌属Staphylococcus,动性杆菌属Planomicrobium,微杆菌属Microbacterium,不动杆菌属Acinetobacter,其中,假单胞菌属为优势种群且解磷效果最好。
新疆核桃;解磷菌;筛选;鉴定
磷是农业生产中的重要限制因素之一,在土壤缺乏磷素的状态下,作物的产量将大大降低。土壤中全磷含量一般都比较充足,但植物可吸收的有效磷含量很低[1],主要是因为对土壤施用大量的磷肥后,这些可溶性磷肥大部分很快会被转变成植物难以吸收利用的磷酸盐形式,主要以磷酸钙为主[2]。研究表明,解磷菌可以将土壤中的难溶态磷通过溶解或矿化作用转化为可溶性磷。核桃Juglans regiaL.是世界著名的四大坚果之一,具有较高的营养价值和保健功能[3],它作为新疆特色林果的主要树种,同样面临着严重缺磷的问题。因此,有必要从核桃土壤中筛选出高效的解磷菌株制成生物菌剂,再回接到土壤中以促进植物生长[4]。这样不仅可以有效地减少化学磷肥的使用,还对提高作物产量具有重要意义。
目前,国内外已有大量关于解磷菌的研究。在国内方面,2006年,Chen等分离得到多株具有解磷能力的细菌,发现其解磷作用与有机酸的产生和培养基pH值的降低有关[5]。2007年,吕学斌等将分离得到的4株解磷菌株和2株对照菌株进行了解磷效果的对比试验,结果发现不同菌株有着不同的磷源偏好,解磷效果差异较大[6]。2008年,吕德国等探讨了解磷细菌定殖规律及其与本溪山樱地上部和地下部生长发育的关系,发现解磷细菌的定殖数量随外来微生物侵入数量的增多而减少[7]。国外方面,2005年,Chung等从韩国不同农作物根际土壤中分离得到13株解磷细菌,并进行了全细胞脂肪酸甲酯(FAME)和16S rDNA序列分析[8]。2006年,Hameeda等研究发现,微生物解磷的能力与其产生葡萄糖酸的量有很大关系,解磷能力强,其相应的产生葡萄糖酸的量也多[9]。2008年,Delvasto等从巴西地区一种含磷量较高的铁矿石中分离得到4株解磷细菌,并研究了菌株的多样性、解磷活力及解磷机制[10]。
如今,解磷微生物肥的应用已很广泛,但对核桃专用解磷菌剂的研究还比较少。笔者从核桃根际土壤中筛选出具有解磷作用且能在根际稳定定殖的优质菌株,并对其进行鉴定,旨在为核桃专用微生物肥的研制提供菌株材料。
1 试验区气象条件
试验于2013~2014年在新疆农业大学实验室进行,试验区设于阿克苏红旗坡农场某核桃园(N39°30′~ 41°27′,E79°39′~ 82°01′)。 试验区地处欧亚大陆深处,远离海洋,具有典型的暖温带大陆性干旱气候特征。降水稀少,蒸发量大,主要靠灌溉水,蓄水量稳定。光照充足,热量丰富,昼夜温差大,无霜期较长。地面平均温度12.0~15.1 ℃,年平均降水量为80.4 mm,年平均蒸发量为1 948 mm,年平均日照时数2 809 h,一般年份最低气温-15 ℃左右,极端最低气温-21 ℃。
2 材料与方法
2.1 试验设计
试验材料为阿克苏、和田、喀什等地的核桃根际土壤。土样带回实验室后,取根系及黏附其上的土壤用于解磷菌的分离筛选,将筛选好的解磷菌进行抗生素标记后,定殖于试验区,并于加入菌剂后的0、10、25、45 d进行根际土壤的回收,再次进行解磷能力测定及菌落计数。最后,将筛选出的优质解磷菌进行菌种鉴定。
2.2 试验方法
对土壤中解有机磷菌和解无机磷菌的分离分别采用的是卵磷脂与磷酸三钙解磷培养基[11-12];解磷能力测定采用的是溶磷圈初筛法[13]和液体摇瓶复筛法[14];定殖能力测定采用的是含利福平肉汤梯度培养法,从而获得耐利福平350 μg/mL的标记菌株并进行灌根及回收试验;菌种鉴定采用的是16S rDNA鉴定[15]。
3 结果与分析
3.1 解磷菌的分离
通过对采集的核桃根际土壤进行解磷菌的分离,共得到54株解磷菌株并对其进行了编号,具体编号见表1。

表 1 新疆核桃解磷菌株Table 1 The phosphate-solubilizing bacteria of Xinjiang walnut
3.2 解磷菌的初筛
将分离得到的54株解磷菌进行溶磷圈法试验,初步选出以下14株解磷效果较好的解磷菌,并重新进行编号。测定其培养1 d和3 d后,在磷灰石板和卵黄板上形成的透明圈和浑浊圈的半径,如图1、图2所示。
从图1可以看出,除PH-4外,培养1 d后,解无机磷菌在磷灰石板上形成了透明圈,其半径为1.71~4.02 mm;培养3 d后,各菌株均形成了明显的透明圈,其半径为2.15~6.17 mm。其中,PH-6、PH-7、PH-11、PH-12的解无机磷能力相对较高。
从图2可以看出,培养1 d后,解有机磷菌在卵黄板上均形成浑浊圈,半径为2.00~7.82 mm;培养3 d后,各菌株均形成了明显的浑浊圈,其半径为3.91~11.83 mm。解有机磷效果好的有:PH-1、PH-4、PH-7、PH-8、PH-11。综合图1和2可以得出,在初筛中,PH-1、PH-7、PH-8、PH-11的解无机磷和解有机磷效果均较好。

图1 新疆核桃解磷菌在磷灰石板上形成的透明圈半径Fig. 1 Transparent circle radii forming on the apatite board of xinjiang walnut phosphate-solubilizing bacteria

图2 新疆核桃解磷菌在卵黄板上形成的浑浊圈半径Fig. 2 Turbidity circle radii forming on the yolk board of xinjiang walnut phosphate-solubilizing bacteria
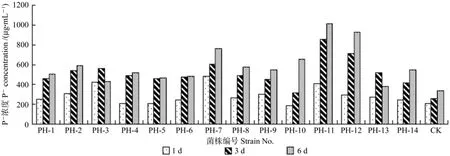
图3 解无机磷菌液含磷量Fig. 3 Phosphorus contents of inorganic phosphorus solubilizing bacteria solutions
3.3 解磷菌的复筛
将初筛得到的14株解磷菌与CK(加入等量灭活培养液)一起进行液体摇瓶复筛,其发酵液1、3、6 d后的可溶性磷含量测定结果见图3和图4。
从图3和图4可以看出,接种后,随着天数的增加发酵液中可溶性磷(解有机磷P+和解无机磷P-)含量也基本上呈增长趋势,仅有极少数出现下降,如解无机磷中的PH-3、PH-13和解有机磷的PH-2、PH-4在6 d后浓度有所下降,但其含量与CK相比均有所提高,故将其保留。其中解无机磷效果好的有:PH-7、PH-11、PH-12;解有机磷效果好的有:PH-1、PH-8、PH-11、PH-12。综合以上结果来看,这14株解磷菌均可进行下一步试验。

图4 解有机磷菌液含磷量Fig. 4 Phosphorus contents of organic phosphorus solubilizing bacteria solutions
3.4 耐利福平诱导后菌株的解磷能力
将筛选后的14株解磷菌经利福平标记后,再次进行溶磷圈测定,其结果如图5所示。

图5 利福平标记后解磷菌的解磷能力Fig. 5 Phosphate-solubilizing ability of phosphate-solubilizing bacteria after inducted by rifampicin resistance
从图5可以看出,经利福平标记后,PH-7、PH-8、PH-11仍能保持相对较高的解磷能力,但大多数解磷菌的解磷能力变弱,PH-4、PH-10和PH-13甚至丧失了解无机磷能力,PH-6失去了解有机磷能力。其中,PH-10的解有机磷能力又相对较低,将其去除,采用其它13株解磷菌进行下一步试验。
3.5 解磷菌定殖试验
3.5.1 解磷菌定殖后菌落计数结果
将利福平标记过的解磷菌培养液经计数达108cfu/mL后,将其稀释液与CK(设等量灭活的细菌培养基为对照)一起施入核桃根际,并在加入菌剂后的0、10、25、45 d进行根际土壤的回收计数,试验结果如表2所示。

表 2 定殖后解磷菌菌落计数Table 2 Colony count of phosphate-solubilizing bacteria after colonization cfu/mL
从表2可以看出,施入核桃根际的解磷菌株在定殖过程中数量呈快速下降的趋势,这主要是由于初始接种量较大,超出了土壤的承载量,随着时间的推移,接种进去的解磷菌慢慢适应了当地土壤环境,菌株数量也逐渐稳定下来,45 d后保持在107cfu/mL。其中PH-1、PH-7、PH-8、PH-11、PH-12的菌株数量较多,达到2×107cfu/mL以上,说明其具有较强的适应性。
3.5.2 解磷菌定殖后解磷能力测定结果
将定殖45 d后的解磷菌进行回收,纯化后进行溶磷圈试验,所得结果见图6。

图6 定殖后解磷菌解磷能力Fig. 6 Phosphate-solubilizing ability of phosphate-solubilizing bacteria after colonization
从图6可以得出以下结论,筛选出的13株解磷菌在定殖后基本上仍能保持其解磷能力。其中,PH-1、PH-7、PH-8、PH-11、PH-12的解磷效果相对较好;PH-2、PH-4与PH-13失去了解无机磷能力,且PH-2、PH-13的解有机磷能力效果也不好,将其去除,而PH-4的解有机磷能力相对较好,将其保留。故最终筛选出11株解磷能力较好的菌株。
3.6 菌种鉴定
3.6.1 16S rDNA的PCR扩增产物电泳检测
采用细菌基因组DNA提取试剂盒对核桃解磷菌进行DNA提取后,对其进行PCR扩增,并进行1%琼脂糖凝胶电泳检测,所得电泳图谱如图7所示。

图7 解磷菌16S rDNA 的PCR扩增产物电泳检测结果Fig. 7 Electrophoresis test results of PCR ampli fi cation products of phosphate-solubilizing bacteria 16S rDNA
从图7中可以看出扩增出的16S rDNA片段序列长度在1 000~2 000 bp,符合常规的16S rDNA序列长度。
3.6.2 16S rDNA基因序列分析
将回收的片段送至上海生工生物工程服务有限公司进行测序,共获得11条DNA序列,采用ClustalX1.8软件进行拼接,使用NCBI的BLAST功能,与GenBank中已有序列进行比对,结果如表3所示。
经拼接对比鉴定,发现这11株解磷菌归属于 5个 属。 其 中,PH-1、PH-4、PH-5、PH-7、PH-9、PH-11为 假 单 胞 菌 属Pseudomonas,PH-6和PH-14为葡萄球菌属Staphylococcus,PH-3为动性杆菌属Planomicrobium,PH-8为微杆菌属Microbacterium,PH-12为不动杆菌属Acinetobacter。
4 小 结
4.1 新疆核桃解磷菌的分离筛选
从新疆核桃根际土壤中分离出54株解磷菌,采用溶磷圈初筛和液体摇瓶复筛法,选出解磷菌14株。经耐利福平诱导后,淘汰1株。然后将这13株菌株数量在108cfu/mL水平的解磷菌菌剂进行大田定殖45 d后,13株菌株的数量均保持在107cfu/mL水平(对照为106cfu/mL水平),再用溶磷圈法测定其解磷能力,最终筛选出11株解磷效果较好的菌株。
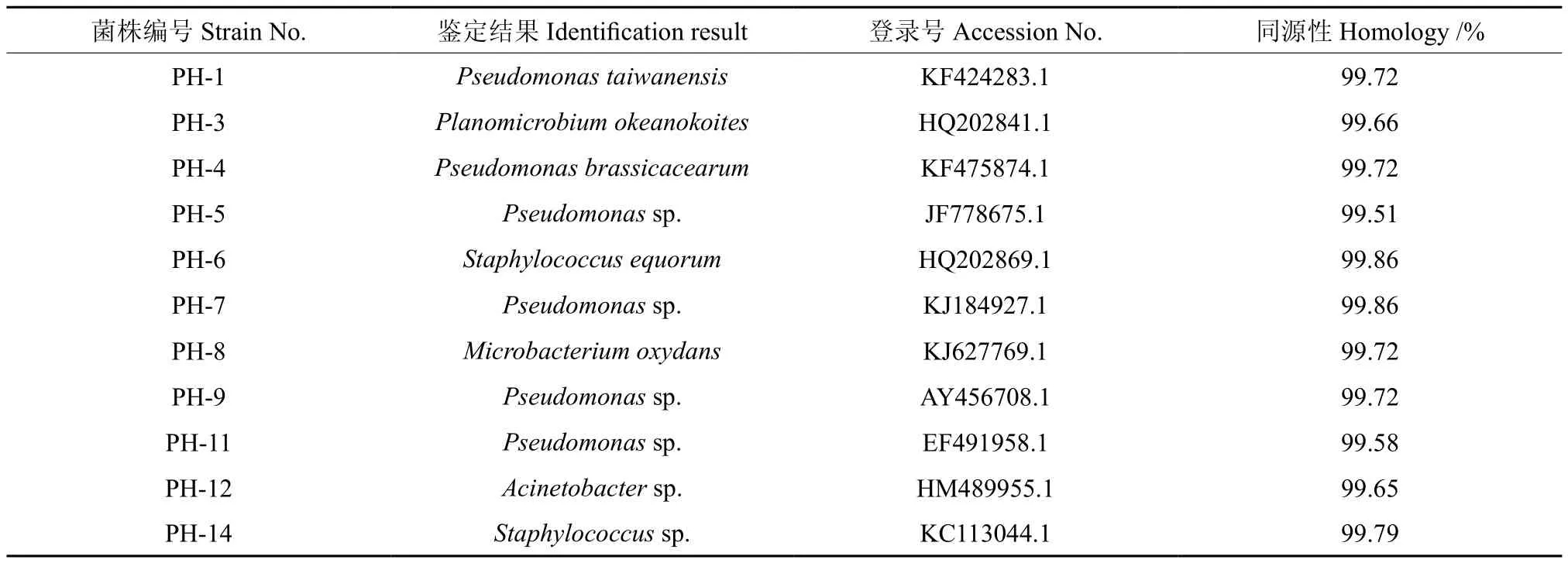
表 3 解磷菌16S rDNA序列BLAST结果Table 3 BLAST results of 16S rDNA sequence in phosphate-solubilizing bacteria
4.2 新疆核桃解磷菌的鉴定
经16S rDNA进行鉴定,得出这11株解磷菌归属于5个属,其中6株菌株属于假单胞菌属Pseudomonas,1株为微杆菌属Microbacterium,1株为不动杆菌属Acinetobacter,2株为葡萄球菌属Staphylococcus,1株为动性杆菌属Planomicrobium。
综合以上结果得出,假单胞菌属为解磷菌的优势种群,而且是解磷能力最好的。本试验再次证实了解磷微生物的资源种类繁多,可供人们的开发和利用,特别是假单胞菌属。但是,由于解磷菌的解磷能力具有不稳定性,在菌株保存过程中,有些菌株会失去解磷能力。因此,深入研究解磷能力的稳定性和解磷机制是今后的研究目标。
[1]王金路,陈永忠,张党权,等.不同磷源对油茶幼苗生长的影响[J].中南林业科技大学学报,2014,34(5):47-50.
[2]伊 鋆.高效解磷细菌的筛选及解磷机理的研究[D].大连:大连理工大学,2011.
[3]武 静.早实核桃坚果品质与叶片营养相关性浅析[J].中南林业科技大学学报,2013,33(8):24-27.
[4]Jose Mariano. Phosphate-solubilizing bacteria as inoculants for agriculture: use of updated molecular techniques in their study[J].Agronomie, 2001, 21: 561-568.
[5]Chen Y P, Rekha P D, Arun A B,et al.Phosphate solubilizing bacteria from subtropical soil and their tricalcium Phosphate solubilizing abilities[J]. Applied soil Ecology,2006,34:33-41.
[6]吕学斌,孙亚凯,张毅民.几株高效溶磷菌株对不同磷源溶磷活力的比较[J].农业工程学报,2007,23(5):195-197.
[7]吕德国,于 翠,秦嗣军,等.本溪山樱根部解磷细菌的定殖规律及其对植株生长发育的影响[J].中国农业科学,2008,41(2): 508-515.
[8]Chung H Y, Park M, Madhaiyan M,et al. Isolation and characterization of phosphate solubilizing bacteria from the rhizosphere of crop plants of Korea[J]. Soil Biology &Biochemistry, 2005, 37: 1970-1974.
[9]Hameeda B, Harish K RY, Rupela O P,et al.Effect of carbon substrates on rock phosphate solubilization by bacteria from composts and macrofauna[J]. Current Microbiology, 2006, 53:298-302.
[10]Delvasto P, Valverde A, Ballester A,et al.Diversity and activity of phosphate bioleaching bacteria from a high-phosphorus iron ore[J]. Hydrometallurgy, 2008,92:124-129.
[11]中国科学院南京土壤研究所微生物室.土壤微生物研究法[M].北京:科学出版社,1985.
[12]徐光辉,郑洪元.土壤微生物分析方法手册[M].北京:农业出版社,1986.
[13]吴 凡,崔 萍,夏尚远,等.桑树根际解磷细菌的分离鉴定及解磷能力测定[J].蚕业科学,2007,33(44):521-527.
[14]张祥胜.发酵液有效磷含量测定方法研究[J].湖州职业技术学院学报,2008,(3):1-3.
[15]孙林琦,郭艺鹏,王海儒,等.新疆枣园土壤解钾微生物菌株筛选及鉴定[J].经济林研究,2014,32(4):58-62.
Screening and identi fi cation of phosphate-solubilizing bacteria in rhizosphere soil of Xinjiang walnut
ZHANG Jing-jing, LI Jian-gui, GUO Yi-peng, HAN Chao, QIN Yun-ting
(Institute of Forestry, Xinjiang Agricultural University, Urumqi 830052, Xinjiang, China)
In order to provide strain material for development of speci fi c walnut microbial fertilizer, through separation and purification of the phosphate-solubilizing bacteria in rhizosphere soil of Xinjiang walnut, some high quality and efficient phosphate-solubilizing strains were screened, which had growth-promoting effect for walnut tree and could colonize stably in its rhizosphere. 54 strains of phosphate-solubilizing bacteria were isolated from the rhizosphere soil of Aksu, Hotan and Kashgar walnut-producing areas in Xinjiang, ability of its phosphate-solubilizing were measured by using the methods of dissolved phosphorus ring screening and liquid shake fl ask screening, and 14 strains of bacteria with strong phosphate-solubilizing ability were screened out. 13 strains of phosphate-solubilizing bacteria were reserved after inducted by rifampicin resistance, and eventually 11 strains of phosphate-solubilizing bacteria were selected out after the field colonization experiments. The 11 strains of phosphate-solubilizing bacteria were identified by 16S rDNA, they belonged to 5 genera, and they werePseudomonas,Staphylococcus,Planomicrobium,Microbacterium, andAcinetobacter.Among them,Pseudomonaswas the dominant population and its phosphate-solubilizing effect was best.
Xinjiang walnut; phosphate-solubilizing bacteria; screening; identi fi cation
S664.1
A
1003—8981(2015)02—0057—06
2015-01-04
国家林业公益性项目重大专项课题“新疆红枣、核桃专用微生物肥料研制与应用示范”(201304701);新疆自治区重点学科森林培育。
张晶晶,硕士研究生。
李建贵,教授,博士生导师。E-mail:lijiangui1971@163.com
张晶晶,李建贵,郭艺鹏,等.新疆核桃根际土壤中解磷菌的分离筛选及鉴定[J].经济林研究,2015,33(2):57-62.
10.14067/j.cnki.1003-8981.2015.02.010
http: //qks.csuft.edu.cn
[本文编校:闻 丽]
