多种微创保守性术式治疗子宫腺肌病及术后生殖预后的临床观察
2015-01-05熊佳维李凌霄
熊佳维,李凌霄,蒋 丽
(广西妇产医院妇二科,广西 南宁 530002)
多种微创保守性术式治疗子宫腺肌病及术后生殖预后的临床观察
熊佳维,李凌霄,蒋 丽
(广西妇产医院妇二科,广西 南宁 530002)
目的探讨多种微创保守性术式治疗子宫腺肌病(AM)的长期疗效,以及子宫腺肌病患者术后生殖预后的影响因素。方法收集2010年1月至2014年1月诊断为子宫腺肌病且有意愿保留子宫或生育要求的患者共93例,根据手术方式的不同分为:子宫动脉阻断术(uterine artery blockage)组(A组,n=32),病灶切除术(lesion resection surgery)组(B组,n=33),子宫动脉阻断联合病灶切除术组(C组,n=28),比较3组间的随访指标;对7个可能影响术后生殖预后的因素进行单因素和多因素Logistic 回归分析。结果与术前相比,3组患者术后各阶段的月经量均明显减少、痛经评分下降、子宫体积明显缩小(P<0.05);3组术后相应指标(月经量、痛经评分、子宫大小)在术后12月均降至最低,随后有上升趋势;术后12月起C组月经量、痛经评分、子宫大小分别与同期A、B组比较,差异有统计学意义(P<0.05)。单因素分析发现1年内妊娠率与年龄、子宫内膜-肌层交界区(JZ)厚度、合并子宫内膜异位症(EM)情况、术后规范用药情况及接受助孕、辅助生殖技术情况等因素有关,差异有统计学意义(P<0.05);进一步多因素Logistic 回归分析显示,独立危险因素包括年龄≥35岁、JZ厚度>12 mm,而当JZ厚度<10 mm、术后常规用药则是保护性因素。(OR分别为2.327、3.025、0.328、0.357,P<0.05)。结论3种术式治疗AM的远期疗效良好,其中以子宫动脉阻断联合病灶切除术的疗效更佳;术后生殖预后与多个因素有关。
子宫腺肌病; 微创; 保守性手术; 生殖预后; 影响因素
子宫腺肌病(adenomyosis,AM)是指异位内膜浸润正常的子宫肌层,周围平滑肌细胞增生包裹异位的内膜上皮和基质而形成病灶,通常是发生在内膜-肌层交界下2.5 mm位置,病变弥漫[1]。传统的公认有效的治疗该病的方法是子宫切除术,但该术式对于年龄较轻,要求保留子宫或者有生育要求的患者常常难以接受。微创保守性术式的多样化发展为满足患者个体化需要成为了可能。然而,该类术式存在的风险有:顾及维持子宫及其肌层形态结构完整则难以完全切净病灶;而做到尽量切除病灶,则易使子宫基本形态和肌层结构受到严重破坏,术后并发症增多,尤其对后续妊娠产生十分不利的影响[2]。这些风险让临床医生在实施该类术式时变得犹豫。因此,本研究通过回顾性分析临床资料,阐述多种保守性术式治疗AM的长期疗效观察,并探讨影响术后生殖预后的影响因素,旨在评价各种保守性术式的临床价值并鉴别可能存在的导致不孕症发生的危险因素。
1 资料与方法
1.1 一般资料
收集2010年1月至2013年1月在广西妇产医院诊断为子宫腺肌病且有意愿保留子宫或有生育要求的患者共93例,均行系统手术及药物治疗且有完整病例随访资料。子宫腺肌病的诊断标准[3-4]:1)临床表现:痛经、月经量增多、子宫增大;2)B超检查:子宫增大,肌层回声不均,常表现为子宫后壁增厚明显,内膜线前移;3)MRI检查:子宫内存在界线不清、信号强度低的病灶,T2加权影像可有高信号强度的病灶,内膜与肌层交界区增厚>12 mm。按照不同的手术方式,将其分为3组:子宫动脉阻断术(uterine artery blockage,UAB)组(A组,n=32),病灶切除术(lesion resection surgery)组(B组,n=33),子宫动脉阻断联合病灶切除术组(C组,n=28)。3组患者的术前一般资料(即相关临床病理特征)比较,差异均无统计学意义(P>0.05),见表1。

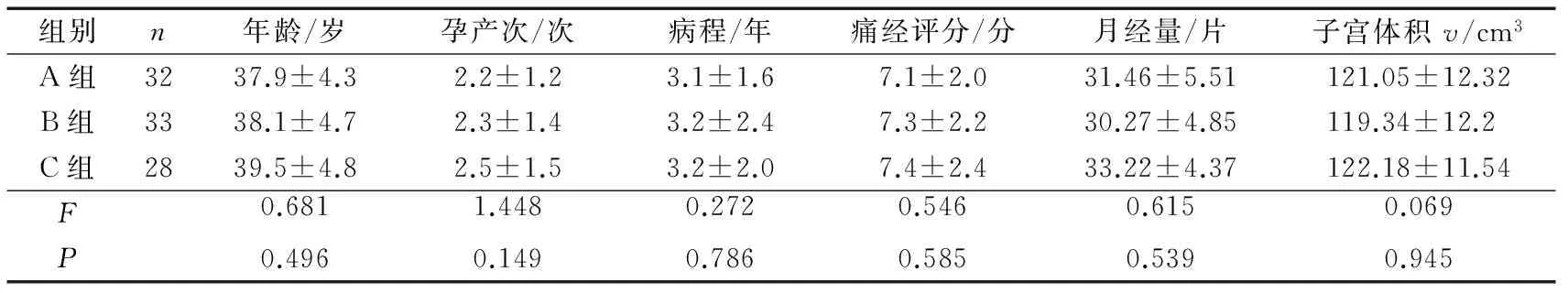
组别n年龄/岁孕产次/次病程/年痛经评分/分月经量/片子宫体积v/cm3A组3237.9±4.32.2±1.23.1±1.67.1±2.031.46±5.51121.05±12.32B组3338.1±4.72.3±1.43.2±2.47.3±2.230.27±4.85119.34±12.2C组2839.5±4.82.5±1.53.2±2.07.4±2.433.22±4.37122.18±11.54F0.6811.4480.2720.5460.6150.069P0.4960.1490.7860.5850.5390.945
1.2 治疗方法
术前若影像资料提示病灶弥漫、过大暂时不宜行保守性手术的手术,则先予促性腺激素释放激素激动剂(GnRHa)治疗,等条件允许再行手术。保守性手术的手术原则:避免子宫严重损失,同时尽量切除病灶或减少病灶体积、负荷。
1)子宫动脉阻断术:向前举起子宫,暴露阔韧带后叶基底部腹膜,于输尿管外侧分离暴露子宫动脉起始处,以双极电凝1~2 cm,切断。
2)病灶切除术:于子宫壁突起最明显处梭形切开子宫浆肌层,以单极电铲将腺肌瘤或病灶尽量切净,缝合子宫创面。腹腔镜下病灶切净标准:子宫体积基本正常,创面组织弹性较好,肉眼无明显病灶。
3)子宫动脉阻断联合病灶切除术:先行子宫动脉阻断术再行病灶切除术。
患者若合并子宫肌瘤或卵巢巧克力囊肿则同时行子宫肌瘤挖除术或卵巢巧克力囊肿剥除术;合并盆腔子宫内膜异位症、盆腔粘连者则行子宫内膜异位灶电灼及粘连分离术[5-7]。术后规范予患者GnRHa治疗。原则上避孕6个月以上,有生育要求的腺肌病患者,在停药后或恢复月经后积极妊娠。
1.3 观察指标
1.3.1 术后随访指标
6、12、18个月的月经量、子宫体积与疼痛评分。1)月经量:根据手术前后患者每个月经周期使用同种卫生巾片数作为评价标准;2)子宫体积:利用彩色多普勒超声测量子宫体长径、前后径及横径,根据公式[V(cm3)=0.523×长径(cm)×前后径(cm)×横径(cm)]获得子宫体积;3)疼痛评分(包括对术后疼痛及痛经的评估):利用数字评分法(Numeric Rating Scale,NRS)进行疼痛程度评估,NRS法将一条直线平均分为10份,每个点用0到10共11个数字标记,“0”为无痛,“10”为剧痛,重复3次取均值[8]。
1.3.2 生殖预后的影响因素
通过查阅相关文献[3]得到可能影响保守性手术术后生殖预后的7个因素,包括年龄、不孕时间、子宫内膜-肌层交界区(myometrial junctional zone,JZ)厚度、AM类型、合并子宫内膜异位症( endometriosis,EM)、术后规范用药情况、术后接受助孕或辅助生殖技术等,所有患者随访1年以上。根据流行病学疾病特点将患者分为2组(<35岁组、≥35岁组)。子宫内膜-肌层交界区(myometrial junctional zone,JZ)厚度:在治疗(包括保守手术和药物治疗)结束后利用T2加权MRI测量JZ厚度。根据病情发展程度将AM的类型分为:1)单纯的JZ增生(T2加权图像显示8 mm≤JZ<12 mm,年龄≤35岁);2)部分或弥漫性腺肌病(JZ≥12 mm,表现为高信号强度的病灶、侵及肌层);3)腺肌瘤(表现为子宫肌层肿块,MRI示边缘模糊的低信号强度病灶)[3]。术后接受助孕、辅助生殖技术:在保守手术和药物治疗结束后,根据患者的年龄和病情,选择直接助孕或者正常月经开始后的6个月内仍未妊娠,则接受辅助生殖技术。
1.4 统计学处理
2 结果
2.1 3组术后随访指标比较
A、C 2组患者均无妊娠要求,而有妊娠要求的患者均属B组共25例;术后1年内成功怀孕11例(44%)(未被纳入进行长期临床观察),因此B组中有22例临床资料被纳入长期临床观察。与术前相比,3组患者术后各阶段的月经量均明显减少、痛经评分下降、子宫体积明显缩小(P<0.05);3组术后相应指标(月经量、痛经评分、子宫大小)在术后12月均降至最低,随后有上升趋势;术后12个月起C组月经量、痛经评分、子宫大小分别与同期A、B组比较,差异有统计学意义。见表2。


指标评分时间A组(n=32)B组(n=33)C组(n=28)月经量/片术前31.56±5.3130.17±4.7533.12±4.67术后6月10.81±3.05*11.63±2.89*10.62±3.37*术后12月11.91±2.24*12.66±1.73*9.86±2.31*#术后18月13.36±1.58*14.02±1.74*10.27±1.45*#痛经评分/分术前7.2±2.07.5±2.27.4±2.4术后6月2.4±1.5*2.5±1.1*1.8±0.7*术后12月3.2±2.1*3.0±1.7*1.1±0.4*#术后18月3.5±1.1*3.3±1.6*1.4±1.1*#子宫大小/cm3术前121.05±12.32119.34±12.20122.18±11.54术后6月76.72±4.36*72.37±4.80*56.22±4.36*术后12月77.53±6.74*70.02±7.32*55.56±6.33*#术后18月83.33±5.47*78.52±4.15*64.46±8.22*#
*P<0.05与术前相比;#P<0.05与同期A、B组比较。
2.2 各临床因素与保守性术式治疗子宫腺肌病患者生殖预后的关系
年龄<35岁、JZ厚度<10 mm、未合并EM、术后规范用药及接受助孕、辅助生殖技术的患者的1年妊娠率明显升高,差异有统计学意义(P均<0.05);而术后1年内妊娠与未妊娠患者的不孕时间、AM 3种类型比较,差异无统计学意义(P>0.05)。见表3。
表3 各临床因素与生殖预后的关系
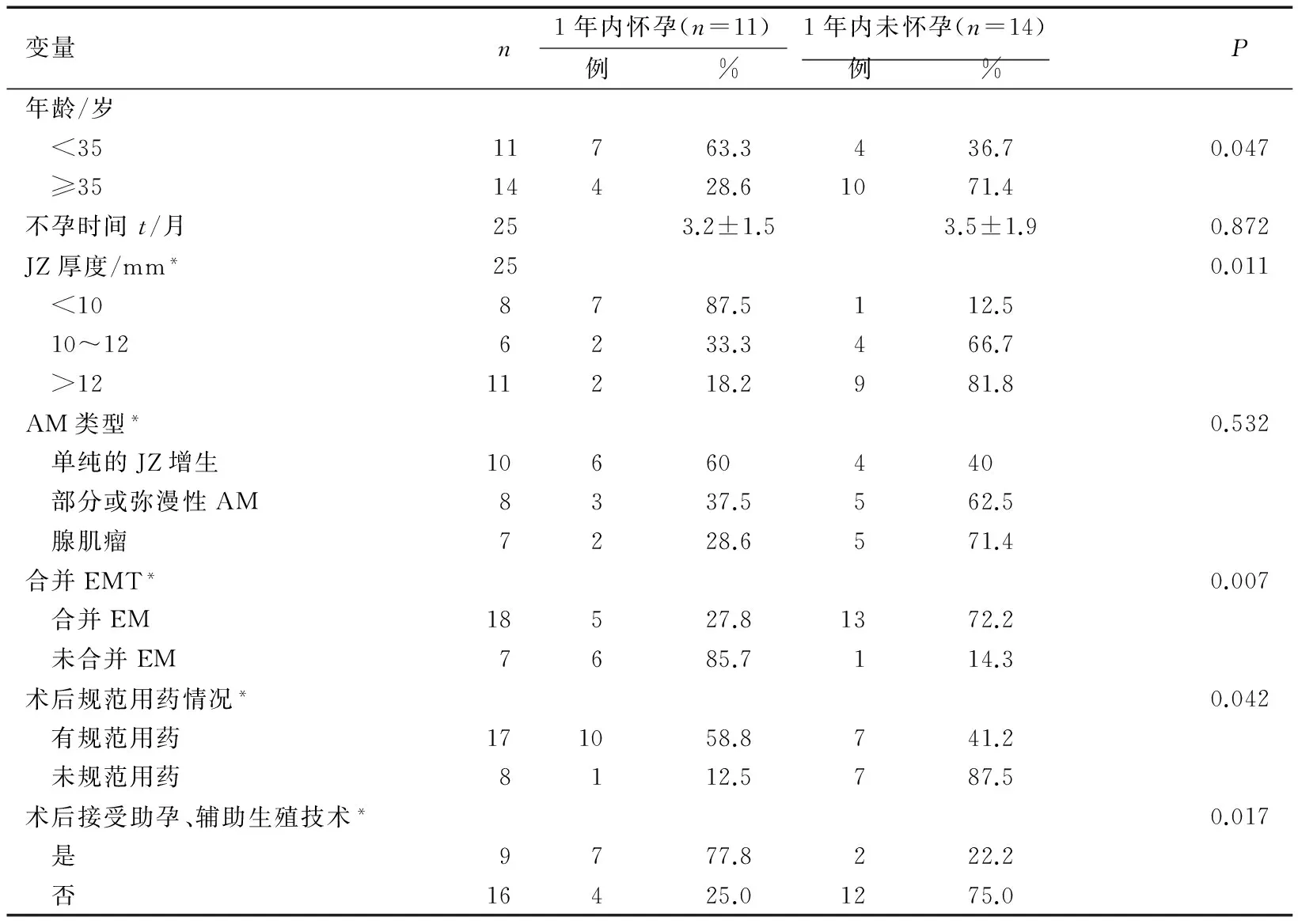
变量n1年内怀孕(n=11)1年内未怀孕(n=14)例%例%P年龄/岁 <3511763.3436.70.047 ≥3514428.61071.4不孕时间t/月253.2±1.53.5±1.90.872JZ厚度/mm*250.011 <108787.5112.5 10~126233.3466.7 >1211218.2981.8AM类型*0.532 单纯的JZ增生10660440 部分或弥漫性AM8337.5562.5 腺肌瘤7228.6571.4合并EMT*0.007 合并EM18527.81372.2 未合并EM7685.7114.3术后规范用药情况*0.042 有规范用药171058.8741.2 未规范用药8112.5787.5术后接受助孕、辅助生殖技术*0.017 是9777.8222.2 否16425.01275.0
*:使用确切概率法。
2.3 多因素分析
以是否怀孕作为应变量(y未怀孕=1,y怀孕=0),将单因素分析有意义的年龄、JZ厚度、合并EM情况、术后规范用药情况及是否接受助孕、辅助生殖技术作为自变量进行多因素非条件Logistic 回归分析。由表4可知,导致1年内未怀孕的独立危险因素包括年龄≥35岁、JZ厚度>12 mm,而当JZ厚度<10 mm、术后常规用药则是保护性因素。年龄:年龄≥35岁导致未怀孕风险是年龄<35岁的2.327倍( 95%CI:1.128~6.865);JZ厚度:以10~12 mm为参照,JZ>12 mm组导致未怀孕的风险是参照组的3.025倍(95%CI:1.328~8.018),JZ<10 mm组导致未怀孕的风险是参照组的0.328倍(95%CI:0.191~0.925);术后规范用药情况:术后规范用药组导致未怀孕的风险是参照组的0.357倍(95%CI:0.124~0.939)。
表4 保守性术式术后影响子宫腺肌病患者生殖预后的Logistic 回归分析

变量βWaldχ2OR95%CIP年龄(≥35岁)0.8455.9752.3271.128~6.8650.032JZ厚度(mm)# <10-1.1153.5580.3280.191~0.9250.001 >121.1076.5443.0251.328~8.0180.014合并EM0.5035.9611.6541.279~5.3120.312术后规范用药-1.034.5450.3570.124~0.9390.031接受助孕、辅助生殖技术-0.7944.8220.4520.145~0.9650.783Constant-2.0877.2180.124-0.001
#:以10~12 mm为参照;-:未测。
3 讨论
1925年,Frankl分离得到腺肌瘤;两年后Sampson描述并定义了子宫内膜异位症,此后AM和EM终被认为是两种不同的疾病,各自存在不同病理学特征及致病机制。近些年,无创影像技术的蓬勃发展为更好了解AM的病理生理改变、进行准确诊治提供了良好的平台。目前,一系列的研究[5,7,9]表明,保守性术式能减轻AM病灶负荷,最大限度保留子宫功能为妊娠争取积极条件,改善AM导致的低生育能力。但该类术式存在的风险却让临床医生踌躇不前。因此,本研究通过观察多种保守性术式治疗AM的积极作用,探讨影响1年内不孕的危险因素,为临床医生选择合适的诊疗、预防措施提供参考。
本研究发现,相比术前,3组患者术后各阶段随访指标明显改善且均于术后12月阶段各随访指标控制得最好; C组在术后12、18月期间各指标均优于同期A、B组;导致1年内未怀孕的独立危险因素包括年龄≥35岁、JZ厚度>12 mm,而当JZ厚度<10 mm、术后常规用药则是保护性因素。对于以上结果,解释如下:1)子宫动脉阻断术、病灶切除术及子宫动脉阻断联合病灶切除术治疗AM的远期疗效均不错,尤其在术后12月,病情的控制良好。2)相比子宫动脉阻断术、病灶切除术,子宫动脉阻断联合病灶切除术的远期效果更好,结果跟彭存旭[5]报道类似。3)年龄一直被认为是影响生殖预后的独立危险因素,本研究的单因素和多因素分析都证明了年龄越大的AM患者怀孕率越低,而Cai等[10]的研究也印证本研究的结果,推测是与卵巢的储备功能有关。4)子宫内膜-肌层交界区的破坏是导致子宫肌层异常蠕动的重要原因,而后者的异常蠕动会严重影响胚胎的种植,最终导致生殖预后不良[6]。JZ厚度是较直观评价子宫内膜-肌层交界区破坏程度的指标,Maubon等[11]的研究显示,当患者的JZ平均厚度>7 mm(正常女性JZ厚度≤5 mm),最大JZ厚度>10 mm时,患者的胚胎着床失败率可高至95.8%,并指出增厚的JZ是生殖预后不良的预测因素,其结论跟本研究结果类似。5)临床中,对AM患者应用最广泛的药物即促性腺激素释放激素激动药(GnRH-a),其可改善患者的妊娠率,其机制[6]可能为:①GnRH-a导致的低雌激素状态可缩小AM患者的子宫体积(尤其肌层体积);②GnRH-a可改善子宫和内膜的容受性,提供胚胎种植的成功率。本研究同样发现,规范用药(即GnRH-a)的患者的妊娠率明显上升(58.8% vs 12.5%),多因素分析显示,规范用药史AM患者1年内怀孕的保护因素,这也印证了以上观点。
综上所述,本研究发现子宫动脉阻断术、病灶切除术及子宫动脉阻断联合病灶切除术治疗AM的远期疗效良好,其中以子宫动脉阻断联合病灶切除术的疗效更佳;年龄≥35岁、JZ厚度>12mm,均可作为预测AM患者术后生殖预后的独立危险因素;而当JZ厚度<10mm、术后常规用药则是保护性因素。基于本研究,建议临床医生可根据AM患者病情、意愿(尤其有生育要求的患者),在制定治疗方案时建议根据具体情况选择合适术式且考虑相关影响因素。
[1] 中华医学会妇产科学分会子宫内膜异位症协作组.子宫内膜异位症的诊断与治疗规范[J].中华妇产科杂志,2007,142(9):645-648.
[2] 李雷,冷金花.子宫腺肌病对生育影响及治疗研究进展[J].中国实用妇科与产科杂志,2012,28(12):953-955.
[3] Campo S,Campo V,Benagiano G.Adenomyosis and infertili-ty[J].Reproductive Biomedicine Online,2012,24(1):35-46.
[4] 冷金花,郎景和.子宫腺肌病的手术治疗[J].实用妇产科杂志,2006,22(1):10-12.
[5] 彭存旭,李景刚,郝贤华,等.腹腔镜下多术式联合治疗子宫腺肌病的临床观察[J].实用妇产科杂志,2014,30(6):475-478.
[6] 石一复,郝敏.子宫内膜异位症诊疗新进展[M].北京:人民军医出版社,2014:290-293.
[7] 张丽君,涂长玉,杨志永,等.腹腔镜下子宫动脉阻断术与促性腺激素释放激素激动剂治疗子宫腺肌病的研究[J].中华临床医师杂志:电子版,2011,9(16):4858-4861.
[8] 冯艺.疼痛分册[M].北京:北京大学医学出版社,2010:9.
[9] Wang P H,Su W H,Sheu B C,et al.Adenomyosis and its variance:adenomyoma and female fertility[J].Taiwan J Obstet Gynecol,2009,48(3):232-238.
[10] Cai Q F,Wan F,Huang R,et al.Factors predicting the cumulative outcome of IVF/ICSI treatment:a multivariable analysis of 2450 patients[J].Hum Reprod,2011,26(9):2532-2540.
[11] Maubon A,Faury A,Kapella M,et al.Uterine junctional zone at magnetic resonance imaging:a predictor of in vitro fertilization implantation failure[J].J Obstet Gynaecol Res,2010,36(3):611-618.
(责任编辑:刘大仁)
Long-Term Clinical Observation of Various Minimal Invasive Conservative Surgical Procedures for Adenomyosis and Analysis of Factors Influencing Postoperative Reproductive Prognosis
XIONG Jia-wei,LI Ling-xiao,JIANG Li
(TheSecondDepartmentofGynecology,GuangxiMaternityHospital,Nanning530002,China)
Objective To explore the long-term effects of various minimal invasive conservative surgical procedures on adenomyosis (AM),and to investigate the factors influencing postoperative reproductive prognosis.Methods Clinical data of 93 patients who were diagnosed with AM and had willingness to retain uterus or requirement for fertility from January 2010 to January 2014 were analyzed retrospectively.These patients were treated with uterine artery occlusion (group A,n=32),lesion resection (group B,n=33),or their combination (group C,n=28).Follow-up indicators were compared among the three groups.Seven potential factors influencing postoperative reproductive prognosis were evaluated by univariate analysis and multivariate logistic regression analysis.Results The menstruation amount,dysmenorrhea score and uterine size significantly reduced after treatment in all the three groups (P<0.05).These indictors reached their lowest levels at postoperative month 12,and then showed an upward trend.Furthermore,these indictors in group C were significantly different from those in group A and group B since postoperative month 12 (P<0.05).Univariate analysis showed that the 1-year pregnancy rate was correlated with age,JZ thickness,EM,standard postoperative medication and assisted reproductive technology (P<0.05).Multivariate logistic regression analysis showed that the independent risk factors included age≥35 years and JZ thickness>12 mm (OR=2.327 andOR=3.025,respectively;P<0.05).However,JZ thickness <10 mm and standard postoperative medication were the protective factors for 1-year pregnancy rate (OR=0.328 andOR=0.357,respectively;P<0.05).Conclusion Both uterine artery occlusion and lesion resection,especially their combination,have long-term curative effects on AM.Multiple factors are correlated with postoperative reproductive prognosis.
adenomyosis; minimal invasive surgery; conservative surgery; reproductive prognosis; influence factors
2015-03-21
熊佳维(1982—),女,在职研究生,主治医师,主要从事妇科宫颈疾病及内分泌的研究。
R737.33
A
1009-8194(2015)12-0047-05
10.13764/j.cnki.lcsy.2015.12.019
