干扰素α通过P204和RAS信号途径诱导大鼠血管平滑肌细胞凋亡*
2015-01-05龙向淑吴强刘太河宋方黄晶田茂波肖燕
龙向淑,吴强,刘太河,宋方,黄晶,田茂波,肖燕
(1.贵州省人民医院心血管内科,贵阳 550002;2.安顺学院数学与计算机科学学院,安顺 561000)
·药物研究·
干扰素α通过P204和RAS信号途径诱导大鼠血管平滑肌细胞凋亡*
龙向淑1,吴强1,刘太河2,宋方1,黄晶1,田茂波1,肖燕1
(1.贵州省人民医院心血管内科,贵阳 550002;2.安顺学院数学与计算机科学学院,安顺 561000)
目的观察干扰素-α(IFN-α)对大鼠血管平滑肌细胞(VSMCs)凋亡的影响,并探讨其部分机制。方法将VSMCs分为A、B、C 3组,A组转染非特异性siRNA,B组予IFN-α干预后转染非特异性siRNA,C组予IFN-α干预后转染IFN诱导蛋白204基因(IFI204) siRNA,均培养至48 h收集细胞。反转录聚合酶链反应(RT-PCR)法检测IFN诱导蛋白204(P204) mRNA表达,Western blot检测P204、RAS蛋白表达及RAF/ERK磷酸化变化,流式细胞仪Annexin-V FITC/PI法检测细胞凋亡。结果与A组比较,B组P204 mRNA和蛋白表达上调(P<0.05),细胞凋亡增多(P<0.05),伴RAS蛋白表达减少(P<0.05),RAF/ERK磷酸化水平下降(P<0.05);C组P204 mRNA及蛋白表达下调(P<0.05),细胞凋亡减少(P<0.05),RAS蛋白表达增多和RAF/ERK磷酸化水平上调(P<0.05)。结论P204及RAS信号途径参与IFN-α诱导大鼠VSMCs凋亡过程的调控。
干扰素;血管平滑肌细胞;干扰素诱导蛋白204;RAS信号途径;凋亡
血管平滑肌细胞(vascular smooth muscle cells,VSMCs)是构成血管壁的主要实质细胞,各种理化刺激导致VSMCs过度增殖及凋亡减少是动脉粥样硬化(atherosclerosis,AS)、高血压(hypertension,HP)及经皮血管成形术(percutaneous transluminal angioplasty,PTA)后再狭窄等血管增殖性疾病(vascular proliferative diseases,VPD)发病的主要机制[1]。干扰素(interferon,IFN)是一组具有抗病毒、免疫调节、抑制细胞增殖及促进细胞凋亡等作用的活性细胞因子家族[2-8]。IFN诱导蛋白204(interferon induction protein 204,P204)是IFN诱导P200家族的鼠类蛋白成员。研究显示,IFN-α可诱导P204表达而抑制大鼠VSMCs及血管外膜成纤维细胞增殖[9-10],但IFN对VSMCs凋亡的影响及其机制尚未完全明确。笔者在本研究中用IFN-α和(或)P204 siRNA处理大鼠原代VSMCs,观察VSMCs凋亡变化并探讨其部分机制,为IFN在VPD领域的应用提供新的依据。
1 材料与方法
1.1 动物 清洁级斯泼累格·多雷(Sprague Dawley,SD)大鼠(雄性2只,雌性1只),约5周龄,体质量120~140 g,第三军医大学实验动物中心提供,实验动物生产许可证号:SCXK(渝)2012-0003。
1.2 试剂 IFN-α(批号:19990034),购自北京三元基因工程有限公司;α平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)单克隆抗体(批号:BM0002)、免疫组化染色试剂盒(批号:SA1021)及二氨基联苯胺(diaminobenzidine,DAB)显色试剂盒(批号:AR1022)购自武汉博士德生物工程有限公司;Annexin V-FITC细胞凋亡检测试剂盒(批号:C1063)和Tubulin抗体(批号:AT819)购自碧云天生物技术研究所;TRNzol 总RNA提取试剂(批号:DP405)、2×Taq PCR MasterMix(批号:KT201)和100 bp DNA Ladder(批号:MD109)购自北京天根生化科技有限公司;反转录聚合酶链反应(reverse transcription polymerase chain reaction,RT-PCR)试剂盒(批号:DRR047A)购自TaKaRa公司;聚合酶链反应polymerase chain reaction,PCR)扩增引物由宝生物工程(大连)有限公司合成,具体序列如下,P204,上游:5′-TCATGGTCCC-AAACAAGTGA-3′,下游:5′-ACCCATTGCACCCAA-AATAA-3′(扩增长度200 bp);GAPDH,上游:5′-ACCACAGTCCATGCCATCAC-3′,下游:5′-TCCACCA-CCCTGTTGCTGTA-3′(扩增长度452 bp);P204抗体(批号:sc-13367)及IFI204 siRNA(批号:sc-40700)购自Santa Cruz公司;RAS(批号:ab108602)、p-RAF(批号:ab78334)及p-ERK 44/42抗体(批号:ab47339)购自Abcam公司。
1.3 主要仪器 sw-cj-1f型超净工作台(吴江市金家坝金太净化设备厂);MCO-20AIC二氧化碳培养箱(日本SANYO Electric 公司);5810R型台式高速冷冻离心机(德国Eppendorf公司);Veriti96孔型梯度PCR仪(美国ABI公司);DU 640型核酸蛋白分析仪(美国Backman公司);FACSCalibur流式细胞仪(美国BD公司);DYY-7C型电泳仪(北京市六一仪器厂);EC3 600型凝胶成像系统(美国UVP公司)。
1.4 细胞培养及实验分组 按文献[11]的方法培养VSMCs。取4~6代细胞用于实验。将VSMCs分为A、B、C 3组,A组未加IFN-α,与B组及C组同步转染非特异性siRNA,B组予IFN-α干预后6 h转染非特异性siRNA,C组予IFN-α干预后6 h转染IFI204 siRNA,IFN终浓度为2×106U·L-1,3组干预后均培养至48 h收集细胞。实验重复3次。
1.5 RT-PCR检测mRNA表达 按Trizol 法提 取细胞总RNA,取总RNA1 μg 按RT-PCR试剂盒说明书反转录合成cDNA,取cDNA产物3 μL进行PCR循环,PCR扩增条件:94 ℃预变性3 min,94 ℃30 s、58 ℃30 s及72 ℃1 min,扩增30个循环,最后72 ℃延伸5 min。取PCR产物5 μL在2%琼脂糖凝胶中电泳分析,电泳结果采用EC3 600型凝胶成像系统扫描成像。
1.6 Western blot 检测蛋白表达 收集干预后的VSMCs于离心管(eppendorf,EP)中,1 000 r·min-1(半径=250 mm)离心5 min、去上清液后加入细胞裂解液,4 ℃冷冻,离心5 min,取上清液另置于预冷、无菌的EP管中,BCA法蛋白定量。取蛋白样品量80 μg于0.2 mL EP管中,加入十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)蛋白上样缓冲液,100 ℃煮沸3 min。用8%SDS-PAGE恒压80~100 V分离蛋白,4 ℃恒流250 mA×90 min转移蛋白至聚偏氟乙烯(poly-vinylidene fluoride,PVDF)膜上。封闭液封闭PVDF膜2 h,去除封闭液,加入按1:500稀释的一抗,4 ℃孵育过夜,聚山梨酯20/TBS溶液(tris-buffered saline and tween 20,TBST)漂洗,加入按1:5 000稀释的辣根过氧化物酶标记的二抗孵育2 h,TBST漂洗。将PVDF蛋白面朝上置于保鲜膜上,取增强化学发光法化学发光试剂A和B按1:1避光混合1 min,将混合液滴加至PVDF膜上,约1 min后去尽残液,固定PVDF膜。X线胶片曝光、显影及定影后扫描,用图像软件根据信号强弱对条带进行灰度分析。
1.7 流式细胞术检测细胞凋亡 按Annexin V-FITC细胞凋亡检测试剂盒C1063说明书操作收集细胞并染色,采用流式细胞仪检测细胞凋亡。
2 结果
2.1 干预因素对P204 mRNA和蛋白表达的影响 与A组比较,B组P204 mRNA和蛋白表达增加(P<0.05),C组P204 mRNA和蛋白表达减少(P<0.05);与B组比较,C组P204 mRNA和蛋白表达减少(P<0.05)。见图1。
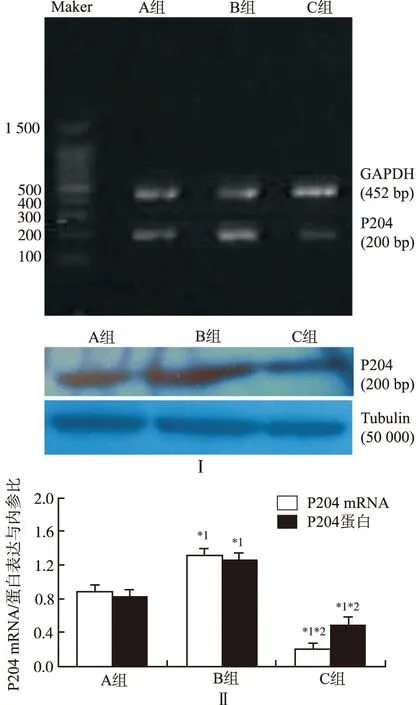
Ⅰ.电泳图;Ⅱ.柱形图;与A组比较,*1P<0.05;与B组比较,*2P<0.05
图1 3组大鼠VSMCs P204 mRNA及蛋白表达的比较(n=3)
Ⅰ.electrophotogram;Ⅱ.histogram;compared with group A,*1P<0.05;compared with group B,*2P<0.05
Fig.1 Comparison of VSMCs P204 mRNA and protein expression of among three groups of rats(n=3)
2.2 干预因素对VSMCs凋亡的影响 与A组比较,B组细胞凋亡增多(P<0.05),C组细胞凋亡减少(P<0.05);与B组比较,C组细胞凋亡减少(P<0.05)。见图2。
2.3 干预因素对RAS蛋白表达和RAF及ERK磷酸化p-RAF及p-ERK水平的影响 与A组比较,B组RAS 蛋白表达减少,RAF及细胞外信号调节激酶(extra-cellular signal-regulated kinase,ERK)磷酸化水平降低(P<0.05),C组RAS 蛋白表达增多,RAF及ERK磷酸化水平升高(P<0.05);与B组比较,C组RAS 蛋白表达增多,RAF及ERK磷酸化水平升高(P<0.05)。见图3。
3 讨论
VSMCs是血管壁的主要实质细胞,炎症、免疫反应及剪切力等因素作用使其异常增殖及凋亡减少是AS、HP及PTA后再狭窄等VPD发生、发展的重要机制。因此,VSMCs作为“参与者”在VPD发病中起关键作用,研究如何有效抑制VSMCs增殖并适当促进其凋亡对防治上述疾病至关重要。
IFN是最早应用于临床的基因工程药物之一,其抗病毒、调节免疫及抗肿瘤作用及其机制已明确[4-6,12-13]。IFN可影响跨膜信号传递、蛋白激酶激活、蛋白磷酸化及细胞基因表达而诱导细胞凋亡[2,7,13]。P204是IFN诱导蛋白P200家族的鼠类蛋白成员,IFN-α可诱导P204表达而抑制大鼠VSMCs增殖及其部分机制已明确[9],但IFN-α对VSMCs凋亡的影响及其机制尚未完全明了。本研究显示,IFN-α干预后P204 mRNA和蛋白表达上调,VSMCs凋亡增多,进一步证实P204表达存在转录和翻译水平的IFN-α诱导性,提示IFN-α可诱导P204表达而促进VSMCs凋亡。IFN-α除通过诱导P204表达而抑制VSMCs增殖外是否尚存在其他机制?RAS信号传导途径是与细胞增殖、凋亡及分化密切相关的信号途径之一。细胞外信号刺激激活RAS,激活型RAS逐级磷酸化活化RAF及MEK,最终活化ERK而产生促进细胞增殖及抑制细胞凋亡等生物学效应。本研究表明,单纯IFN-α干预可诱导P204 mRNA和蛋白表达上调,伴RAS蛋白表达减少,其下游蛋白RAF及ERK磷酸化水平下降,VSMCs凋亡增多;IFN-α干预后再转染IFI204 siRNA,P204 mRNA和蛋白表达下调,RAS蛋白表达增多,RAF及ERK磷酸化水平升高,VSMCs凋亡减少,显示IFI204 siRNA对P204在转录和转录后水平的抑制作用,RAS蛋白表达及其下游信号蛋白RAF及ERK的磷酸化水平与P204呈反向变化趋势,提示RAS信号途径可能参与IFN-α促进VSMCs凋亡过程的调控。

Ⅰ.电泳图;Ⅱ.柱形图;与A组比较,*1P<0.05;与B组比较,*2P<0.05
图3 3组大鼠VSMCs RAS蛋白表达和RAF及ERK磷酸化水平的比较(n=3)
Ⅰ.electrophotogram;Ⅱ.histogram;compared with group A,*1P<0.05;compared with group B,*2P<0.05
Fig.3 Comparison of the expression of RAS protein and the phosphorylation levels of RAF and ERK in VSMCs among three groups of rats(n=3)
综上所述,IFN-α可诱导P204表达而促进VSMCs凋亡,P204及RAS信号途径可能参与IFN-α诱导大鼠VSMCs凋亡过程的调控,但P204与RAS信号途径之间的相互作用机制有待进一步研究。
[1] 李丹,郭小梅.诺考达唑抑制大鼠血管平滑肌细胞增殖的作用及机制[J].医药导报,2014,33(8):1004-1008.
[2] STAWOWCZYK M,VAN S S,KUMAR K P,et al.The in-terferon stimulated gene 54 promotes apoptosis[J].J Biol Chem,2011,286(9):7257-7266.
[3] BEKISZ J,BARON S,BALINSKY C,et al.Antiproliferative properties of type Ⅰ and type Ⅱ interferon[J].Pharmaceuticals(Basel),2010,3(4):994-1015.
[4]ASMANA N R.Human interferon alpha-2b:a therapeutic protein for cancer treatment[J].Scientifica(Cairo),2014,2014:970315.
[5] BU X F,ZHANG J,JIA L J,et al.Effect of human inter-feron-λ1 recombinant adenovirus on a gastric cancer orthotopic transplantation model[J].Exp Ther Med,2014,8(4):1115-1122.
[6] KERUR N,VEETTIL M V,SHARMA-WALIA N,et al.IFI16 act as a nuclear pathogen sensor to induce the inflammasome in response to kaposi sarcoma-associated herpesvirus infection[J].Cell Host Microbe,2011,9(5):363-375.
[7] ZHAO J,WANG M,LI Z,et al. Interferon-α suppresses invasion and enhances cisplatin-mediated apoptosis and autophagy in human osteosarcoma cells[J].Oncol Lett,2014,7(3):827-833.
[8] ZHANG L N,VELICHKO S,VINCELETTE J,et al.Inter-feron-beta attenuates angiotensin Ⅱ-accelerated atherosclerosis and vascular remodeling in apolipoprotein E deficient mice[J].Atherosclerosis,2008,197(1):204-211.
[9] 龙向淑,吴强,宋方.干扰素诱导蛋白P204表达变化对大鼠血管平滑肌细胞增殖及P21表达的影响[J].中国病理生理杂志,2012,28(2):249-252.
[10] 宋方,吴强,潭洪文,等.IFN-α通过P204抑制大鼠主动脉外膜成纤维细胞增殖[J].基础医学与临床,2012,32(12):1431-1436.
[11] 宋方,吴强,陆德琴,等.一套系统培养鼠主动脉血管壁细胞简单可靠的方法[J].中国动脉硬化杂志,2011,19(4):361-366.
[12] CHO H,KELSALL B L.The role of type I interferons in intestinal infection,homeostasis,and inflammation[J].Immunol Rev,2014,260(1):145-167.
[13] BORDEN E C,SEN G C,UZE G,et al.Interferon at age 50:past,current and future impact on biomedicine[J].Nat Rev Drug Discov,2007,6(12):975-990.
Inducement Effect of Interferon Alpha on Apoptosis of Rat Vascular Smooth Muscle Cells via P204 and RAS Signal Pathway
LONG Xiangshu1, WU Qiang1, LIU Taihe2, SONG Fang1, HUANG Jing1, TIAN Maobo1, XIAO Yan1
(1.DepartmentofCardiology,GuizhouProvincialPeople’sHospital,Guiyang550002,China;2.DepartmentofInstituteofMathematicsandComputerScience,AnshunCollege,Anshun561000,China)
Objective To investigate the effect of interferon alpha (IFN-α) on apoptosis of vascular smooth muscle cells (VSMCs) in rats and the related mechanism. Methods The cells were divided into three group: group A, group B and group C.Group A was transfected with nonspecific siRNA, group B was intervened with IFN-α and transfected with nonspecific siRNA, and group C was intervened with IFN-α and transfected with IFI204 siRNA.All the cells were cultured for 48 h.The expression of P204 mRNA was determined by semiquantitative reverse transcription polymerase chain reaction (RT-PCR).P204, RAS protein levels, and phosphorylation levels of RAF and ERK were analyzed by Western blotting.The cell apoptosis was analyzed by flow cytometry with Annexin-V FITC/PI method. Results As compared with group A, the expression of P204 mRNA and protein in group B was up-regulated (P<0.05), the cell apoptosis was increased (P<0.05), in the process of the above, the expression of RAS protein was decreased (P<0.05) and the phosphorylation levels of RAF and ERK were dropped (P<0.05).In group C, the expression levels of P204 mRNA and protein were down-regulated (P<0.05), and cell apoptosis was decreased (P<0.05), the expression of RAS protein and the phosphorylation levels of RAF and ERK were increased (P<0.05). Conclusion P204 and RAS signal pathway participates in IFN-α regulation of apoptosis of VSMCs in rats.
Interferon; Vascular smooth muscle cells; Interferon induction protein 204; RAS signal pathway; Apoptosis
2014-12-15
2015-03-05
*国家自然科学基金资助项目(81260030);贵州省科技攻关项目(黔科合LH字[2014]7023号)
龙向淑(1977-),女,贵州天柱人,主治医师,硕士,主要从事冠心病、心力衰竭发病基础与临床的研究。电话:(0)15285646460,E-mail:928602548@qq.com。
吴强(1969-),男,广东雷州人,主任医师,博士,主要从事冠心病、心力衰竭发病基础与临床防治的研究。电话:(0)13984112269,E-mail:gzgywq@126.com。
R965;R972
A
1004-0781(2015)12-1555-04
10.3870/j.issn.1004-0781.2015.12.002
