理论空燃比天然气汽车尾气中H2O和O2对CH4与NO反应的影响
2015-01-04尚鸿燕任成军龚茂初陈耀强四川大学化学工程学院成都60065四川省中自尾气净化有限公司成都67四川大学化学学院教育部绿色化学与技术重点实验室成都60064
尚鸿燕 胡 伟 王 云 任成军 龚茂初 陈耀强,,*(四川大学化学工程学院,成都60065; 四川省中自尾气净化有限公司,成都67;四川大学化学学院,教育部绿色化学与技术重点实验室,成都60064)
理论空燃比天然气汽车尾气中H2O和O2对CH4与NO反应的影响
尚鸿燕1胡 伟1王 云2任成军3龚茂初3陈耀强1,3,*
(1四川大学化学工程学院,成都610065;2四川省中自尾气净化有限公司,成都611731;3四川大学化学学院,教育部绿色化学与技术重点实验室,成都610064)
共沉淀法制备CeZrYLa+LaAl复合氧化物载体,等体积浸渍法制备了Pt催化剂,用于研究理论空燃比天然气汽车(NGVs)尾气净化反应中CH4与NO的反应规律.并考察了10%(体积分数,φ)H2O和计量比O2对CO2存在时的CH4+NO反应的影响.结果表明:对于不同条件下的NO+CH4反应,主要生成N2和CO2,高温区有CO生成.低温区无O2时可以生成N2O,有O2时可以生成NO2;添加10%(φ)的H2O后,CH4转化活性降低,NO转化活性基本不变,这是由于H2O减弱了CH4与CO2的重整反应,但是对CH4与NO的反应基本没有影响;添加计量比的O2后,CH4转化活性提高,而NO转化活性降低,这是由于O2和NO之间存在竞争吸附,CH4被O2氧化为主要反应,从而减弱了NO的转化;同时添加计量比的O2和10%(φ)H2O,CH4与CO2的重整反应受到抑制, CH4与NO的反应、甲烷蒸汽重整反应和甲烷被O2氧化反应同时发生,CH4和NO的转化活性均提高.
Pt;CeZrYLa+LaAl;尾气组分;CH4对NO的还原;天然气汽车尾气净化
1 引言
天然气的主要成分是CH4,CH4是H/C比值最高的碳氢化合物(HC),因此CH4相比其他HC燃料在燃烧过程中有更少的CO2生成量,1-3并且天然气还具有使用范围广、价格低廉及污染排放少等优点,这使得天然气汽车(NGVs)在全世界范围内广泛使用.NGVs通常有理论空燃比和稀燃两种工作方式,理论空燃比燃烧方式为燃料与计量空气混合;稀燃方式为空气过量.对于理论空燃比NGVs,其主要污染排放物为CH4、NOx和CO.其中,CH4是一种具有强温室效应的气体,由于CH4是最为稳定的HC化合物之一,其转化和活化困难,表现在CH4的自身氧化反应比一般HC化合物反应难度大;同时CH4和NO的反应也比其他HC与NO的反应困难得多,这导致NO的转化难度大,而NO对人类及环境带来严重的危害.为了满足日益严格的汽车尾气排放标准,装备具有同时转化CH4、CO和NO的尾气处理催化剂必不可少.
理论空燃比NGVs催化剂主要借鉴汽油车的三效催化剂(TWC),一般采用CeO2改性的Al2O3为载体,Pt、Pd或Rh等贵金属为活性组分.1,4,5在本课题组过去的研究中,所制备CeO2-ZrO2-Al2O3、CeO2-ZrO2-MxOy(M=Y,La)/Al2O3及CeO2-ZrO2-Y2O3-La2O3+ La2O3-Al2O3等材料在汽油车及NGVs尾气净化催化剂中体现了优异的性能.6-8而且研究发现,在稀燃和理论空燃比条件下,Pd对CH4完全氧化的活性高于Rh或者Pt;9在富燃还原性条件下,Pt的活性略高于Pd.10
理论空燃比NGVs尾气净化催化剂上进行的主要反应有CH4氧化,CO氧化和NO还原(包括CH4对NO的还原和CO对NO的还原).由于CH4和NO的反应比其他HC与NO的反应困难得多而备受关注.11-14Burch和Ramli15报道了Pt、Pd和Rh催化剂上CH4对NO的还原反应,发现NO和CH4的反应与气体组成和温度有关,不同催化剂的反应活性与催化剂可被CH4还原的程度相关,这是由于NO转化生成N2主要发生在还原表面活性位上,这些活性位可能是金属单质原子,如Pt,也可能是氧空缺,如Pd和Rh,并且在Pt和Pd催化剂上可以生成N2O.对于Pt/ Al2O3和Pt/SiO2催化剂上的NO与CH4反应,NO的还原与NO的分压相关,而与CH4关系不大,对于NO/O2/CH4反应,NO转化率随O2含量增加先升高后降低,表明O2存在时的NO还原存在一个最佳的表面氧物种和碳氢化合物的覆盖量.16Ohtsuka等17研究了水蒸气和SO2存在条件下的CH4与NO反应,所制备的Pt-Pd催化剂具有优异的耐久性.实际上理论空燃比NGVs尾气中除了CH4、CO和NO外,还存在化学计量比的氧气,10%(体积分数,φ)的水蒸气和12%(φ)的CO2气体等,并且这些组分对尾气转化反应具有重要的影响作用.由于CH4和NO的反应是理论空比尾气净化的主要反应,尾气中O2和H2O对该反应的影响作用关系到催化剂的性能.研究O2和H2O对CO2存在条件下的CH4+NO反应的影响,对尾气净化反应过程的分析和操作条件的控制将会有指导意义.
本文以共沉淀法制备结合储氧材料和耐高温氧化铝材料两者优点的70%(质量分数,w) Ce45Zr45Y5La5+30%(w)La3Al97纳米复合材料为载体,在该材料上负载Pt活性组分制备了Pt催化剂,用于研究理论空燃比NGVs尾气中O2和H2O对大量CO2存在条件下的CH4与NO反应活性的影响.
2 实验部分
2.1 载体的制备
按配比称取Ce(NO3)3·6H2O(化学纯,四川乐山五通桥东风化工厂),ZrO(NO3)2·6H2O(化学纯,江苏宜兴新兴锆业公司),Y(NO3)3·6H2O(化学纯,山东淄博市吉利浮选厂),La(NO3)3·6H2O(化学纯,成都科龙化学试剂厂)配成浓度为10%(w)的混合盐溶液,使用NH3·H2O(分析纯,成都露橙化工试剂厂)作沉淀剂进行滴定,得到沉淀物;同样按配比称取La(NO3)3·6H2O(化学纯,成都科龙化学试剂厂)和Al(NO3)3·9H2O(化学纯,山东淄博市吉利浮选厂)配成浓度为10%的混合盐溶液,使用NH3·H2O(分析纯,成都露橙化工试剂厂)作沉淀剂进行滴定,得到沉淀物.并将两沉淀物通过剧烈搅拌混合.将所得沉淀混合物进行陈化、过滤、洗涤和干燥后,在800°C焙烧3 h,即制得CeO2-ZrO2-Y2O3-La2O3+La2O3-Al2O3样品,记为CeZrYLa+LaAl.其中CeZrYLa占70% (w),LaAl含量为30%(w).在CeZrYLa中CeO2和ZrO2含量均为45%(w),Y2O3和La2O3含量均为5% (w);在LaAl中,La2O3和Al2O3含量分别为3%(w)和97%(w).
2.2 催化剂的制备
采用等体积浸渍法,在上述制备的载体上,浸渍Pt(NO3)2(分析纯,成都光明光电信息股份公司)溶液.然后在120°C干燥,550°C焙烧3 h,得到Pt/ CeZrYLa+LaAl催化剂粉末,贵金属含量为1.2% (w);所得催化剂粉末加去离子水混合球磨制浆,涂覆在堇青石蜂窝基体(体积2.5 cm3,高2.7 cm)上,涂覆量180 g·L-1,涂层中贵金属Pt含量2.14 g·L-1.经120°C干燥后,550°C焙烧3 h,即得整体式催化剂,记为Pt.
2.3 催化活性评价
活性测试在自组装的一套专用多路固定床连续流动微型反应器中进行,各路气体分别用质量流量计控制流速,在进入反应器之前混合均匀.气体的体积空速均为34000 h-1.评价所用反应气CH4、NO、H2O、CO2的体积分数分别为0.087%、0.074%、10%、12%,O2含量可调(调节理论空燃比条件),并以N2为平衡气.反应前后的CH4使用上海科创色谱仪器有限公司生产的GC9800型气相色谱仪进行检测,NO与CO用佛分环保仪器检测设备制造有限公司FGA-4100型汽车排气分析仪进行检测.
3 结果与讨论
3.1 CO2存在时各反应条件下CH4与NO的转化活性
图1给出了O2与H2O对Pt催化剂上不同反应活性的影响结果.从图中可以看出,(i)对于CH4+NO+ CO2反应,Pt催化剂的CH4转化T50(起燃温度:污染物转化50%时温度)和T90(完全转化温度:污染物转化90%时温度)分别为445和490°C,NO转化T50和T90分别为286和297°C;(ii)添加10%(φ)H2O后, CH4活性明显下降,NO转化活性基本不变.说明H2O减弱了CH4与CO2的重整反应,而对CH4和NO的反应基本没有影响;(iii)添加计量比的O2后,CH4转化活性明显提高,NO转化活性远低于无O2(CH4+ NO+CO2和CH4+NO+H2O+CO2)条件,说明O2的出现会存在甲烷被O2氧化反应与甲烷被NO氧化反应的竞争,甲烷被O2氧化反应优先进行,减弱了甲烷与NO的反应使得NO转化活性低于无O2条件,这与文献18报道一致;(iv)同时添加计量比O2和10%(φ) H2O后,460°C以下CH4转化率提高,这是由于O2和H2O同时存在时,Pt催化剂上放热的甲烷被O2氧化反应和强吸热的甲烷水蒸气重整反应同时发生,反应体系本身实现了自供热,在较低的反应温度下达到较高的甲烷转化率.19同时NO转化活性得到明显提高,这是由于Pt催化剂上甲烷蒸汽重整反应产生H2,促进催化剂三效性能,从而对NO转化有利.5接下来我们针对图1的实验结果对各反应条件下的CH4与NO反应进行详细地分析.

图1 O2与H2O对Pt催化剂上不同反应活性的影响Fig.1 Effects of O2and H2O on the activities of Pt-based catalyst for different reactions
3.2 无氧无水时CH4+NO+CO2的反应
从图1可以看出,Pt催化剂对于CH4和NO分别在490和297°C达到完全转化,此条件下污染物转化过程中可能发生的反应有:20,21
CH4与NO以1:3反应

CH4与NO以1:4反应
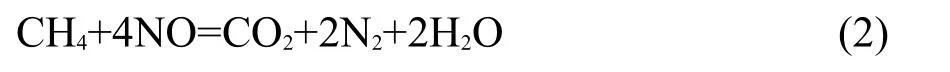
CH4与NO以1:8反应

CH4与CO2重整反应

体系中多余的CO2与H2反应

由CH4和NO的化学反应式(1)-(3)的化学计量比可以发现,同一温度下NO的转化率与CH4转化率之比值R应处于:3≤R≤8.反应(4)会造成R<3.
表1给出了不同温度条件下各反应的NO/CH4转化率比值及尾气中CO含量,其中,COa是活性测试反应器出口处检测到的CO含量,COb是假设高温区所有转化的NO和CH4均按着方程(1)进行反应能够生成的CO含量.从表中可以看出:对于CH4+ NO+CO2反应,在体系温度处于520-440°C时,R<3,这说明有反应(4)发生使得R<3,尾气中CO生成量大于0.11%高达0.23%,如此高的CO生成量远大于体系中全部的CH4(0.087%(φ))与NO(0.074%(φ))以反应(1)生成的CO含量,也大于全部的CH4以反应(4)生成的CO量,说明高温区还存在逆水汽变换反应(5).此时NO的转化主要依靠CH4与NO的反应(但是不能确定以(1)-(3)哪种途径反应);在体系温度T≤420°C时,3<R<8,尾气中CO生成量远小于高温区,说明随着温度降低反应(4)和(5)减少.温度越低R越接近8,说明低温时反应(3)逐渐增多,生成了N2O.为了验证低温区生成了N2O,我们对该反应前后的NOx(NO、N2O和NO2)使用ANTARIS IGS在线分析仪进行检测,结果显示整个温度范围内只生成极少量的NO2,温度较低时逐渐生成了N2O,并且随着温度降低N2O选择性提高.这与文献15报道的CH4与NO反应中N2O主要在400°C以下生成一致.

表1 不同温度条件下各反应的NO/CH4转化率比值及尾气中CO含量Table 1 Ratios of NO to CH4consumed and the CO yields for all reactions at different temperatures
为了确定不同温度段CH4与NO以何种途径反应,我们测试了Pt催化剂上没有CO2存在时的CH4+ NO反应,并与CO2存在时的CH4+NO反应进行对比,结果示于图2.无CO2存在时CH4+NO反应的NO/CH4转化率比值R和尾气中CO含量结果列于表1.图2中,没有CO2存在时的CH4+NO反应,CH4转化活性低于有CO2存在时的活性,NO活性基本不变.这是由于没有反应(4)的发生造成的.从表1可以看出,CH4+NO反应在520-500°C之间时,R<3, COa>COb,说明CH4除了发生反应(1)以外还可能发生了少量的CH4与载体储氧材料的反应或者CH4在催化剂上的裂解,使得R<3;480°C时,R<3,COa<COb,除了反应(1)还可能发生了CH4在催化剂上的裂解反应使得R<3;460-400°C之间,3<R<4,COa远小于COb,说明主要发生反应(2),只存在少量的反应(1);400-300°C之间,4<R<8,体系中没有CO生成,说明主要发生反应(2)和(3),而且随着温度降低,R接近8,说明低温主要发生反应(3),生成了N2O.ANTARIS IGS在线分析仪测试结果也证明低温生成了N2O,并且随温度降低N2O选择性提高.N2O的产生是由于该条件下CH4转化率极低,催化剂表面存在NOads和Nads物种,N2O可以通过简单的Nads+ NOads反应途径生成的.16
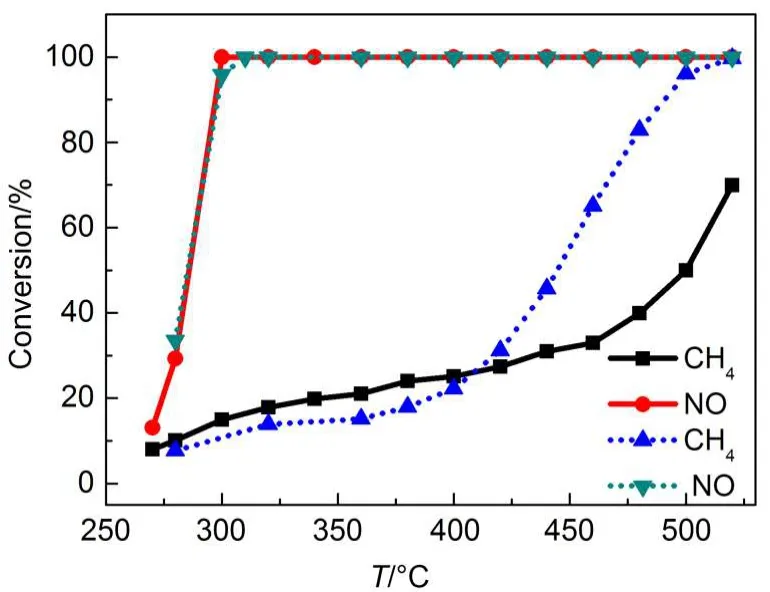
图2 CO2对Pt催化剂上CH4+NO反应活性的影响Fig.2 Effect of CO2on the activity of Pt-based catalyst for CH4+NO reaction
3.3 10%(φ)H2O对CH4+NO+CO2反应的影响
从图1可以看出,添加H2O后,Pt催化剂上CH4在520°C达到最大转化率79%,NO在304°C完全转化,相比无H2O条件,CH4转化率在360°C以上出现明显下降,而NO转化率不变,说明水蒸气对CH4与NO的反应影响不大,但是减弱或者抑制了CH4与CO2的重整反应(4)和逆水汽变换反应(5),从而降低了CH4转化率.此条件下污染物转化过程中在上述五个反应基础上还可能发生蒸汽重整反应:

不同温度条件下CH4+NO+H2O+CO2反应的NO/CH4转化率比值及尾气中的CO含量列于表1.从表中可以看出:尾气中COa远低于上述CH4+NO+ CO2反应的CO生成量,说明添加H2O减弱或抑制了反应(4)和(5).在520-480°C之间:R<3,COa>COb,可见除了发生反应(1)之外,还发生了CH4与CO2的重整反应(4)和/或者CH4与H2O的重整反应(6)生成了CO.此时不能确定反应(4)和(6)哪个反应为主,根据文献22报道CH4与CO2的重整反应远慢于CH4与H2O的重整反应,表明此时可能主要发生反应(6); 460°C时,3<R<4,COa<COb,说明同时发生反应(1)和(2),并以(2)为主;420-290°C之间,4<R≤8.26,尾气中没有CO生成,说明发生反应(2)和(3),随着温度降低,R增大,更多的反应以途径(3)进行,生成了N2O.ANTARIS IGS在线分析仪测试结果也证明低温生成了N2O,并且随温度降低N2O选择性提高.
3.4 计量比的O2对CH4+NO+CO2反应的影响
从图1可以看出有氧条件下Pt催化剂对于CH4和NO分别在439和425°C达到完全转化.此条件下污染物转化过程中还可能发生以下反应:

相比无O2条件,NO转化活性明显降低,说明O2出现后体系中存在甲烷被O2氧化和甲烷被NO氧化的竞争,甲烷被O2氧化优先发生,18使得CH4转化活性迅速提高,NO转化活性低于无O2条件.
不同温度条件下CH4+NO+O2+CO2反应的NO/ CH4转化率比值及尾气中的CO含量列于表1.从表中可以看出:O2的添加使得尾气中COa生成量相比CH4+NO+H2O+CO2条件进一步降低.在整个温度范围内,R值都小于3,说明除了CH4与NO的反应外,在整个温度范围内CH4主要发生了氧化反应(7)使得R<3.在520-440°C之间,COa与COb基本一致,不能确定是反应(1)还是反应(4)生成的;420°C时, COa<COb,说明反应(1)或(4)减弱,CH4和NO以途径(2)反应增多;400-340°C之间,尾气中没有CO生成,R值比高温区增大,但是仍然小于3,有反应(2)的发生.但是不能根据R值判断有没有反应(3)和(8)的发生.使用ANTARIS IGS在线分析仪检测反应前后的NOx(NO、N2O和NO2),结果发现,整个温度范围内有极少量的N2O生成,在低温时逐渐检测到NO2,随着温度降低NO2选择性提高.说明低温时CH4转化率降低,没有足够的CH4将NO还原,从而发生了反应(8)生成了NO2.
3.5 10%(φ)H2O和计量比的O2同时存在对CH4+ NO+CO2反应的影响
此时反应体系存在CH4、NO、H2O、O2和CO2,污染物转化过程中上述的8个反应都可能发生.从图1也可以看出H2O和O2同时存在时Pt催化剂对于CH4和NO分别在416和395°C达到完全转化,CH4的转化活性优于上述各条件.这可能由于O2和H2O同时存在时,Pt催化剂上放热的甲烷氧化反应和强吸热的甲烷水蒸气重整反应同时发生,反应体系本身实现了自供热,在较低的反应温度下达到较高的甲烷转化率.19对于NO的转化活性,虽低于无O2条件(CH4+NO+CO2和CH4+NO+H2O+CO2),但是高于CH4+NO+O2+CO2条件的NO活性,这可能是由于蒸汽重整反应产生H2,H2作为还原剂提高了NO的转化,从而提高催化剂的三效性能.5不同温度条件下CH4+NO+H2O+O2+CO2反应的NO/CH4转化率比值及尾气中的CO含量列于表1.从表1可以看出,只有少部分温度下检测到0.01%的CO,大部分温度下没有检测到CO,说明O2和H2O同时存在抑制了反应(4)和(5).我们知道只发生CH4与NO的反应时3≤R≤8,然而在O2和H2O同时存在条件下R值在整个温度范围内均小于3且大部分在1左右.说明此条件下主要反应为氧化反应(7)和蒸汽重整反应(6)(蒸汽重整反应中产生的CO也可以进一步发生氧化或通过水汽变换反应除去).NO的转化主要依靠CH4与NO以1:4反应(2)进行,可能有CH4与NO以1:3反应生成CO,但CO进一步会发生氧化反应或通过水汽变换反应除去.ANTARIS IGS在线分析仪检测结果显示,低温区有NO2生成,证明低温CH4转化率较低时,NO可被O2氧化生成NO2.
为了进一步证明H2O和O2同时存在条件下有蒸汽重整反应(6)的发生,对H2O和O2同时存在时不同温度下的CH4相应转化率下所需氧原子含量(记为A)、NO相应转化率下提供的氧原子含量(记为B)及原始气提供的氧原子含量(记为C),进行了计算并列于表2.
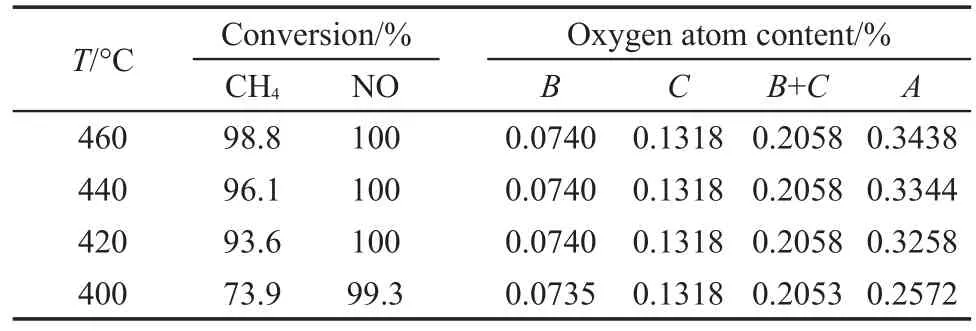
表2 不同温度下各氧含量结果Table 2 Oxygen atom contents at different temperatures
原始反应气组成为0.087%(φ)CH4+0.074%(φ) NO,从CH4氧化反应方程CH4+2O2=CO2+2H2O可以看出,1 mol CH4需要4 mol氧原子,而1 mol NO提供1 mol氧原子.从表2结果可以看出,各温度条件下对应NO转化率所提供的氧与原始气所提供的氧原子含量之和均小于相应CH4转化率下所需要的氧原子含量,说明有H2O参与反应,提供了氧原子,从而证明H2O和O2同时存在条件下,有蒸汽重整反应的发生.
4 结论
各条件下的CH4与NO反应高温时存在以CH4: NO摩尔比1:3反应生成CO和N2;中温区以摩尔比1:4反应生成N2和CO2;低温区,无氧时有N2O生成,有氧时NO被氧化生成NO2.
有CO2存在条件下的CH4+NO反应,大量CH4发生CO2与CH4的重整反应;添加10%(φ)H2O,减弱CO2与CH4的重整反应;添加计量比O2,主要发生CH4被O2氧化反应,降低了NO转化率,CO2与CH4的重整反应受到抑制;同时添加计量比O2和10%(φ) H2O,CH4被O2氧化、蒸汽重整、CH4与NO反应同时发生,Pt催化剂上CH4与NO转化活性均提高.
(1) Bounechada,D.;Groppi,G.;Forzatti,P.;Kallinen,K.; Kinnunen,T.Appl.Catal.B:Environ.2012,119,91.
(2) Xia,W.S.;Chang,G.;Hou,Y.H.;Weng,W.Z.;Wan,H.L. Acta Phys.-Chim.Sin.2011,27,1567.[夏文生,常 刚,侯玉慧,翁维正,万惠霖.物理化学学报,2011,27,1567.]doi: 10.3866/PKU.WHXB20110627
(3) Li,C.L.;Chen,W.;Yuan,J.;Shangguan,W.F.Acta Phys.-Chim.Sin.2012,28,450.[李曹龙,陈 威,袁 坚,上官文峰.物理化学学报,2012,28,450.]doi:10.3866/PKU. WHXB201112141
(4) Klingstedt,F.;Neyestanaki,A.K.;Byggningsbacka,R.; Lindfors,L.E.;Lundén,M.;Petersson,M.;Tengström,P.; Ollonqvist,T.;Väyrynen,J.Appl.Catal.A:Gen.2001,209, 301.doi:10.1016/S0926-860X(00)00768-7
(5) Salaün,M.;Kouakou,A.;Da Costa,S.;Da Costa,P.Appl. Catal.B:Environ.2009,88,386.doi:10.1016/j. apcatb.2008.10.026
(6) Lan,L.;Chen,S.H.;Zhao,M.;Gong,M.C.;Chen,Y.Q. J.Mol.Catal.A:Chem.2014,394,10.doi:10.1016/j. molcata.2014.06.032
(7) Yuan,S.H.;Wang,Y.J.;Shi,Z.H.;Zhao,M.;Gong,M.C.; Liu,Z.C.;Chen,Q.Z.;Chen,Y.Q.Chin.J.Catal.2007,28, 401.[袁书华,王永军,史忠华,赵 明,龚茂初,刘忠长,陈启章,陈耀强.催化学报,2007,28,401.]doi:10.1016/S1872-2067 (07)60036-9
(8) Guo,J.X.;Shi,Z.H.;Wu,D.D.;Yin,H.Q.;Gong,M.C.; Chen,Y.Q.Appl.Surf.Sci.2013,273,527.doi:10.1016/j. apsusc.2013.02.074
(9) Oh,S.H.;Mitchell,P.J.;Siewert,R.M.J.Catal.1991,132, 287.doi:10.1016/0021-9517(91)90149-X
(10) Burch,R.;Loader,P.K.Appl.Catal.B:Environ.1994,5,149. doi:10.1016/0926-3373(94)00037-9
(11) Descorme,C.;Gélin,P.;Lécuyer,C.;Primet,M.J.Catal.1998, 177,352.doi:10.1006/jcat.1998.2112
(12) Marques,R.;Kabouss,K.E.;Da Costa,P.;Da Costa,S.; Delacroix,F.;Djéga-Mariadassou,G.Catal.Today 2007,119,166.doi:10.1016/j.cattod.2006.08.019
(13) Ozkan,U.S.;Kumthekar,M.W.;Karakas,G.Catal.Today 1998,40,3.doi:10.1016/S0920-5861(97)00112-0
(14) Li,B.;Wang,H.;Ding,F.C.;Li,C.Q.;Song,Y.J.;Ke,M.; Ren,C.T.Acta Phys.-Chim.Sin.2013,29,1289.[李 滨,王 虹,丁福臣,李翠清,宋永吉,柯 明,任翠涛.物理化学学报,2013,29,1289.]doi:10.3866/PKU.WHXB201304162
(15) Burch,R.;Ramli,A.Appl.Catal.B:Environ.1998,15,49.doi: 10.1016/S0926-3373(97)00036-2
(16) Burch,R.;Ramli,A.Appl.Catal.B:Environ.1998,15,63.doi: 10.1016/S0926-3373(97)00037-4
(17) Ohtsuka,H.;Tabata,T.;Hirano,T.Appl.Catal.B:Environ. 2000,28,L73.
(18) Fang,H.;Cai,L.;Liu,P.;Zhao,M.;Zhang,L.J.;Gong,M.C.; Chen,Y.Q.Acta Phys.-Chim.Sin.2006,22,1004.[房 华,蔡 黎,刘 萍,赵 明,张丽娟,龚茂初,陈耀强.物理化学学报,2006,22,1004.]doi:10.3866/PKU.WHXB20060819
(19) Cai,X.L.Catalyst forAutothermal Reforming of Methane to Produce Hydrogen.Ph.D.Dissertation,South China University of Technology,Guangzhou,2007.[蔡秀兰.甲烷、氧气和水蒸气自热重整制氢催化剂的研究[D].广州:华南理工大学, 2007.]
(20) Subramanian,S.;Kudla,R.J.;Chattha,M.S.Ind.Eng.Chem. Res.1992,31,2460.doi:10.1021/ie00011a009
(21) Gao,J.;Hou,Z.Y.;Lou,H.;Zheng,X.M.Fuel Cells: Technologies for Fuel Processing,1st ed.;Elsevier Science: Amsterdam,2011;pp 191-221.
(22) Grenoble,D.C.;Estadt,M.M.;Ollis,D.F.J.Catal.1981,67, 90.doi:10.1016/0021-9517(81)90263-3
Effects of H2O and O2on the Reaction of NO Reduction by CH4under Stoichiometric Natural Gas Vehicles
SHANG Hong-Yan1HU Wei1WANG Yun2REN Cheng-Jun3GONG Mao-Chu3CHEN Yao-Qiang1,3,*
(1College of Chemical Engineering,Sichuan University,Chengdu 610065,P.R.China;2Sichuan Zhongzi Exhaust Gas Cleaning Co.,Ltd.,Chengdu 611731,P.R.China;3Key Laboratory of Green Chemistry&Technology, Ministry of Education,College of Chemistry,Sichuan University,Chengdu 610064,P.R.China)
Composite support CeZrYLa+LaAl was prepared by co-precipitation,and platinum catalyst supported on the composite support was prepared by impregnation.The behavior of the Pt catalyst for the reaction of NO reduction by CH4from the exhausts of natural gas vehicles(NGVs)was studied under stoichiometric conditions.Additionally,the effects of 10%(volume fraction,φ)H2O and stoichiometric O2on the reaction in the presence of CO2were also investigated.Results show that N2and CO2were the main products for the different reactions,CO was detected under high temperature,and NOxwas detected under low temperature(in the presence of O2,the NOxwas NO2,whereas the NOxwas N2O when no O2was present).In the presence of 10%(φ)H2O,the conversion of CH4noticeably decreased and NO conversion remained unchanged,possibly because the presence of H2O weakens the reforming reaction of CH4with CO2,but does not affect the activity of NO reduction by CH4.In the presence of stoichiometric O2,there was an obvious increase of CH4conversion and a decrease of NO conversion.These could be explained by the competition between NO and O2,where the oxidation of methane by O2is the main reaction,limiting the reaction of NOreduction by CH4.Moreover,in the presence of 10%(φ)H2O and stoichiometric O2,CO2reforming of CH4was negligible.Numerous reactions were detected simultaneously,such as the oxidation of CH4by NO,steam reforming of CH4,and the reduction of NO by CH4,thus improving the conversions of CH4and NO.©Editorial office ofActa Physico-Chimica Sinica
Pt;CeZrYLa+LaAl;Gas composition;Reduction of NO by CH4; Natural gas vehicle exhaust purification
O643
10.3866/PKU.WHXB201502051www.whxb.pku.edu.cn
Received:November 2,2014;Revised:February 4,2015;Published on Web:February 5,2015.
∗Corresponding author.Email:nic7501@scu.edu.cn;Tel:+86-28-85418451.
The project was supported by the National Natural Science Foundation of China(21173153),Project from Sichuan Provincial Environment Office,
China(2011HB002),and Science and Technology Support Project of Science and Technology Department of Sichuan Province,China(2012FZ0008).
国家自然科学基金(21173153),四川省环境保护厅项目(2011HB002)及四川省科技厅科技支撑项目(2012FZ0008)资助
