重组乳酸乳球菌的异常毒性评价
2015-01-04曲晓军王金英夏海华孙建华沙长青
曲晓军, 王金英, 夏海华, 原 韬, 于 冲, 孙建华,沙长青
(1.黑龙江省科学院微生物研究所,黑龙江哈尔滨 150010;2.黑龙江省科学院高技术研究院,黑龙江哈尔滨 150020;3.黑龙江省科学院,黑龙江哈尔滨 150001)
重组乳酸乳球菌的异常毒性评价
曲晓军1,2, 王金英1,2, 夏海华1,2, 原 韬1,2, 于 冲1,2, 孙建华1,2,沙长青2,3*
(1.黑龙江省科学院微生物研究所,黑龙江哈尔滨 150010;2.黑龙江省科学院高技术研究院,黑龙江哈尔滨 150020;3.黑龙江省科学院,黑龙江哈尔滨 150001)
[目的] 评价重组乳酸乳球菌的异常毒性,为其制备黏膜免疫活载体疫苗及免疫型微生态制剂提供理论支持。 [方法]给小白鼠腹腔注射不同剂量的表达金黄色葡萄球菌纤黏蛋白原凝集素A(ClfA)的重组乳酸乳球菌MG1363/pMG36c-clfA菌液,评价重组乳酸乳球菌的异常毒性。[结果]注射高、中、低剂量重组乳酸乳球菌液的各组小白鼠7 d内无一死亡,体重增长正常。[结论]重组乳酸乳球菌对机体未见异常毒性,适合制备黏膜免疫基因工程活载体疫苗和免疫型微生态制剂。
重组乳酸乳球菌;异常毒性;腹腔注射
乳酸菌是一大类可发酵碳水化合物产生乳酸的革兰氏阳性细菌,其对人体和动物无致病性,被公认为是安全级别的有益微生物[1]。研究表明,乳酸菌具有提升机体免疫能力、抑制肿瘤、抑制肠道中致病菌生长、预防和治疗各类腹泻以及合成维生素等功效[2-7]。
乳酸菌包括乳酸球菌、乳酸杆菌、双歧杆菌、肠球菌等二十几个属[8]。乳酸乳球菌(Lactococcuslactis)属于乳酸菌的典型菌种,是其模式菌[9],为兼性厌氧的革兰氏阳性球菌,是乳品发酵工业的重要菌株,在医药工程及食品领域具有非常重要的应用前景[10]。乳酸乳球菌可耐受胃肠道低pH、蛋白酶及高胆盐等恶劣条件,在人体内存活2~3 d,其不攻击肠道黏膜,不会引起机体较强的免疫反应[11]。近年来,随着基因工程和分子生物学技术的飞速发展,乳酸乳球菌分子生物学及作用机制方面的研究也取得了重要进展,乳酸乳球菌完整基因组已经完成了测序工作[8],这为乳酸乳球菌基因工程技术的发展和表达系统的构建奠定了重要基础。因此,一系列基因表达载体和受体系统也相继建立起来[12],以乳酸乳球菌为载体表达外源蛋白已成为生物制药和疫苗研究的热点[13]。
金黄色葡萄球菌(Staphylococcusaureus)是一类重要的条件致病菌,能引起人体表皮感染、化脓性关节炎、心内膜炎等[14-15],美国每年因被金黄色葡萄球菌感染而丧生的人数已超过死于艾滋病人数[16]。同时,金黄色葡萄球菌也是国内外最常见的细菌性食物中毒病原之一,由其引起的食物中毒占细菌性食物中毒的33%[17-18]。在畜禽感染方面, 金黄色葡萄球菌可引起奶牛乳房炎、猪羊皮炎和流产、羔羊败血病、马创伤性感染、脓肿、蜂窝织炎、鸡的坏疽性皮炎、败血病等疾病,造成了巨大的经济损失[19]。
金黄色葡萄球菌对机体的感染首先需要黏附到宿主组织表面,然后释放出各种毒素及酶,对机体造成伤害。而实现黏附目的的组分位于金黄色葡萄球菌表面,称之为黏附素(adhesin)。黏附素是一类蛋白质,包括纤黏蛋白原凝集素A、B(Fibrinogen-binding proteins clumping factor A and B,ClfA,CIfB)、纤黏蛋白A、B(fibronectin-binding proteins A and B,FnBPA,FnBPB)、胶原结合蛋白(collagen-binding protein, Can)和A蛋白(protein A)等[20]。ClfA是金黄色葡萄球菌重要的黏附素之一,编码ClfA的基因clfA,在迄今为止所有临床分离的金黄色葡萄球菌中都存在,因此,以黏附素ClfA为靶位进行疫苗研制是预防和治疗金黄色葡萄球菌感染的有效选择[19]。
笔者以评价前期构建的表达金黄色葡萄球菌黏附素ClfA的重组乳酸乳球菌MG1363/pMG36c-clfA菌株的异常毒性为目的,为下一步制备基因工程黏膜免疫活载体疫苗、新型免疫型微生态制剂奠定基础。
1 材料与方法
1.1 材料
1.1.1试验动物。ICR系清洁级小白鼠,雌性,18~22 g,购自黑龙江省中医药大学实验动物中心,共计40只,分为4组,每组10只。
1.1.2菌株。重组乳酸乳球菌(MG1363/pMG36c-clfA)由黑龙江省科学院微生物研究所应用医学微生物研究室构建。
1.1.3培养基。MRS肉汤培养基,购自广东环凯微生物科技有限公司。
1.1.4主要仪器设备。独立送风隔离笼具,超净工作台,细菌麦氏比浊仪,恒温培养箱。
1.2 方法
1.2.1重组乳酸乳球菌增菌培养。将重组乳酸乳球菌(MG1363/pMG36c-clfA)接种于MRS肉汤培养基中,30 ℃静止培养28 h。
1.2.2重组乳酸乳球菌标准浓度菌液制备。将重组乳酸乳球菌培养物4 ℃、4 000 r/min离心20 min,收集沉淀,用100 ml 0.9% 氯化钠注射液洗涤3次,沉淀溶于50 ml 0.9% 氯化钠注射液中,用细菌麦氏比浊仪精确校正菌液浓度4.0×104、2.0×107、1.0×108CFU/ml(以0.9% 氯化钠注射液为标准空白溶液)。
1.2.3异常毒性试验。随机将40只小鼠分为4组,即对照组、高剂量组、中剂量组、低剂量组,每组10只,每只小鼠试验前编号、标记、称重。高剂量组给1.0×108CFU/ml重组乳酸乳球菌氯化钠混悬液0.5 ml,中剂量组给2.0×107CFU/ml重组乳酸乳球菌氯化钠混悬液0.5 ml,低剂量组给4.0×104CFU/ml重组乳酸乳球菌氯化钠混悬液0.5 ml,对照组给0.9%氯化钠注射液0.5 ml,全部试验组均一次性腹腔注射给药,观察给药后0~7 d小鼠的存活及健康情况,7 d 后试验结束,每只小鼠称重,记录结果。
1.3 数据处理试验数据用简明统计软件计算,以平均值±标准差表示。
2 结果与分析
小鼠腹腔注射给药后,对照组及高、中、低剂量组小鼠全部健存,皮肤、毛色和活动均无异常反应,7 d 后,每只小鼠体重均较给药前增加,高、中、低剂量组小鼠体重增加量和增加率与对照组小鼠相比无显著性差异(表1)。
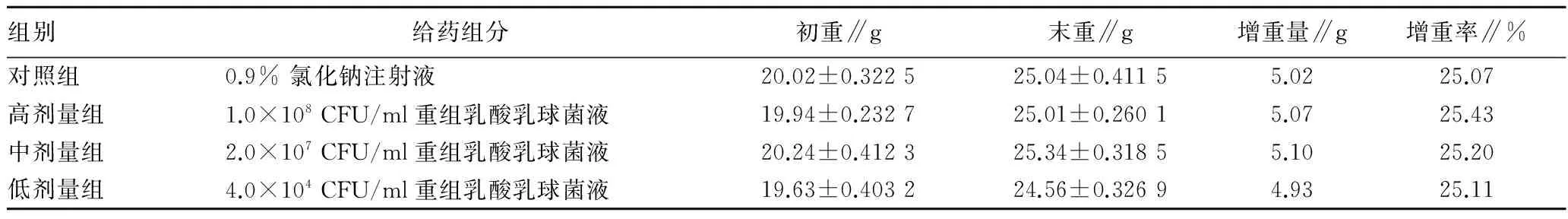
表1 重组乳酸乳球菌异常毒性对小鼠体重的影响
3 讨论
疫苗以技术水平划分,可分为第一代完整病原体疫苗(减毒的活疫苗及灭活疫苗)、第二代分子技术亚单位疫苗和第三代基因工程疫苗[19]。部分第一代、第二代疫苗免疫效果不明显,且在激发机体免疫反应之前有降解的可能性,使其应用受到了限制[21-24]。目前,第三代基因工程疫苗是疫苗研发中的重点,而黏膜免疫活载体疫苗作为基因工程疫苗中非常重要的一类,由于其可在黏膜表面接种激发作为机体第一道屏障的黏膜免疫以阻止病原微生物的入侵,故成为基因工程疫苗研发中的热点[25]。
目前活载体疫苗研究最多的是致弱病原菌载体,如分枝杆菌(mycobacteria)[26]、沙门氏菌(salmonlla)[27]。但因其仍可能保持侵袭性和毒性,对儿童、老人及部分免疫缺陷者有潜在的危险,此外,过强的免疫应答会降低后继疫苗的效力,因此,其在应用上受到了限制。
利用乳酸乳球菌作为抗原递呈载体能够克服上述缺陷。乳酸乳球菌是安全级的微生物,在基因工程活载体疫苗的研发上具有很多天然的优势:首先,它不是人和动物肠道内固有菌,不会在肠道内定居,免疫原性小,不会造成免疫麻痹,可重复免疫;其次,乳酸乳球菌自身携带多种成分可参与免疫修饰,可作为佐剂激活机体的免疫系统,激发体液及细胞免疫;第三,乳酸乳球菌分泌蛋白较少,且不分泌胞外蛋白酶,因此,表达的外源蛋白易于纯化且能保持天然的活性;最后,乳酸乳球菌易于驯化,相关表达系统的构建技术比较成熟[28]。
该研究对前期构建的表达金黄色葡萄球菌纤黏蛋白原凝集素A(ClfA)的重组乳酸乳球菌MG1363/pMG36c-clfA菌株进行异常毒性的评价研究。该研究设置了高、中、低剂量组,分别腹腔注射1.0×108、2.0×107、4.0×104CFU/ml重组乳酸乳球菌氯化钠混悬液0.5 ml,相当于人体每天建议用量的2 500、500和1倍。结果表明,重组乳酸乳球菌MG1363/pMG36c-clfA菌株对动物体无明显可见的异常毒性作用。重组乳酸乳球菌在制备基因工程活载体疫苗和新型免疫型微生态制剂方面具有十分广阔的应用前景。
[1] 杨洁彬,郭兴华,张篪,等.乳酸菌:生物学基础及应用[M].北京:中国轻工业出版社,1996.
[2] SEEHOFER D,RAYES N,SCHILLER R,et al.Probiotics partly reverse increased bacterial translocation after simultaneous liver resection and colonic anastomosis in rats[J].J Surg Res,2004,117(2):262-271.
[3] D’SOUZA A,RAJKUMAR C,COOK J,et al.Probiotics in prevention of antibiotic associated diarrhoea:Meta-analysis[J].BMJ,2002,324(7350):1361-1366.
[4] SINGH J,RIVENSON A,TOMITA M,et al.Bifidobacterium longum,a lactic acid-producing intestinal bacterium inhibits colon cancer and modulates the intermediate biomarkers of colon carcinogenesis[J].Carcinogenesis,1997,18(4):833-841.
[5] RIED K.Gastrointestinal health.The role of pro-and pre-biotics in standard foods[J].Aust Fam Physician,2004,33(4):253-255.
[6] WANG M F,LIN H C,WANG Y Y,et al.Treatment of perennial allergic rhinitis with lactic acid bacteria[J].Pediatr Allergy Immunol,2004,15(2):152-158.
[7] POUWELS P H,LEER R J,SHAW M,et al.Lacticacidbacteriaas antigen delivery vehicles for oral immunization purposes[J].Int J Food Microbiol,1998,41(2):155-167.
[8] 凌代文,东秀珠.乳酸菌分类鉴定及实验方法[M].北京:中国轻工业出版社,1999.
[9] NOUAILL S,RIBEIRO L A,MIYOSHI A,et al.Heterologous protein production and delivery systems forLactococcuslactis[J].Genet Mol Res,2003,2(1):102-111.[10] GASSON M J.In vivo genetic systems in lactic acid bacteria[J].FEMS Microbiol Rev,1990,7:43-60.
[11] WU X,LEE W,TRAN L,et al.Engineering aBacillussubtilisexpression-secretion system with a strain deficient in six extracellular proteases[J].J Bacteriol,1991,173(16):4952-4958.
[12] 向华,谭华荣,刘敬忠.乳酸乳球菌基因表达载体系统的研究[J].微生物学通报,1998,25(4):230-232.
[13] 曲晓军,沙长青,李思明,等.重组乳酸乳球菌的应用进展[J].黑龙江科学,2013,4(4):34-36.
[14] FOWLER V G JR,MIRO J M,HOEN B,et al.Staphylococcusaureusendocarditis: A consequence of medical progress [J].Journal of the American medical association, 2005,293(24):3012-3021.
[15] VAN BELKUM A,VERKAIK N J,DE VOGEL C P,et al.Reclassification ofStaphylococcusaureusnasal carriage types [J].Journal of infectious diseases, 2009, 199(12):1820-1826.
[16] 严淑娴(译).耐甲氧西林葡萄球菌可能比HIV杀死更多的美国人[J].英国医学杂志:中文版(BMJ),2008(1):32.
[17] LEIR Y,BARON F,GAUTIER M.Staphylococcus o2-reus and food poisoning[J].Genet Mol Res,2003,2(1):63-76.
[18] 邓泽静,李毅,洪程基,等.食品中金黄色葡萄球菌污染状况及其毒素检测[J].浙江预防医学,2011,23(2):92-96.
[19] 曲晓军,王金英,孙建华,等.奶牛乳房炎金黄色葡萄球菌疫苗研究概况和未来发展趋势[J].黑龙江科学,2012,3(8):34-38.
[20] FITZGERALD J R,HARTIGAN P J.Molecular population and virulence factor analysis ofStaphylococcusaureusfrom bovine intramammary infection [J].Journal of appllied microbiology, 2000,88:1028-1035.
[21] FLOCK J.Extracellular-matrix-binding proteins as targets for the prevention ofStaphylococcusaureusinfections[J].Mol Med Today,1999,5(12):532-537.
[22] 章锐锋,王选锭.金黄色葡萄球菌疫苗的研究进展[J].国外医学(微生物学分册),2003,26(4):23-24.
[23] NORDHAUG M L,NESSE L L,NORCROSS N L,et al.A field trial with an experimental vaccine againstStaphylococcusaureusmastitis in cattle.1. Clinical parameters[J].J Dairy Sci,1994,77:1267-1275.
[24] NORDHAUG M L,NESSE L L,NORCROSS N L,et al.A field trial with an experimental vaccine againstStaphylococcusaureusmastitis in cattle.2.Antibody response[J].J Dairy Sci,1994,77:1276-1284.
[25] ERIKSSOIN K,HOLMGREN J.Recent advances in mueosal vaccines and adjuvants[J].Curr Opin Immunol,2002,14:666-672.
[26] STOVER C K,DE LA CRUZ J F,LEE M H.New use of BCG for recombinant vaccines[J].Nature, 1991,351:456-460.
[27] CHATFIELD S N,DOUGAN G,ROBERTS M.Progress in the development of multivalent oral vaccines based on live attenuated Salmonella[M].New York: Plenum Press,1994:32-34.
[28] SZOSTAK M P,HENSEL A,EKO F.Bacterial ghosts:Non-living candidate vaccines[J].Biotechnol,1996,44:161-170.
Abnormal Toxicity Evaluation of RecombinantLactococcuslactis
QU Xiao-jun1,2,WANG Jin-ying1,2,XIA Hai-hua1,2,SHA Chang-qing2,3*
(1.Institute of Microbiology,Heilongjiang Academy of Sciences, Harbin,Heilongjiang 150010;2.High Tech Research Institute,Heilongjiang Academy of Sciences, Harbin,Heilongjiang 150020;3. Heilongjiang Academy of Sciences, Harbin, Heilongjing 150001)
[Objective]The aim was to evaluate abnormal toxicity of recombinantLactococcuslactis.,and provide theoretical support for its application in the mucosal immune vaccine and immune micro ecological preparation.[Method] The mice were intraperitoneally injected with different doses of recombinantLactococcuslactisMG1363/pMG36c-clfA strain with expressing fibrinogen lectin A ofStaphylococcusaureusto evaluate its abnormal toxicity.[Result] The results showed that, injection of high, medium and low dose recombinantLactococcuslactisfluid of mice within 7 d, increased weight was normal without a death. [Conclusion] RecombinantLactococcuslactishad no abnormal toxicity to the organism and it was suitable for the preparation of mucosal immune gene engineering live vector vaccine and immune micro ecological preparation.
RecombinantLactococcuslactis; Abnormal toxicity; Intraperitoneal injection
黑龙江省院所基本应用技术研究专项(CZ13BQXJ06)。
曲晓军(1973- ),男,黑龙江哈尔滨人,高级工程师,硕士,从事微生物药物学研究。*通讯作者,研究员,硕士,从事微生物学研究。
2015-08-13
S 188
A
0517-6611(2015)28-022-02
