同位素内标法测定饲料中氢溴酸常山酮
——超高效液相色谱-串联质谱法
2015-01-04王丽娜田晓玲
王丽娜,王 姝,田晓玲,刘 凯
(1.辽宁省兽药饲料畜产品质量安全检测中心,辽宁 沈阳 110016;2.辽宁省食品药品监督管理局行政服务中心,辽宁 沈阳 110016)
同位素内标法测定饲料中氢溴酸常山酮
——超高效液相色谱-串联质谱法
王丽娜1,王 姝2,田晓玲1,刘 凯1
(1.辽宁省兽药饲料畜产品质量安全检测中心,辽宁 沈阳 110016;2.辽宁省食品药品监督管理局行政服务中心,辽宁 沈阳 110016)
本研究建立了饲料中氢溴酸常山酮的UPLC-MS/MS分析方法。样品经乙腈提取,离心后经正己烷除脂净化,氮气吹干后,50%甲醇溶液复溶,UPLC-MS/MS分析。结果表明,氢溴酸常山酮在20.0~500.0μg/L浓度范围内线性关系良好,r2=0.999 1。以浓缩饲料、配合饲料、预混料为添加基质,其回收率在60%~120%,检出限为25.0 μg/kg,定量限为50.0μg/kg。结论显示,本方法灵敏度高,专属性好,操作简单,结果可靠,可满足饲料中氢溴酸常山酮的分析检测。
氢溴酸常山酮;饲料;UPLC-MS/MS
氢溴酸常山酮是由一种植物常山(Dichroa fabrifuga)中获得的喹唑酮类物质,常山酮为较新型的广谱抗球虫药。在国内氢溴酸常山酮被允许以3 mg/kg的浓度添加到饲料里,休药期为4 d。目前,检测氢溴酸常山酮的方法主要采用液相色谱法、液相色谱-质谱法[1],目前关于检测饲料中氢溴酸常山酮残留量的报道较少。本文采用超高效液相色谱-串联质谱法测定饲料中氢溴酸常山酮含量能够克服背景干扰,提高信噪比,能够准确定性和定量
1 材料与方法
1.1 仪器与试剂
1.1.1 仪器 Waters ACQUITY UPLC-TQ Detector超高效液相色谱串联质谱仪、氮吹仪(Heros RS-2)、高速离心机(Biofuge STRATOS Centri fuge),Mi ll iQ超纯水器(美国Mil l ipore公司)。
1.1.2 对照品 氢溴酸常山酮、氢溴酸常山酮-13C6(对照品均来源于Adlershof GmbH公司),纯度≥95.0%。
1.1.3 对照品溶液的配制 分别精密称取氢溴酸常山酮、氢溴酸常山酮-13C6对照品,以50%乙腈水溶液为溶剂配成浓度各约1 mg/mL标准储备液,2~8℃冷藏保存。准确吸取适量上述标准储备液,用50%乙腈水溶液稀释成浓度为1μg/mL对照品中间液。
1.1.4 试剂 乙腈(色谱纯);正己烷(分析纯);甲酸(色谱纯,纯度为99%);甲醇(色谱纯)。试验用水均为超纯水。
1.2 样品前处理 称取饲料样品2 g(准确至0.01 g)于50 mL离心管中,加入1μg/mL内标工作液100μL(应明确内标工作液的配制方法及浓度),加入乙腈20 mL,涡旋60 s,10 000 r/min离心5 min,上清液转移至另一离心管中。加入5 m正己烷,涡旋30 s,10 000 r/min离心5 min。弃去上层,下层溶液50℃氮气吹干。2 mL 50%甲醇溶液溶解后,加入5 mL正己烷,涡旋30 s,10 00 r/min离心5 min。弃去上层,下层过0.22μm滤膜过滤,上机测定。
1.3 色谱-质谱条件
1.3.1 色谱条件 C18100 mm×2.1 mm,粒径1. μm。或其他效果等同的C18柱;柱温40℃,流动相流速为0.3 mL/min,流动相:A:甲醇;B:0.1%甲酸水溶液;梯度洗脱程序:0~1 min,维持5%A,1~3 min A线性变化至95%,3.5~5 min,维持5%A。
1.3.2 质谱条件 电喷雾正离子扫描(ESI+),毛细管电压3.0 KV,离子源温度120℃,脱溶剂气温度350℃,脱溶剂气流速650 L/h,锥孔锥孔气流速50 L/h,碰撞气为高纯氩气,光电倍增管电压650 V。采用MRM多反应监测方式,母离子(Q1)/子离子(Q3)离子对见表1。
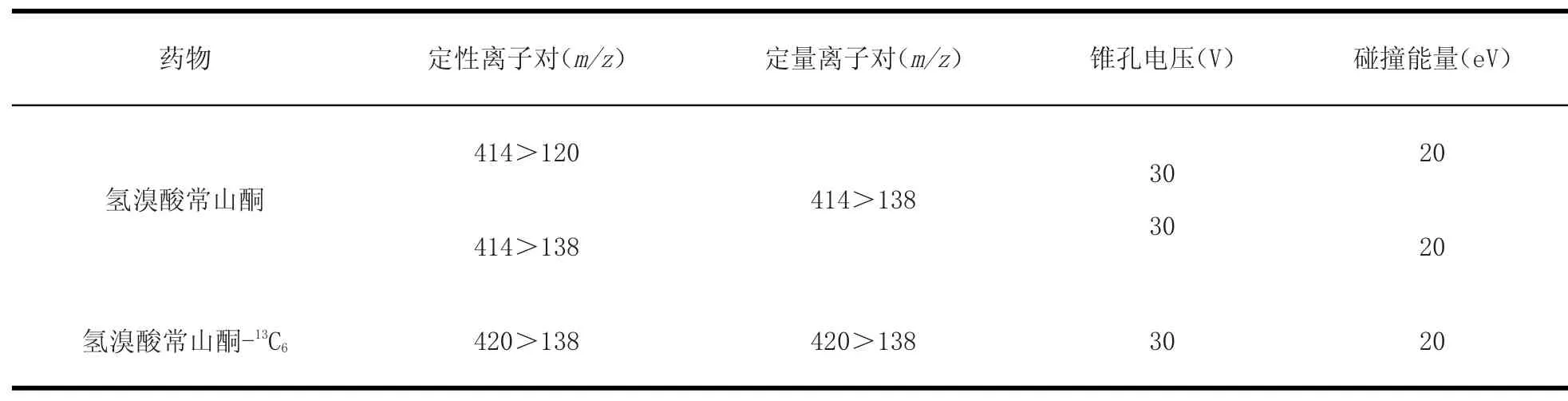
表1 目标化合物的UPLC-MS/MS检测条件Tab le1 UPLC-MS/MS acquisition param eters for target com pounds
2 结果与分析
2.1 母离子和子离子的选择 以甲醇和0.1%甲酸水溶液为流动相[2],采用MS-Scan模式进行全扫描,确定母离子质量数,优化母离子使其获得较高的丰度。选定母离子后再采用Daughter-Scan方式对其子离子进行扫描,通过优化碰撞能量选择两个丰度较高的子离子作为定性和定量离子。利巴韦林药物的离子对、锥孔电压及碰撞能量的优化参数见表1。
根据欧盟2002/657/EC要求,确证利巴韦林至少需要4个识别点(IP),分别选择了母离子以及对应的2个响应较强的子离子作为定性定量依据,这样1个母离子1个IP点,对应2个子离子分别1.5个IP点,达到了4个IP点,很好地满足了欧盟有关法规的要求。
2.2 液相色谱优化条件的选择 氢溴酸常山酮中等极性,容易在反相C18色谱柱上保留[3]。以甲醇和0.1%甲酸水溶液作流动相,在流速为0.3 mL/min的条件下,根据实验室条件选用Waters BEH C18、Wa ters HSS T3、Agilent SB-Aq色谱柱,其测得的结果是,氢溴酸常山酮在Agi lent SB-Aq色谱柱中的保留性差,保留时间短。在Waters BEH C18和Waters HSS T3色谱柱中保留性好,能够有效避免药物在死时间出峰,保留时间理想。流动相以0.1%甲酸水为强洗溶剂,以甲醇为弱洗溶剂[4],减少水相可缩短保留时间,但甲醇可提高质谱检测的灵敏度。在流动相中加入甲酸可以提高被检测药物的离子化效率,提高灵敏度。故试验选择1.3.1为试验液相条件。
2.3 样品前处理条件的确定 氢溴酸常山酮药物的提取剂在参考相关文献的基础上选择使用甲醇、乙腈2种提取液的提取效果[5],根据添加50μg/kg的样品回收结果,表明乙腈为提取溶剂时提取回收率高,杂质干扰小。
2.4 线性方程、检出限和定量限 分别精密量取适量1μg/mL的氢溴酸常山酮及内标溶液,制得浓度为20、50、100、200、500 ng/mL系列对照溶液供高效液相色谱-串联质谱法测定。以对照品和内标物色谱峰面积的比值为纵坐标,对照溶液浓度为横坐标,绘制标准曲线。曲线方程见表2。

表2 目标化合物的线性方程、相关系数、检出限和定量限Tab le2 Calibration curves,corre lation coefficient、LOD and LOQ o f target com pounds
2.5 方法的灵敏度 空白试料按相同的步骤处理后,测定结果表明:在相应的保留时间,空白试料对所测分析物无干扰。

图1 配合饲料定量限图谱Fig.1 Chromatogram s o f ribavirin spiked at the leve l of LOQ in feeds
检测限(LOD)与定量限(LOQ):添加适量混合标准溶液于2g空白样品中,经提取净化后测定,根据所测药物的S/N>3(按PtP算)计算氢溴酸常山酮在配合饲料、浓缩饲料、预混合饲料中检出限为25μg/kg,S/N>10(按PtP算)计算氢溴酸常山酮在配合饲料、浓缩饲料、预混合饲料中定量限50μg/kg,见图1~3。

图2 浓缩料定量限图谱Fig.2 Chromatograms of ribavirin spiked at the level of LOQ in concentrated feeds

图3 预混合饲料定量限图谱Fig.3 Chrom atogram s of Halofuginone spiked at the leve l of LOD in Pre-m ixed feeds feeds
20μg/L标准溶液在MRM监测模式下的选择离子流图,见图4。

图4 20μg/m L氢溴酸常山酮对照品溶液图谱Fig.4 Chrom atogram s of 20μg/m L Halofuginone standards so lution
2.6 方法回收率和精密度考察 由于氢溴酸常山酮在产蛋期饲料中禁止使用,作为药物饲料添加剂用量为3 mg/kg。采用标准添加法,在空白饲料中(产蛋期)添加浓度50~250μg/kg,在普通饲料中添加浓度为1.5~6 mg/kg的水平范围内进行回收率试验,各浓度5个样品平行试验,平均回收率为60.0%~120%,批内批间RSD值均<20%。计算结果见表3~8。
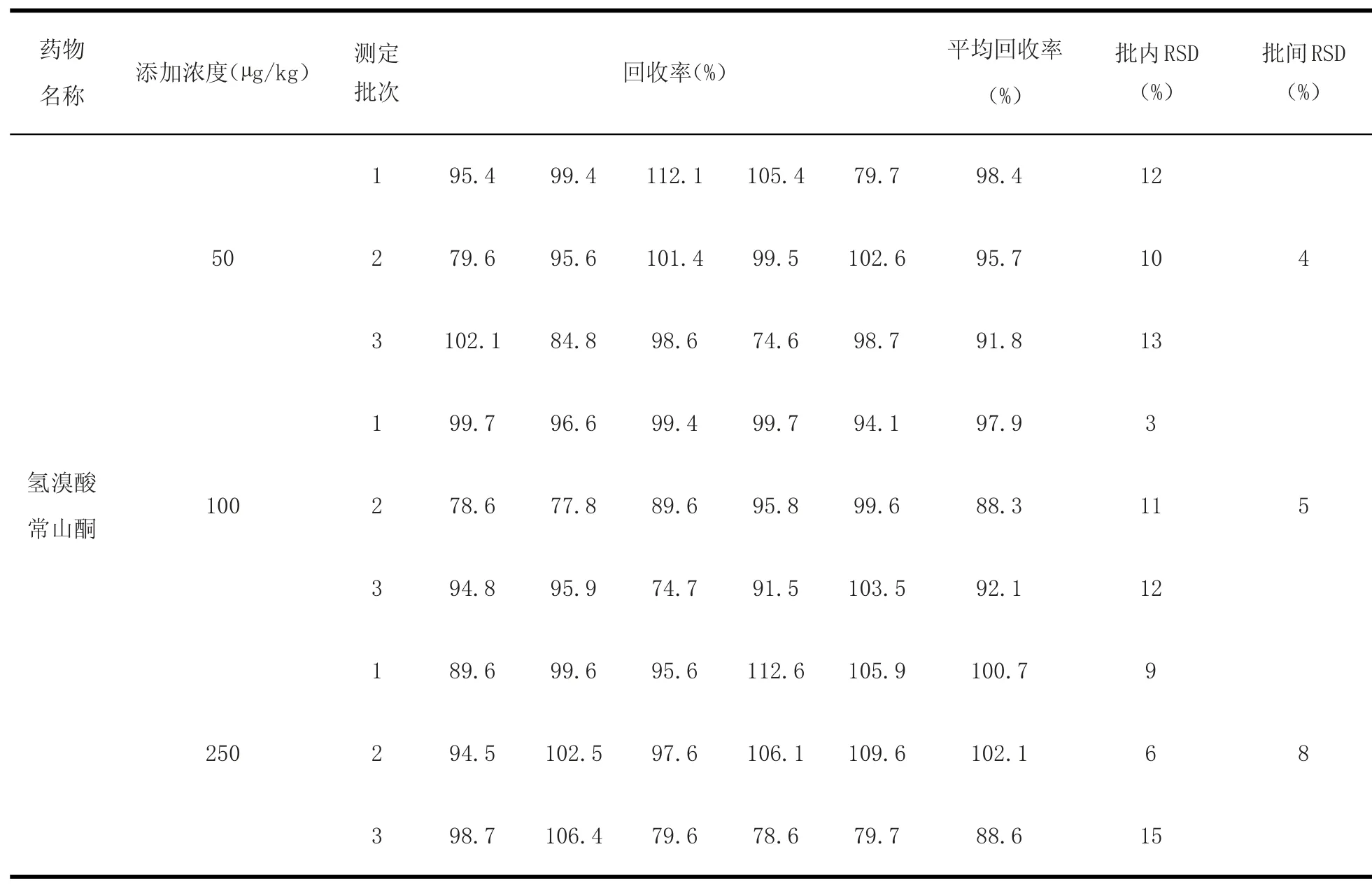
表3 空白预混合饲料(产蛋期)中添加药物后得到的回收率及批内批间RSDTable3 Results o f recovery experim ents and RSD in Pre-m ixed feeds(egg laying period)(n=5)
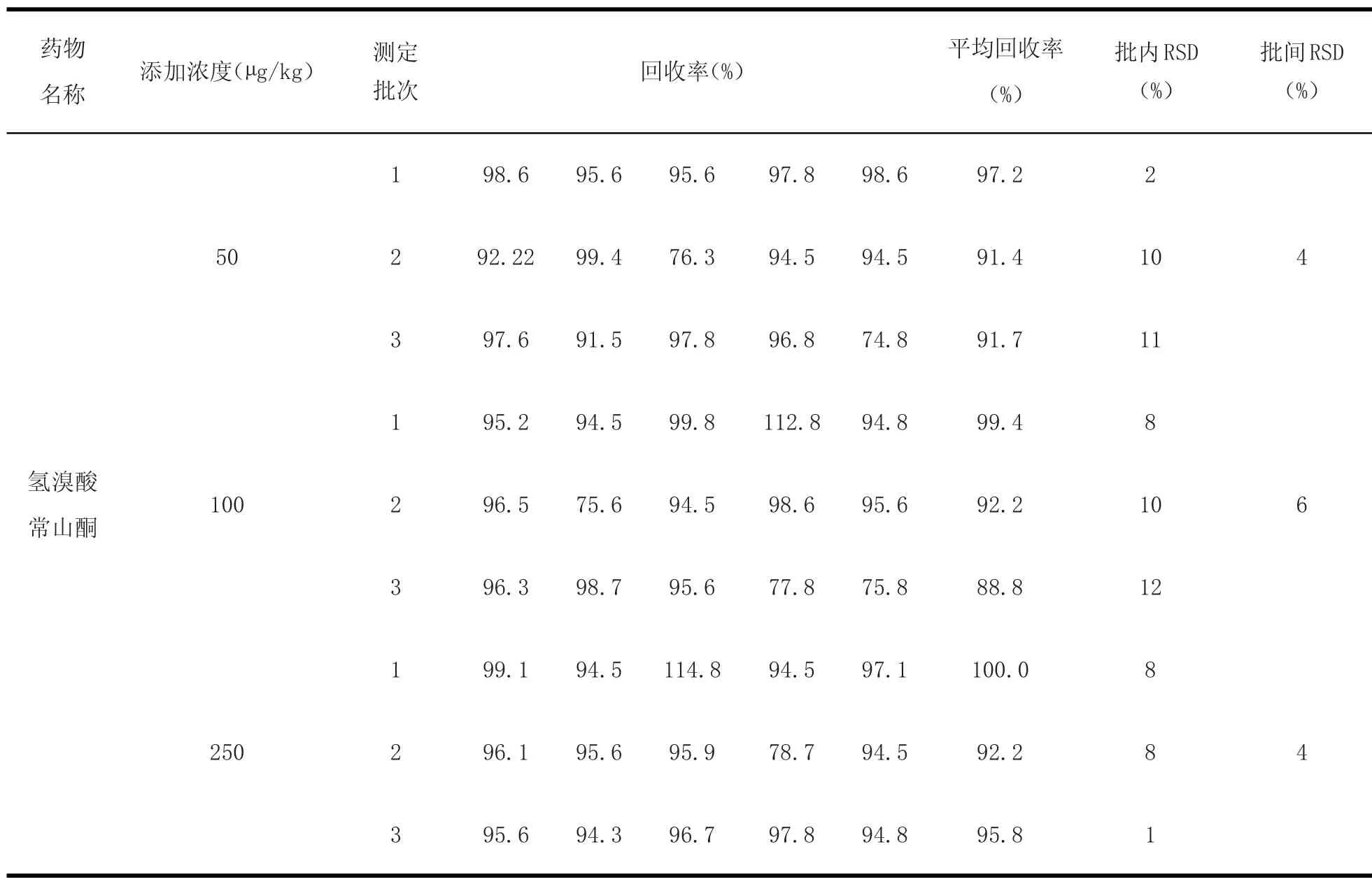
表4 空白浓缩饲料(产蛋期)中添加药物后得到的回收率及批内批间RSDTable4 Results of recovery experiments and RSD in concentrated feeds(egg laying period)(n=5)

表5 空白配合饲料(产蛋期)中添加药物后得到的回收率及批内批间RSDTab le5 Results of recovery experim ents and RSD in feeds(egg laying period)(n=5)

表6 空白预混合饲料(非产蛋期)中添加药物后得到的回收率及批内批间RSDTab le6 Resu lts of recovery experim ents and RSD in pre-m ixedd feeds(n=5)

表7 空白浓缩饲料(非产蛋期)中添加药物后得到的回收率及批内批间RSDTab le7 Resu lts o f recovery experim ents and RSD in concentrated feeds(n=5)
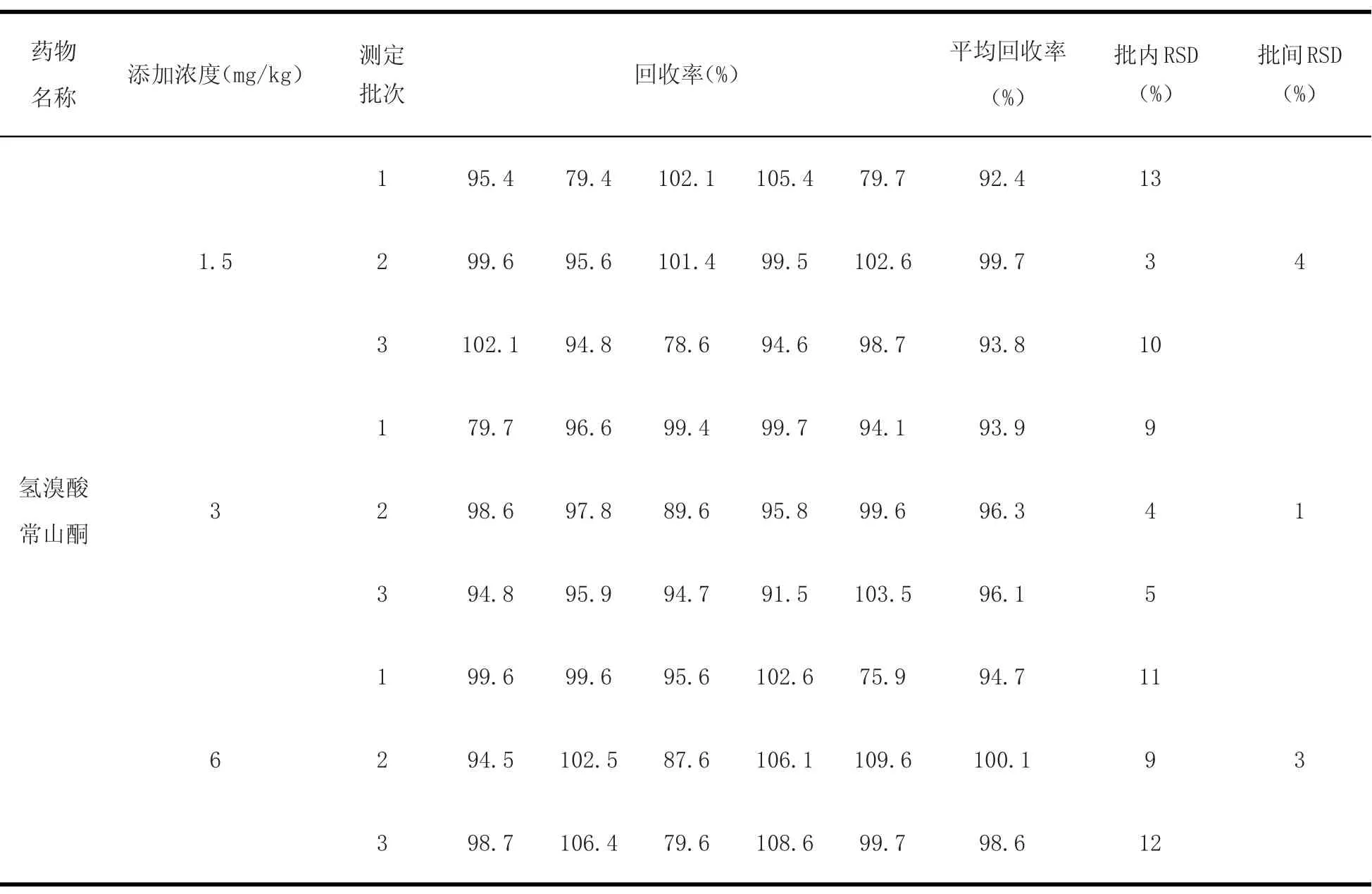
表8 空白配合饲料(非产蛋期)中添加药物后得到的回收率及批内批间RSDTab le8 Results of recovery experiments and RSD in feeds(n=5)
3 结论
本研究建立了一种定性与定量测定配合饲料、浓缩饲料、预混合饲料中氢溴酸常山酮残留量的分析方法。此方法稳定性强,重现性好,能够满足配合饲料、浓缩料、预混合饲料中氢溴酸常山酮的确证检测。
[1]李丹,孙雷,毕言峰,等.超高效液相色谱-串联质谱法测定鸡肉和牛肉中五种常用抗球虫药[J].中国兽药杂志,2013,47(4):38-41.
[2]曹莹,黄士新,沈富林,等.高效液相色谱法测定鸡肝组织中的氢溴酸常山酮残留[J].中国兽药杂志2004,38(4):11-13.
[3]候亚莉,汤明,郭利敏,等.鲟鱼肌肉中氢溴酸常山酮残留检测的高效液相色谱法[J].中国兽药杂志2006,40(5):15-18.
[4]吴宁鹏,杜向党,沈建忠.鸡肝脏和肌肉组织中常山酮残留的ELISA检测[J].畜牧兽医学报,2006,37(6)597-602.
[5]李银生,王秀红.液相色谱串联质谱法同时测定鸡肉或鸡蛋中常见抗球虫类药物残留[J].上海交通大学学报(农业科学版),2011,29(6):16-23.
Determ ination of Halofuginone in Feeds by Ultra Perform ance Liquid Chromatography-Tandem Mass Spectrometry
Wang Lina1,Wang Shu2,Tian Xiaol ing1,Liu Kai1
(1.Animal feed qual ity and safety of venterinary testing centre in Liaoning province,Liaoning Shenyang
110016;2.Liaoningprovincial foodandDrugAdminist rationAdminist rativeServiceCenter,Liaoning Shenyang 110016)
Amethod of Ul tra Per formance Liquid Chromatography-Tandem mass spect romet ry(UPLC-MS/ MS)for determination of Halofuginone in feeds was developed.The samples were extracted with acetonit ri le,cent ri fugated and then degreasing purif ied with n-hexane,dried with nitrogen,dissolved again using 50%methanol solution.Af ter UPLC-MS/MS,the resul ts shows that the l inear relationship is good(r2=0.999 1)when hydrobromic acid Changshan ketone concent ration range is at 20~500μg/L.As the added mat rix with concent rated feed,feed,premix,the recovery rate is 60%~120%,the detection l imit is 25μg/kg,the l imit of quanti f ication is 50μg/kg.Conclusion:this method has the advantages of high sensitivity,good speci ficity,simple operation,reliable resul ts,which can meet the detection and analysis of Halofuginone analysis in feed.
Halofuginone;Feeds;UPLC/MS/MS
S812.6
1672-9692(2015)05-0012-07
2015-03-24
王丽娜(1982-),女,硕士研究生,主要从事兽药残留检测工作。
